壳寡糖调节肠道菌群对大鼠急性胰腺炎治疗效果研究
2021-05-10罗娅媛白燕鸥
刘 旭, 赵 岩, 韩 浩, 罗娅媛, 白燕鸥
1.北部战区总医院 消化内科,辽宁 沈阳 110016;2.中国科学院金属研究所沈阳材料科学国家研究中心,辽宁 沈阳 110016
急性胰腺炎(acute pancreatitis,AP)是临床常见的急腹症,近年来发病率呈上升趋势[1]。有研究表明,AP病程中肠道微生态受到炎症应激的干扰,损伤肠屏障功能,导致肠黏膜通透性增加、细菌移位及内毒素血症,诱发机体二次感染,造成全身炎症反应综合征加重,多器官功能障碍,当AP发展为重症AP时甚至可导致患者死亡[2]。因此,针对AP患者肠道微生态的研究越来越受到关注。壳寡糖(chitooligosaccharide,COS)是壳聚糖或甲壳素通过化学或酶水解从虾和蟹壳等天然物种中提取而成[3],具有抗氧化、抗炎、抗菌和免疫调节特性[4]。多项研究表明,COS对肠道微生态紊乱有一定的治疗作用[5-9]。本研究构建AP大鼠模型并应用COS进行治疗,旨在探讨COS调节肠道菌群治疗大鼠AP的疗效。现报道如下。
1 材料与方法
1.1 实验动物 选取20只SPF级健康雄性6~8周SD大鼠为研究对象。大鼠体质量(300±10)g,购自浙江省医院动物实验中心。将大鼠常规喂食1周后,按照随机数字表法将其分为对照组与治疗组,每组各10只。
1.2 AP动物模型制备 大鼠于术前12 h禁食,自由饮水。腹腔注射戊巴比妥溶液(2 mg/100 g)麻醉。开腹后用3.5%牛黄胆酸钠(1 ml/1 000 g),以0.2 ml/min的速度沿胰胆管逆行注射,观察5~10 min后关腹。注射24 h内,观察大鼠焦虑、烦躁等表现,详细记录。造模成功后,治疗组给予10% COS灌胃,每8 h灌胃1次,每次5 ml,共进行24 h。对照组给予等剂量生理盐水灌胃。
1.3 样本采集 血清采集:单手固定大鼠,大鼠眼眶静脉采集血液,静置30 min后放入离心机,3 000 r/min离心10 min,取上清液。粪便采集步骤:固定大鼠,将大鼠直立,挤压大鼠肠道,促进排便,用ep管收集粪便。研究结束后,采用颈椎脱臼法处死大鼠,收集各组样本的胰腺、肠组织,将组织放入10%福尔马林溶液中固定,粪便置于冻存管后,立即放入-80℃保存,待进一步检测。
1.4 HE染色 两组胰腺、肠组织固定24 h后,按常规方法进行脱蜡、水合,将切片用二甲苯浸泡5 min,更换二甲苯后再浸泡5 min;无水乙醇中浸泡5 min;95%乙醇中浸泡5 min;85%乙醇中浸泡5 min;70%乙醇中浸泡5 min,磷酸盐缓冲液浸洗3次,每次3 min。浸入试剂盒染色。两组组织在生物倒置显微镜下观察。肠道组织病理评分以Chiu′s 肠组织损伤评分标准[10]为参考,胰腺组织病理评分以Schmidtt胰腺组织评分标准[11]为参考。
1.5 16S rDNA基因组的测序 参照粪便基因DNA提取试剂盒(广州美基生物科技有限公司)说明书抽提粪便菌群DNA,抽提所得DNA采用NanoDrop微量分光光度计检测和琼脂糖凝胶电泳进行质检。将质检合格的基因组DNA纯化后进行两轮聚合酶链式反应扩增。使用AMPure XP Beads 对第二轮扩增产物进行纯化,使用ABI StepOnePlus实时荧光定量聚合酶链式反应系统(Life Technologies,美国)进行定量,根据Novaseq 6000 的PE250 模式pooling 上机测序。
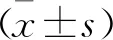
2 结果
2.1 两组大鼠血液检查结果比较 治疗组血清淀粉酶下降幅度与血清脂肪酶下降幅度大于对照组,差异有统计学意义(P<0.05)。见表1。

表1 两组大鼠血液检查结果比较
2.2 两组大鼠胰腺组织HE染色结果 HE染色结果显示,对照组大鼠胰腺组织结构紊乱,间质弥漫性水肿,胰腺腺泡未见大量坏死细胞,有少量出血灶,有少量炎症细胞浸润。治疗组大鼠胰腺组织结构比较清晰,见区域性水肿,无出血灶和坏死细胞,少量炎症细胞浸润。见图1。
2.3 两组大鼠肠道组织HE染色结果 对照组大鼠肠黏膜固有层严重水肿,绒毛顶端脱落,形态不规则,肠黏膜上皮细胞大量坏死,可见固有层裸露和绒毛脱落。治疗组大鼠肠黏膜固有层水肿较对照组轻,绒毛形态不规则及上皮细胞坏死较对照组减轻。见图2。
2.4 两组大鼠粪便中肠道菌群比较 治疗组veillonella菌属、Ruminiclostridium菌属、Prevotellaceae_UCG_001菌属、Parabacteroides菌属、Odoribacter菌属、Muribaculum菌属、Lachnospiraceae_UCG-006菌属、Helicobacter菌属显著多于对照组,差异有统计学意义(P<0.05)。见图3。
3 讨论
AP病程中常因肠道供血减少等因素导致肠道微循环障碍[12],损伤肠道黏膜屏障功能。AP还常伴有肠道蠕动减少甚至消失,肠道正常的清道夫功能减弱,致病菌数量增加,诱发肠道菌群失调[13]。肠道黏膜屏障受损、肠道动力减退、肠内菌群失调及宿主免疫功能受损等可导致细菌移位的发生[14],进而引起胰腺或胰周组织坏死感染,加重病情,甚至危及生命。因此,针对AP肠道微生态的治疗越来越受到临床关注。

图1 两组大鼠胰腺组织HE染色结果(a.对照组;b.治疗组;HE×400)

图2 两组大鼠肠道组织HE染色结果(a.对照组;b.治疗组;HE×400)

图3 两组大鼠造模24 h后肠道菌群比较
国际医学营养食品学会将COS称为除糖、蛋白质、脂、维生素和无机盐之后的“第六大生命要素”[15]。针对此类要素对肠道微生态的研究已逐渐开展[6-9]。本研究结果显示,经过灌胃法给予COS后,构建的大鼠AP动物模型血清淀粉酶、脂肪酶恢复更快,胰腺组织的炎症表现更轻,证明了其对AP的治疗作用;进一步针对大鼠肠道的检查发现,COS治疗组大鼠的肠道黏膜的炎症表现优于对照组;粪便菌群研究显示,COS治疗24 h后大鼠粪便中的多个菌属数量均明显多于对照组。因此,笔者分析COS治疗大鼠AP的机制可能是应用COS增加了AP大鼠肠道菌群的多样性和丰富性,更好地调控了肠道菌群的平衡,进而降低了有害菌的数量,保护了肠道黏膜屏障。
综上所述,COS灌胃对大鼠AP有一定的治疗作用,且可能与其通过调节肠道菌群、保护肠黏膜屏障作用有关。但由于肠道菌群的纲、门、科、属、种分类繁多,本研究仅从菌属层面探讨了两组AP大鼠的肠道微生态变化。因此,仍需要通过进一步更全面、深入的研究予以证实。
