浓香型大曲中降解生物胺菌株的筛选及应用
2021-05-10曾玉雪罗惠波余东黄丹郭辉祥邹永芳
曾玉雪,罗惠波,3,余东,黄丹,3,郭辉祥,邹永芳*
1(四川轻化工大学 生物工程学院,四川 宜宾,644000)2(舍得酒业股份有限公司, 中国生态酿酒产业技术研究院,四川 遂宁,629200) 3(酿酒生物技术及应用四川省重点实验室,四川 宜宾,644000)
生物胺(biogenic amines,BAs)是一类低分子质量的含氮有机碱,具有脂肪族、芳香族和杂环结构[1],是细胞内正常的活性成分[2]。游离氨基酸经脱羧酶作用和醛被胺化作用后生成生物胺,在胺氧化酶作用下被氧化降解[3-4]。微量的生物胺对身体有益,促进人体新陈代谢和生长发育,但过量摄入时胺氧化酶活性不足,将引发一系列疾病反应产生毒害作用,尤其解毒机制有缺陷的人易受到威胁[5-7]。常见的生物胺如组胺、酪胺、色胺和β-苯乙胺的中毒症状包括恶心、发热、出汗、心悸和皮疹等[8]。
生物胺存在于各种食物中,如鱼类、肉类、酒类等发酵制品及水产品等富含蛋白质和氨基酸的食品[9]。白酒生产原料中含有丰富的蛋白质,发酵过程中会被降解为游离氨基酸,在氨基酸脱羧酶的作用下会形成大量的生物胺,影响了白酒的安全性[10]。白酒中生物胺的相关研究较多。杜木英等[11]通过自动氨基酸分析研究白酒发酵过程中生物胺的动态变化,仅鉴定了少数生物胺。温永柱等[12]利用液液萃取和气相色谱-质谱联用技术完成了白酒中生物胺的定性研究,首次在白酒中检测出9种生物胺,腐胺、尸胺、甲胺、乙胺、吡咯烷、异戊胺、环己胺、环庚胺、环戊胺,采用反相高效液相色谱法进行定量分析,得出吡咯烷含量最高[13]。范文来等[14]发现改变酒醅发酵和蒸馏过程可以控制生物胺含量,以蛋白质含量较低的谷物作酿酒原料也能降低白酒中生物胺含量;另外,也可通过在发酵底物曲药、酒醅中选择无氨基酸脱羧酶活性或添加有胺氧化酶和胺脱氢酶活性的微生物来降低白酒中生物胺的含量[15]。
食品中生物胺的控制方法主要有辐照、控制卫生及使用添加剂,在发酵食品中通过添加降解生物胺的微生物从而降低其生物胺含量的方法愈来愈受重视。目前已报道的文章主要是从泡菜[16]、臭豆腐[17]、豆瓣酱[18]以及发酵肉制品[19]筛选出具有降解生物胺的菌株,而关于酒曲中降解生物胺菌株的研究很少。因此,从酒曲中筛选出降解生物胺的菌株,对生产出更健康安全的酒产品具有重要的意义。
1 材料与方法
1.1 材料与仪器
1.1.1 培养基
YPD琼脂培养基:1%酵母膏、2%蛋白胨、2%葡萄糖、2%琼脂(均为质量分数)。
YPD肉汤培养基:1%酵母膏、2%蛋白胨、2%葡萄糖(均为质量分数)。
YPD小麦浸提液培养基:150 g小麦用1 L去离子水浸泡过夜,煮沸60 min,4层纱布过滤得到小麦浸提液,按YPD肉汤培养基配方配制YPD小麦浸提液培养基,分装,250 mL三角瓶的装液量为50 mL,灭菌冷却。
1.1.2 化学试剂
腐胺盐酸盐、尸胺盐酸盐、甲胺盐酸盐、乙胺盐酸盐、吡咯烷、异戊胺、环己胺、环庚胺(纯度均>98%)、丹磺酰氯(dansyl chlorie,DNSCI),美国sigma公司;环戊胺(纯度为98%),日本TCI公司;乙腈、甲醇(均为色谱级)、丙酮、乙醚(均为分析纯),成都市科隆化学品有限公司;氯化钠、碳酸氢钠、盐酸、氢氧化钠、三氯乙酸(均为分析纯),天津市致远化学试剂有限公司;酵母浸出粉胨葡萄糖肉汤培养基、酵母浸出粉胨葡萄糖琼脂培养基,北京奥博星生物技术有限责任公司;超纯水,由电阻率为18.25 Ω的仪器制备。
1.1.3 仪器与设备
LEICA DM500型光学显微镜,德国Leica有限公司;1260 Infinity型高效液相色谱仪,美国Alilent有限公司;BF-2000M型氮气吹干仪,青岛科迪博电子科技有限公司;HWS-12型电热恒温水浴锅,上海齐欣科学仪器有限公司;STARTER2100型酸度计,美国OHAUS仪器有限公司;BSC-400型恒温恒湿箱,上海博迅实业有限公司医疗设备厂;QL-902涡旋仪,海门市其林贝尔仪器制造公司。
1.2 实验方法
1.2.1 生物胺降解菌的筛选
1.2.1.1 生物胺降解菌的初筛
称取25 g大曲样品到225 mL无菌生理盐水中,涡旋振荡1 min;吸取25 mL上清液至225 mL无菌生理盐水中,再依次吸取1 mL~9 mL无菌生理盐水,制成10-1、10-2、10-3、10-4、10-5、10-6、10-7梯度稀释液,然后在10-3、10-4、10-5、10-6分别吸取100 μL至YPD琼脂培养基中进行涂布,28 ℃培养24 h。挑取不同菌落形态、大小、质地、颜色、透明度、生长位置的单菌落,以平板划线法反复分离纯化,直至得到纯菌落,菌株斜面保藏于4 ℃,用于生物胺的降解研究。
1.2.1.2 生物胺降解菌的复筛
将大曲中筛选的微生物斜面于28 ℃活化24 h,添加9 mL无菌生理盐水制成菌悬液,血球计数板调整菌浓至数量级为106个/mL,接种至含有腐胺、尸胺、甲胺、乙胺、吡咯烷、异戊胺、环己胺、环庚胺、环戊胺100 mg/L的50 mL YPD液体培养基中,接种量为6%,接种菌株为样品组,不接种菌株为空白对照组,按酵母菌一般特性设置培养条件,28 ℃、180 r/min培养2 d。采用高效液相色谱法测定其生物胺的含量,选出生物胺降解率最高的菌株,降解率计算如公式(1)所示:

(1)
1.2.2 生物胺含量的测定
采用外标法测定生物胺含量,生物胺标准溶液及相关试剂的配制参考GB 5009.208—2016《食品中生物胺的测定》[20]。
1.2.2.1 标准曲线的制作
按1 000 mg/L称取一定量的生物胺配制标准溶液,然后分别吸取1 mL各生物胺单组分标准储备溶液,置于同一个10 mL的容量瓶中,用0.1 mol/L盐酸溶液定容,配成100 mg/L的生物胺标准混合使用液。生物胺标准混合使用液进行梯度稀释,质量浓度分别为80、60、40、20、10、5 mg/L,得到生物胺标准系列溶液。
1.2.2.2 发酵液中生物胺含量的测定
衍生方法参考GB 5009.208—2016《食品中生物胺的测定》[20]和 FRAS等[21]并稍作改动。取1 mL生物胺标准系列溶液于15 mL离心管中,依次加入1 mL饱和碳酸氢钠溶液,1 mL 2 mol/L的氢氧化钠溶液提供一个碱性环境,1 mL 10 mg/mL DNSCI溶液,涡旋混匀1 min,于40 ℃恒温水浴具塞暗处理30 min,15 min摇匀1次,取出,加入1 mL饱和氯化钠溶液,40 ℃恒温10 min以终止衍生化,取出冷却至室温,加入3 mL×2次乙醚,振荡2 min,静置分层后转移上层有机相至新的15 mL离心管,合并2次萃取液,40 ℃水浴氮气吹干。加入1 mL乙腈溶解残留物,振荡混匀后,过0.22 μm滤膜,待测定。
1.2.2.3 生物胺标准系列溶液的柱前衍生
样品前处理:取5 mL发酵液于15 mL离心管中,6 000×g离心20 min。取1 mL上清液衍生处理,同标品。
1.2.2.4 高效液相色谱条件
色谱条件参考陈智毅等[22]的方法,并稍作修改,色谱柱为Angilent ZORBAX SB C18柱(4.6 mm×250 mm,5 μm),紫外检测波长254 nm,柱温30 ℃,进样量10 μL,流速0.4 mL/min,流动相A乙腈、B超纯水,梯度洗脱程序见表1。

表1 梯度洗脱程序表Table 1 Gradient elution program list
1.2.3 生物胺降解菌的鉴定
1.2.3.1 生物按降解菌的形态学鉴定
观察菌落颜色、大小、形态、质地、透明度、边缘整齐性、表面光滑性等,光学显微镜观察细胞形态,根据《酵母菌的特征与鉴定手册》[23]确认其为酵母菌。
1.2.3.2 生物胺降解菌的分子生物学鉴定
提取降解率最高的菌株基因组DNA的方法参考文献[24]所述并稍作改动,扩增引物为:NL1:5′-GCATATCAATAAGCGGAGGAAAAG-3′;NL4:5′-GGTCCGTGTTTCAAGACGG-3′,进行16S rDNA扩增,PCR程序条件为:94 ℃预变形4 min后进入以下循环,94 ℃变形45 s,55 ℃退火45 s,72 ℃延伸1 min,30个循环;70 ℃修复延伸10 min,40 ℃终止反应。扩增产物送至生工生物工程(上海)股份有限公司测序后,将所得序列在NCBI数据库进行BLAST序列对比,构建菌株系统发育进化树。
1.2.4 生物胺降解菌的生长特性研究
1.2.4.1 温度耐受性
(1)菌种斜面于28 ℃活化24 h后,用9 mL无菌生理盐水制成菌悬液,血球计数板计数并调整菌浓至1×106CFU/mL,按三角瓶装液量的6%接种至无菌小麦浸提液配制的YPD液体培养基,8层纱布封口;
(2)设置培养温度为25、30、35、40、45 ℃,于180 r/min 恒温振荡器培养48 h,再于YPD琼脂培养基平板上活菌计数,确定菌株奥默柯达酵母(Kodamaeaohmeri,HJM)的最高耐受温度。
(3)若在已设置培养温度中没有得到其具体耐受温度,则缩小温度范围继续试验。
1.2.4.2 乙醇耐受性
小麦浸提液配制YPD液体培养基,装液量为50 mL,灭菌后于无菌环境下加入乙醇,体积分数为6%、8%、10%、12%、14%,按体积分数6%的接种量接入菌液,然后在28 ℃、180 r/min培养48 h后平板活菌计数,确定HJM的最高耐受乙醇浓度。
1.2.4.3 酸耐受性
小麦浸提液配制YPD液体培养基,装液量为50 mL,用乳酸调节pH值为2、3、4、5、6,灭菌后按6%的接种量接入菌液,28 ℃、180 r/min培养48 h后平板活菌计数,确定菌株HJM的最高耐酸pH。
1.2.4.4 糖耐受性
小麦浸提液配制YPD液体培养基,装液量为50 mL,酵母直接利用葡萄糖,因此加入葡萄糖调节糖质量浓度为100、200、300、400、500、600 g/L,灭菌后按6%的接种量接入菌液,28 ℃、180 r/min培养48 h后平板活菌计数,确定菌株HJM的最高耐受糖浓度。
1.2.5 生物胺降解菌在固态发酵条件下对生物胺的降解
酵母的最适生长温度是28~30 ℃,本实验室监测浓香型大曲生产中温、湿度的变化趋势,发现28 ℃左右时对应湿度为90%左右[25],在实验室条件下以小麦为固态发酵基质测定该菌对生物胺的降解能力。称取一定量小麦,5%(质量分数)水进行润料4 h,粉碎呈2、4、6瓣,加入20%(质量分数)水,拌匀,以100 mg/L分别加入9种生物胺,再按5%的接种量加入菌液,以不添加菌液作对照,研究菌株HJM固态发酵条件下对生物胺的降解率,通过生长特性研究得到其最适生长温度,恒温恒湿培养2 d后测定其生物胺含量。另外,相同方法制作小麦固态发酵基质,不外加生物胺相同条件下培养2 d,以研究其本身是否含有生物胺。
发酵完成后,取10 g发酵样品到100 mL三角瓶中,加入20 mL 5%(质量分数)三氯乙酸溶液,30 ℃ 200 r/min 振荡30 min,转移上清液到50 mL容量瓶,重复1次,最后用5%三氯乙酸定容,取1 mL衍生,方法同标品。
1.3 数据分析
所有试验数据均使用 SPSS Statistic 25.0 软件进行分析,采用 Origin 2019b软件进行绘图,使用邓肯氏多重比较在5%水平下评估样品间的差异显著性。
2 结果与分析
2.1 生物胺标曲制作
采用高效液相色谱法测定生物胺含量,单标定性,混标定量,得到9种生物胺标准品混合液相色谱图,如图1所示。
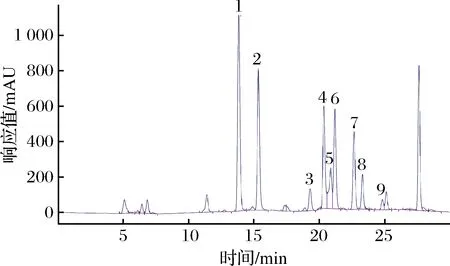
1-甲胺;2-乙胺;3-环戊胺;4-腐胺;5-环己胺;6-尸胺; 7-环庚胺;8-异戊胺;9-吡咯烷图1 九种生物胺标准品混合液相色谱图Fig.1 The mixed liquid chromatogram of 9 biological amines standard
9种生物胺的不同浓度采用高效液相色谱法测定其峰面积,以浓度为横坐标,峰面积为纵坐标,制作标准曲线,回归方程及相关系数如表2所示。9种生物胺在5~80 mg/L线性关系良好,相关系数均>0.99。
2.2 生物胺降解菌的筛选
从大曲中筛选出16株菌,编号为J1~J16,对其进行9种生物胺降解研究,其中J1~J9这几株菌的降解情况略好,其降解率如表3所示,编号为J5的菌株降解的生物胺种类最多,只有尸胺和环庚胺浓度在检测限以下无法测出,其生物胺降解率也显著高于其他菌株(P<0.05),其中对环己胺的降解效果最好,降解率达38.07%。因此,选择编号为J5的菌株进行后续试验研究。

表2 九种生物胺的回归方程和相关系数Table 2 Regression equations and R2 of 9 biogenic amines
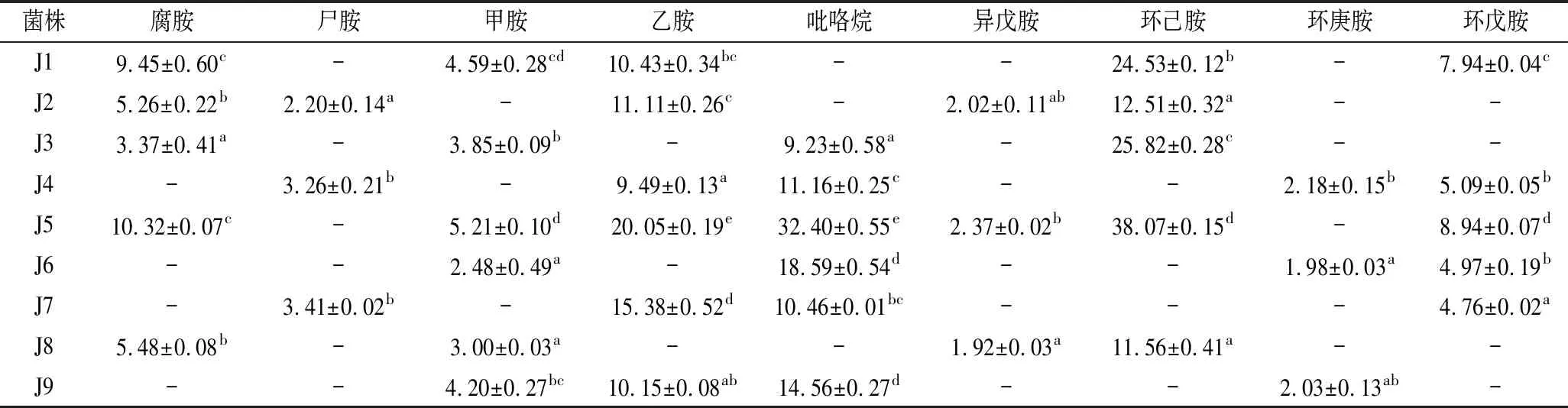
表3 菌株对生物胺的降解率 单位:%
2.3 生物胺降解菌的鉴定
2.3.1 生物胺降解菌的形态学鉴定
编号为J5的菌株对生物胺的降解效果最好,其在YPD琼脂培养基上的菌落形态和光学显微镜及电镜扫描下的细胞形态特征如图2所示。菌落呈圆形、颜色略黄、不透明、表面光滑、边缘整齐,但在斜面培养时间过长,其边缘会出现褶皱状;其菌体呈圆形,出芽繁殖。
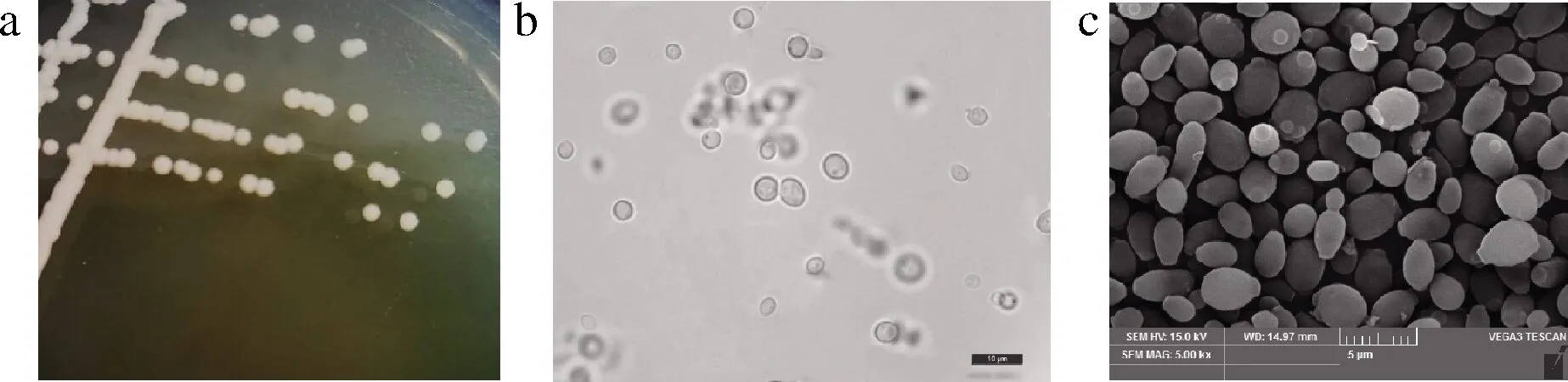
a-菌落形态;b-光学显微镜图;c-电镜图图2 酵母菌J5的形态学特征Fig.2 Morphological characteristics of strain J5
2.3.2 生物胺降解菌的分子生物学鉴定
提取编号为J5的菌株基因组DNA,通过PCR扩增得到J5的16S rDNA序列,测序得到序列长度为498 bp。将该菌株16S rDNA的测序结果在NCBI GeneBank中BLAST核酸库进行对比,得到该菌株与Kodamaeaohmeriisolate K68的同源性高达100%。该菌株与模式菌株GU597323.1及其他近源菌株的16S rDNA构建系统发育进化树如图3所示,得到其与序列号为MK414670.1的奥默柯达酵母(K.ohmeri)的距离最近。因此,可初步确定编号为J5的菌株为奥默柯达酵母,将其命名为K.ohmeriHJM。

图3 菌株J5的系统发育树Fig.3 The phylogenetic tree of strain J5
2.4 K.ohmeri HJM的生长特性研究
K.ohmeriHJM在不同条件下的生长状况如图4所示。由图4-a可知,K.ohmeriHJM在30 ℃时生长最好,与其他温度差异极显著(P<0.01),40 ℃生长减少,45 ℃时停止生长。须在此范围之间继续试验,才可得其最高耐受温度。继续试验得到43 ℃时,菌株少量生长,44 ℃时不再生长,即得到K.ohmeriHJM的最高耐受温度为43 ℃。
由图4-b可知,随着乙醇浓度增加菌株生长总数减少,乙醇体积分数为12%时,菌株生长较少,14%时停止生长。继续试验得乙醇体积分数为13%时,只有少许菌株生长,即得K.ohmeriHJM的最高耐受乙醇体积分数为14%。
由图4-c可知,pH值为6时菌株生长情况最好,随着环境酸度增加菌株生长总数减少,pH值为3时有少许菌株生长,pH值为2时菌株停止生长,即得K.ohmeriHJM最高耐酸pH值为2。表明K.ohmeriHJM在过酸环境下生长受到抑制,但具有一定耐酸性,在酸性环境下能生长。
由图4-d可知,随着葡萄糖浓度的增加菌株生长减少,500 g/L时相对减少,但其总数依然有2.95×108CFU/mL,生长状况良好。600 g /L时,依然有很多菌株生长,即得到K.ohmeriHJM有较高的糖耐受性。
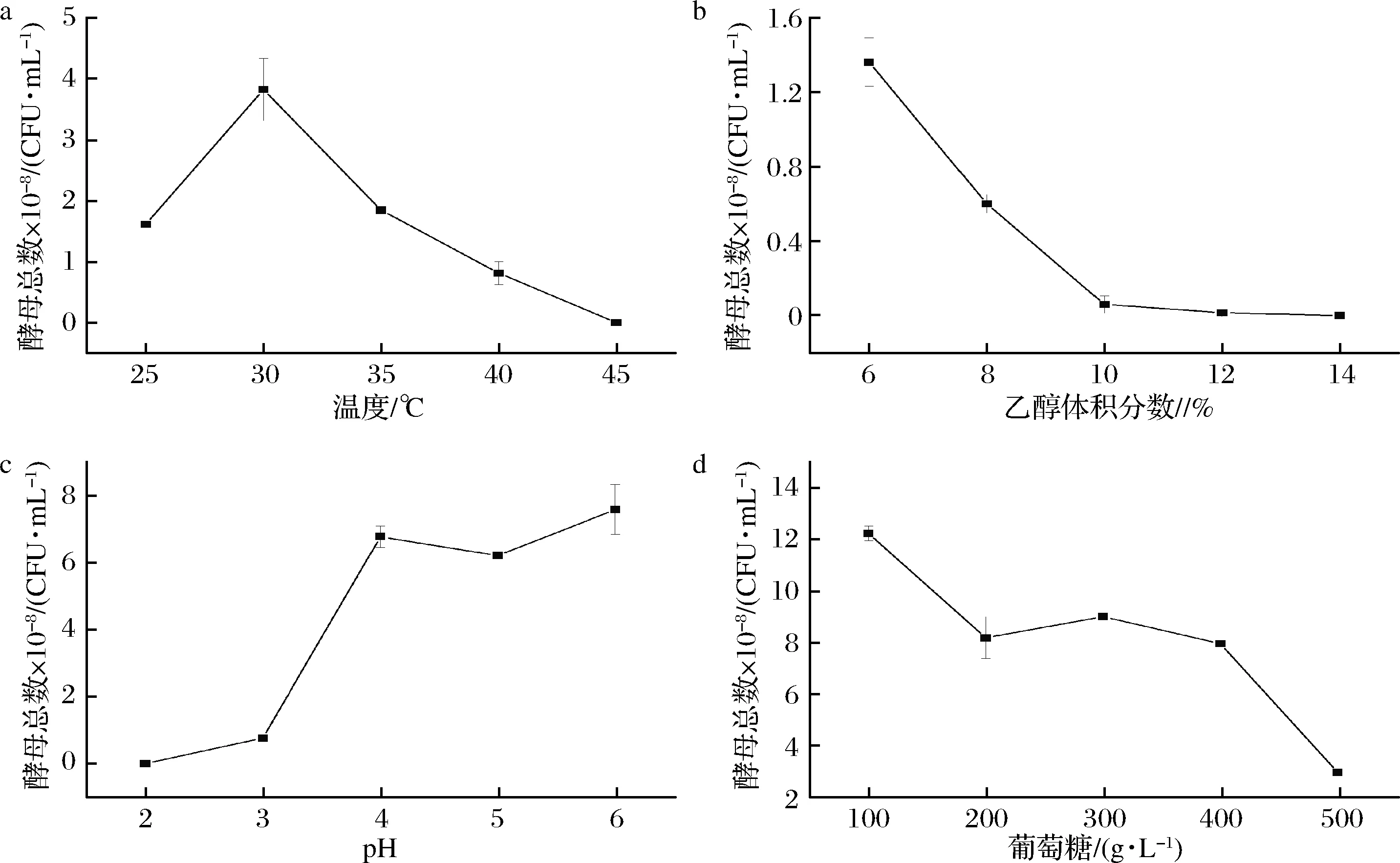
图4 不同条件对K.ohmeri HJM生长的影响Fig.4 The effect of different conditions on the growth of K.ohmeri HJM
2.5 K.ohmeri HJM在固态发酵中的应用
2.5.1 小麦固态发酵基质中生物胺的含量
研究K.ohmeriHJM的温度耐受性,于25~30 ℃ 分别培养48 h计数,得到其最适生长温度为28 ℃。制作小麦固态发酵基质,不添加生物胺不接种菌液,于28 ℃、90%下培养2 d,测定其生物胺含量,结果如表4所示。可得到小麦基质中含有一定量生物胺,其中吡咯烷含量最高,达到133.89 mg/kg,这与温永柱等[13]研究的白酒中吡咯烷含量最高一致。

表4 小麦发酵基质中生物胺的含量 单位:mg/kg
2.5.2 生物胺降解菌在小麦基质中对生物胺的降解
小麦固态发酵基质中含有一定量生物胺,但为更好地表征K.ohmeriHJM在固态发酵条件下对生物胺的降解能力,向小麦基质中添加生物胺,接种菌液相同条件下进行发酵,测定其生物胺含量如图5所示。与未添加生物胺的小麦固态发酵基质中生物胺的含量一致,吡咯烷含量最高,其次是环戊胺。样品组中的生物胺含量显著低于空白组,尤其是吡咯烷和环己胺,二者样品组合空白组中的含量有极显著差异,表明K.ohmeriHJM在固态发酵条件下降解生物胺的效果较好。

图5 固态发酵条件下样品中生物胺的含量Fig.5 The contents of biogenic amines in samples under solid-state fermentation conditions注:“*”表示样品组与空白组相比有显著差异(P<0.05), “**”表示与空白组相比有极显著差异(P<0.01)
K.ohmeriHJM在固态发酵条件下对不同生物胺的降解率如表5所示。环庚胺在检测限以下无法测出,除此之外,其他几种生物胺的降解率多在30%以上,对环戊胺的降解能力最强,降解率达到66.07%,其次是吡咯烷的降解率达到63.42%。固态发酵条件下,K.ohmeriHJM对生物胺的降解效果比在液态环境中更好,这可能是因为K.ohmeriHJM在固态环境中利用小麦基质中的营养生长更旺盛,能更好地发挥作用降解生物胺。
3 结论
该研究从大曲中分离出16株酵母菌,将其接种到含有9种生物胺的小麦浸提液配制的YPD液体培

表5 K.ohmeri HJM在固态发酵中对生物胺的降解率 单位:%
养基培养48 h,对其进行生物胺降解研究,得到1株降解效果最好的编号为J5的酵母菌。对其进行形态学和分子生物学鉴定,得到其为奥默柯达酵母(K.ohmeri),将其命名为K.ohmeriHJM。在固态发酵条件下,不添加生物胺不接种菌液,直接将小麦发酵基质进行培养,测定其中含有一定量的生物胺,吡咯烷含量最高。将奥默柯达酵母接种到小麦固态基质进行培养,以未接菌种为空白对照,得到其对几种生物胺的降解率分别为腐胺(39.19±0.08)%、尸胺(33.77±0.06)%、甲胺(32.44±0.06)%、乙胺(23.39±0.06)%、吡咯烷(63.42±0.02)%、异戊胺(49.83±0.07)%、环己胺(49.73±0.03)%、环戊胺(66.07±0.08)%,尤其对环戊胺、吡咯烷的降解效果很好。
该菌株对腐胺、尸胺、甲胺、吡咯烷等都有较好的降解效果,可以降低以小麦为原料制作的酒曲中生物胺的含量,在白酒酿造中曲药的意义重大,因此降低曲中生物胺含量可为安全生产白酒提供保障。本研究从大曲中分离出降解生物胺的菌株,可为白酒中生物胺的调控提供一定参考价值。另外,对K.ohmeriHJM进行生长特性研究,得到其具有较高的耐糖性、耐酸性和耐乙醇性,推测其在白酒酿造的酸性环境中亦能较高效地降解生物胺。
