食品中诺如病毒检测技术研究进展
2021-05-10廖小艳陈丽丽白亚龙
廖小艳 陈丽丽 白亚龙
(1. 上海市农业科学院农产品质量标准与检测技术研究所,上海 201403;2. 南华大学公共卫生学院卫生检验系,湖南 衡阳 421000;3. 上海科立特农产品检测技术服务有限公司,上海 201403)
诺如病毒(Norovirus,NoV)属于杯状病毒科诺如病毒属,基因组长度约为7.4~7.7 kb,为无包膜单股正链RNA病毒,能广泛地感染人、猪、鼠、牛等多种哺乳动物,是主要的食源性致病原,可引起以呕吐、腹泻为主的急性胃肠炎[1-3]。NoV包含3个开放阅读框(Open Reading Frames,ORFs),分别编码非结构蛋白、衣壳蛋白(Virus particle 1,VP1)、微小结构蛋白。VP1由壳区(Shell domain,S区)和突出区(Protruding domain,P区)组成,P区又包含P1和P2亚区,P2亚区含有主要的中和表位,呈高度易变性[4-5]。NoV的基因型和基因组之间存在很大的抗原差异性,根据衣壳蛋白区和RNA多聚酶区核酸序列,可将NoV分为10个基因组(Genogroup,GⅠ~GⅩ),其中GⅡ型是引起人体急性胃肠炎最主要的基因群,约有85%的NoV感染由GⅡ型导致[6]。NoV在世界范围内均有流行,具有季节性高发、全人群普遍易感、高度变异、感染性强等特点。在中国,约有15%腹泻儿童的血清抗体中检出了诺如病毒,自2014年以来,诺如病毒造成的公共卫生事件显著增加,极大地加重了疾病负担[7]。
NoV主要经粪—口途径传播,污染的食品(如贝类等水产品、蓝莓、生菜等果蔬)是常见的传播媒介。食品中NoV含量低,且基质复杂,富含各种PCR抑制物,导致NoV难以富集检出。目前,病毒富集纯化仍是NoV检测的关键点及难点,在尚无特效药物及疫苗的情况下,开发高效准确的检测方法对防止疾病传播十分必要。文章拟阐述诺如病毒前处理环节及检测的最新研究成果,囊括富集技术、核酸检测、免疫学检测,以及生物传感器等。
1 诺如病毒的富集
食品中NoV含量低,且基质复杂,富含各种PCR抑制物,病毒富集纯化一直是NoV检测的瓶颈。有机絮凝沉淀法、膜过滤法、超滤浓缩等技术是目前NoV富集的主要方法,但这些富集方法是非特异性的,需要不断优化浓缩条件,且各类分子检测抑制物会随NoV的富集而富集[8]。近年来,免疫(抗原—抗体)结合、病毒—受体结合、核酸适配体等特异性的NoV富集手段成为研究热点。
1.1 基于抗原抗体反应的富集技术
免疫磁珠是一种基于抗原抗体反应的特异性病毒富集方法,借助磁珠偶联的方式,利用针对特征性NoV的单克隆抗体或多克隆抗体来捕获病毒颗粒,可从复杂的基质中高效分离和浓缩NoV[9]。Park等[10]通过将克隆表达出的GI-1型和GII-4型NoV的衣壳蛋白对兔进行免疫,制备了针对特定基因型NoV衣壳蛋白的多克隆抗体,并将该多克隆抗体与磁珠偶联获得了相应的免疫磁珠。利用上述制备的免疫磁珠联合RT-PCR法对人工染毒草莓中GI-1型和GII-4型NoV进行检测,其回收率分别为29.50%,14.14%,检出限低至3~7个RT-PCR单位。Lee等[11]利用免疫磁珠分离(磁珠上偶联兔抗人NoV多克隆抗体)和量子点分析技术建立了一种检测新鲜生菜中诺如病毒的方法。该试验比较了免疫磁珠分离和聚乙二醇病毒沉淀两种方法的富集效率,两种方法均从人工染毒的NoV生菜样品中产生了可检测到的扩增片段(213 bp),但免疫磁珠法以10 min的孵育促进病毒沉淀,而聚乙二醇沉淀法需要更长的孵育时间(3 h)和额外的高速离心来沉淀病毒。
虽然免疫磁珠法可高效特异性富集NoV,但NoV抗原的高度变异性使其无法富集所有的NoV,往往需要与多种抗体或多价抗体偶联以提高免疫磁珠法的适用范围及性能[12]。
1.2 基于病毒—受体结合的富集技术
组织血型抗原(Histo-blood group antigens,HBGA)是一类分布于外周组织,可与人源NoV结合的受体,主要包括ABO、 Lewis和“分泌型”系统3种[13]。猪胃黏蛋白(Porcine gastric mucin-conjugate,PGM)被证明含多种HBGA(A型、H1型和Lewis抗原),可与NoV广谱结合[14]。Tian等[15]采用PGM偶联磁珠以浓缩人工染毒食品样本(牡蛎、草莓、树莓和生菜)中NoV,该方法不仅提高了灵敏度,还可有效去除RT-PCR抑制剂。Wang等[16]通过将PGM包被在PCR反应容器上以捕获分离病毒,并评估了热和氯处理对NoV灭活的影响。此外,Suresh等[17]比较了ISO/TS 15216-1:2017方法与猪胃黏蛋白包被磁珠法(Porcine gastric mucin coated magnetic beads,PGM-MB)的病毒提取效率,并结合热变性提取RNA,用于检测人工染毒的新鲜海藻、罗勒、薄荷和菠菜中的人源NoV。数据表明,与ISO/TS 15216-1:2017相比,PGM-MB不仅能显著缩短检测时间,回收率也明显升高,PGM-MB法从1∶10稀释倍数的海藻中提取RNA的回收率高达(52.3±12.9)%。
HBGA可与绝大部分的人源诺如病毒结合,并且可以去除非致病性病毒颗粒的干扰,在NoV前处理中具有广泛的应用前景,但HBGA特异性较低,与其他病毒(如轮状病毒)之间也存在结合[18-19]。
1.3 基于适配体的富集技术
核酸适配体是一段可特异性识别并捕获目标分子的核酸片段,为NoV富集提供了很好的思路[12]。与抗体相比,适配体具有成本较低、易于化学合成和修饰、不引起免疫反应等优点。此外,通过核酸适配体对NoV颗粒进行特异性捕获,可采用简单的洗涤去除分子检测抑制物及样品基质,提高检测的灵敏度,避免假阳性、假阴性结果的产生[20]。Escudero-Abarca等[21]利用指数富集的配体系统进化技术筛选出4种能与GⅡ 2型人源诺如病毒广泛反应的ssDNA核酸适配体,分别命名为适配体19、21、25和26,其中适配体25与病毒样颗粒的结合亲和力在1~5 mg/mL范围内与市售抗体相当。当使用适配体25标记的磁珠结合RT-qPCR对人工污染的生菜中的NoV进行回收和检测时,结果显示,该方法检测下限为10个RNA拷贝数/3 g生菜,捕获率为2.5%~36.0%。
虽然适配体能特异性捕获NoV颗粒,但目前缺乏能够与所有NoV基因型广泛结合的适配体,开发能与更多NoV基因型结合的适配体是解决问题的关键[12]。且与抗体、HBGA受体等相比,利用适配体对NoV进行特异性捕获的研究也要少得多,研究者可进行相关研究,拓展这方面的应用。
2 核酸检测
目前NoV检测方法主要有电镜法、免疫学检测和核酸分子检测技术等。常规电镜观察法具有灵敏度较低、对操作人员技术要求高、检测费用高等缺点,极大地限制了其应用,现已逐渐淘汰,不再作为主流的检测手段。NoV是生命物质,随着分子生物学的长足发展,基于核酸的检测得到了广泛的研究与应用。基于核酸分子的NoV检测方法主要有常规RT-PCR、巢式PCR、多重PCR、RT-qPCR,以及新兴的数字PCR和二代测序技术。由于常规RT-PCR、巢式PCR、多重PCR等存在一些缺陷,逐渐被其他的方法所替代,在此主要对NoV检测的“金标准”RT-qPCR及新兴的PCR技术展开综述。
2.1 RT-qPCR
RT-qPCR允许在单一反应中进行信号放大和扩增确认,通过实时监测荧光信号的增强达到定量的目的,具有灵敏度较高、特异性强等特点,是目前NoV检测的“金标准”[22]。Rupprom等[23]对基于TaqMan探针,用于定量检测GI和GII型NoV的RT-qPCR检测法进行了评估。该方法对GII DNA标准品的灵敏度达103DNA拷贝数/mL,且未与其他常见肠道病毒产生交叉反应,具有良好的分析灵敏度。此外,Brassard等[24]采用RT-qPCR对田间灌溉草莓进行了NoV检测,并评估其污染来源。该研究采用超滤浓缩的前处理方法,结果显示GI型NoV 检测范围为3.0×103~5.0×101particles/g,这与其他新鲜产品(叶绿色和浆果)的研究一致。莫雪梅等[25]根据GII型NoV保守区域设计引物,建立了一种基于SYBR Green I染料的RT-qPCR方法,并用于贝类中NoV检测。该方法检测范围为102~106拷贝,对甲肝病毒、轮状病毒、星状病毒等无交叉反应,灵敏度、特异性较好。
RT-qPCR是目前NoV检测的常规方法,灵敏度较高、特异性强,但RT-qPCR无法区分致病性和非致病性诺如病毒颗粒,且食品样品基质中存在的一些分子检测抑制剂也会对检测结果产生影响。所以,有一些研究会通过与其他技术结合消除此类问题,比如先用PGM对有活性的病毒粒子进行分离,然后进行RT-qPCR[15]。
2.2 数字PCR
微滴式数字PCR(Droplet digital polymerase chain reaction,ddPCR)对样品进行微滴化处理,含有待测靶核酸分子的微滴产生荧光信号,判读为1,否则为0,根据阳性微滴的比例及泊松分布原理实现目标待测物的检测。ddPCR克服了实时PCR需要依赖外部标准曲线和Ct值的局限性,逐渐成为一种替代的RT-qPCR的分析方法。作为一种第三代PCR技术,ddPCR具有灵敏度更高、不受基质抑制的优势,是精准检测含有大量PCR抑制剂的食品和环境样品中低水平NoV的理想方法[26-27]。陈嘉茵等[28]利用RT-ddPCR技术对不同浓度人工染毒生菜样品中的GII型NoV进行了检测,结果显示,RT-ddPCR检测范围为2.12~8.47×104拷贝/μL,其扩增效率为95.44%。在回收率检测试验中,抑制剂对结果无显著性差异。该方法可避免抑制剂造成的“假阴性”结果,对低浓度受污染样品进行有效检测。王雪晴等[29]也采用RT-ddPCR建立了一种检测冷冻草莓中GⅠ型、GII型NoV方法。该方法在10-6稀释倍数的标准品中,实测拷贝数浓度低至1.8拷贝/μL,其灵敏度比RT-qPCR法高一个数量级。但当样品浓度不在检测限范围内时,会因阈值线的设置的差别产生结果偏差[30]。此外,Tan等[31]采用一步法RT-ddPCR,以公开的引物和探针组JJV1F/JJV1R/JJV1P、JJV2F/COG2R/RING2分别用于检测牡蛎中GⅠ 型、GII型NoV,并与RT-qPCR进行比较。结果显示,RT-qPCR检测NoV的灵敏度为1.88×102拷贝/μL,而RT-ddPCR定量检测NoV的灵敏度为1.88×101拷贝/μL,是RT-qPCR的10倍。
越来越多的研究开始将数字PCR用于食源性致病微生物的检测,并且显示出一定的优势,但目前仪器价格昂贵制约着该技术的实际应用,相信随着科技的发展,仪器成本的下降,将会得到普及。
2.3 二代测序技术
二代测序(Next-generation sequencing,NGS)是基于PCR和基因芯片发展起来的一种DNA测序技术,该方法通过捕捉DNA复制过程中新添加的碱基所携带的特殊标记来实现测序,具有高通量、超高速、低成本的特点[32]。常见的技术平台包括Roche的454 FLX、Illumina的Miseq/Hiseq等。常规的RT-PCR之后NGS只能简单地检测NoV RNA的存在,无法区分感染性和非感染性病毒颗粒。为避免非感染性病毒颗粒造成的假阳性,可对样品进行RNase预处理。Imamura等[33-34]结合RNase酶解预处理和NGS技术对牡蛎样品中基因型进行鉴定,证明了牡蛎中传染性NoV的多样性。牡蛎中含有几种NoV基因型(GII.3、GII.4、GII.13、GII.16和GII.17),不同基因型的检出率和比例不同。Bartsch等[35]为了提供用于浆果中病毒检测和鉴定的新方法,对曾造成大规模NoV肠胃炎暴发的草莓进行了NGS测试。研究证明,使用NGS技术可以鉴定自然污染的冷冻浆果中的人类致病性病毒,此次试验产生了约2 900万个序列,仅两个序列显示出与人源NoV同源。
二代测序技术可对诸多常见及罕见的NoV变异序列进行类别鉴定与分析,对于分型溯源具有不可比拟的优势。然而,该方法仍需进一步优化以减少干扰序列,使得能够在高度丰富的核酸的背景下方便且可再现地检测出少量的人类致病性病毒序列,如通过对样品进行DNases处理。
3 免疫学检验
免疫学检验主要基于抗原抗体反应,即用特异性的抗体来检测样本中的NoV。根据用于检测或量化分析物的标记方法,可以将免疫学检验分为不同的类型,目前用于NoV检测的免疫学方法主要有ELISA和免疫层析技术。
3.1 ELISA
ELISA是一种常见的免疫学检测技术,它通过将抗原或抗体结合在固相载体表面,再加入酶标抗体或抗原,当抗原抗体发生特异性结合时,酶催化底物显色以达到检测的目的,ELISA具有检测时间短、操作简单等优点。已有许多商业ELISA试剂盒用于临床样本中NoV的检测,如英国DakoCytomation公司开发的IDEIATM诺如病毒试剂盒、德国R-biopham公司开发的Ridascreen®诺如病毒试剂盒,但这些试剂盒的灵敏度和特异性范围差异很大,且可能出现假阳性结果,制约了其发展应用。食品中NoV含量低,而ELISA的最低检测浓度为104~106病毒颗粒/g,因此目前ELISA尚不能满足食品样本对NoV检测的灵敏度要求[36]。
3.2 免疫层析技术
免疫层析技术以固定有检测线(包被抗体)和质控线(抗抗体)的条状纤维层析材料为固定相,测试液为流动相,是一种在免疫渗滤基础上发展而来的新型免疫学检测方法。当样品中存在相应的抗原时,抗原会与抗体发生特异性反应,在检测线出现可见的条带而达到检测目的。免疫层析具有检测时间短、保质期长、成本相对较低等优点,一些商业免疫层析试剂盒也用于NoV检测。Kumthip等[37]评估了最新版的RIDA®QUICK诺如病毒免疫层析试剂盒对临床样本中NoV检测的敏感性和特异性,并与RT-PCR进行比较。结果显示,该试剂盒具有较高的灵敏度和特异性,且与其他胃肠炎病毒无交叉反应。由于免疫层析技术具有检测灵敏度和特异性较低的缺点,且对NoV的分型能力有限,因而主要用于临床样本中NoV的检测。但可将其与其他技术联合以提高检测的灵敏度,从而满足食品中NoV的检测要求。
ELISA和其他免疫学检测方法一样具有检测灵敏度和特异性较低的缺点,其检测下限为104~106个病毒颗粒/g,不利于食品基质中NoV检测。随着新方法的出现以及与其他技术联用,使得食品中NoV的检测成为可能。如张捷等[38]通过将免疫层析法与近红外荧光结合,制备了一种用于检测贝类中NoV的便携式试纸条;Alharami等[39]开发了一种基于纳米材料的免疫分析方法,可实现对鸡肉、黄瓜、生菜中NoV的检测。免疫学技术与其他技术联用不仅提高了检测的灵敏度,满足了食品中NoV的检测要求,还使检测设备更加便捷。核酸检测、免疫学检测用于诺如病毒检测的评价汇总见表1。
4 生物传感器
生物传感器是一种可将生物响应转换成可测量的光、电或物理信号的分析装置,由生物刺激性材料识别元件和理化转换系统组成。根据所使用的信号转换器,生物传感器可分为电化学、光学、压电晶体和半导体生物传感器等[40]。生物传感器具有灵敏度高、成本低、分析速度快、高度自动化、集成化等特点,越来越成为研究的重点。
4.1 电化学生物传感器
电化学生物传感器是一种将生物识别转换为电流、电位、阻抗等电信号的传感平台,具有低成本、高灵敏度的特点。Baek等[41]以NoroBP-nonFoul-(FlexL)2多肽为特异性生物分子结合剂,研制了一种用于高选择性、高灵敏度检测牡蛎样品中NoV的电化学生物传感器。NoroBP多肽通过噬菌体表面展示技术从随机肽库中筛选而出,能与NoV特异性结合。NoroBP-nonFoul-(FlexL)2多肽是以NoroBP为骨架,将两个(GGGGS)连接子和一个(EKEKEKE)连接子插入到NoroBP中而成。此外,该多肽含有巯基,可在Au表面形成Au—S共价键,利用该特点可将多肽包被在电极上,电流信号随NoV量的增加而递减。该传感器能对牡蛎中NoV进行高灵敏度、高选择性检测,检测下限低至1.7拷贝数/mL。此外,Baek等[42]还开发了一种NoV特异性捕获多肽功能化金纳米修饰的二硫化钨纳米花电化学传感平台。当病毒与金纳米颗粒修饰的二硫化钨纳米花结合时,通过阻止工作电极与氧化还原物之间的电荷转移而提高了阻抗,阻抗值会随着NoV量的增加而增加。利用电化学阻抗谱技术对传感器检测性能进行评估,该传感器具有良好的选择性和灵敏度,在牡蛎样品中检测限为6.21拷贝数/mL。

表1 诺如病毒检测方法(核酸检测、免疫学检测)及评价†
除了利用多肽直接对NoV进行检测外,也可利用NoV衣壳蛋白和诺如病毒样颗粒进行间接检测。如,Guo等[43]通过将制备的针对NoV衣壳蛋白的单克隆抗体偶联在ITO/CdS电极表面,开发了一种光电化学生物传感器,用于特异性和灵敏检测NoV。该传感器电极的光电流随着NoV衣壳蛋白浓度的变化而变化,可在30 min 内以浓度依赖的方式检测到低至2×10-10g/mL的NoV衣壳蛋白。此外,Lee等[44]利用外加磁力将金/磁性纳米颗粒修饰的石墨烯沉积在叉指式铂电极上作为电传感通道,再与GII型NoV抗体偶联,形成诺如病毒样颗粒传感平台。该传感平台可通过测量电阻的变化来监测诺如病毒样颗粒浓度的变化,在0.01 pg/mL~1.00 ng/mL 质量浓度范围具有较高的灵敏度和特异性,检测限为1.16 pg/mL。电化学生物传感器作为一种高灵敏检测病原体和污染物的新型工具,具有快速、现场诊断的NoV的潜力,可有效提高检测的灵敏度,但其在实际中的应用尚未普及[45]。
4.2 光学生物传感器
光学生物传感器可分为基于荧光、吸收、反射、表面等离子体共振等,这些传感器通常具有无标记、所需样品量少、高灵敏度或特异性、可近乎实时地进行检测的优点,在食品中诺如病毒检测方面具有巨大应用潜力[46]。局域表面等离子体共振(Localized surface plasmon resonance,LSPR)是一种应用广泛的传感方法,具有响应速度快、衰变长度短的特点,可高灵敏度地检测其表面的各种分析物[47]。Heo等[48-49]利用该技术开发了一种由亲和肽引导的可检测NoV衣壳蛋白和人源NoV的传感器。亲和肽通过从多价M13随机肽库中经生物筛选而来,可与NoV特异性结合,经ELISA鉴定,其与NoV的结合亲和力为纳摩尔级别。NoV衣壳蛋白含量与LSPR信号的吸光度呈正比,该传感器的最低检测限为0.1 ng/mL。但值得注意的是,利用LSPR进行传感时需严格控制反应条件以减少非特异性结合,而当配体固定在传感器表面后其天然构型可能会改变,这将影响与分析物的结合[50]。除表面等离子体共振型光学传感器外,基于荧光的光学传感器也被应用于食品中NoV检测。Zhao等[51]从嗜热菌中提取载色体,构建了一种以“ε-亚单位抗体—链霉素—生物素—探针”检测系统的F0F1-ATPase生物传感器,并成功用于食品中NoV检测。该研究利用链霉素—生物素系统将设计的探针连接至传感器,根据探针与NoV RNA的特异性结合可实现对NoV的检测。与对照相比,该传感器对NoV的荧光强度有显著性差异,表明NoV被成功捕获并连接到探针。所构建的生物传感器可在1 h内完成NoV RNA检测,灵敏度达0.005 ng/mL。此外,Adegoke等[52]开发了一种SiO2包覆合金化CdZnSeS量子点—分子信标纳米传感器,用于检测GII型NoV。该研究利用核酸杂交原理,通过分子信标探针对NoV RNA进行特异性捕获。该量子点分子信标探针可实现对低浓度NoV RNA的超灵敏检测,最低检出限为8.2拷贝数/mL。与传统的分子检测探针相比,该检测系统具有快速、高特异、高灵敏度等优点。
除了电化学和光学生物传感器之外,还有一些其他的生物传感器也被用于NoV的检测,如基于质量的生物传感器(石英晶体微天平和微悬臂梁)、比色型生物传感器、免疫传感器等。与其他方法相比,生物传感器具有灵敏度高、成本低、分析速度快、所需样品量少等特点,在食品中诺如病毒检测方面具有巨大应用潜力。虽然生物传感器的开发极大地提高了检测的灵敏度,但其在实际中的应用尚未普及,且当其利用配体捕获NoV时,可能会改变配体的天然构象,从而影响与分析物的结合,因此仍需进一步改进。生物传感器用于诺如病毒及其代替物检测评价汇总见表2。
5 展望
在半个世纪的过程中,食品中NoV检测和分析技术取得了极大的进展,人们对NoV的流行病学特征、基因分型、检测和诊断有了更深入的认识。但目前NoV的检测仍存在诸多挑战,需要进一步的研究。首先,将含量极低的NoV从大样本的复杂食品基质中提取富集一直都是NoV检测的瓶颈环节,虽然已有一些基于靶向结合的特异性富集方法,但仍缺少能与不同基因型NoV进行广谱结合的配体,因此开发具有广谱配位性的配体对NoV的检测极为重要[12];其次感染性和非感染性病毒颗粒的区分对食品中NoV的检测也十分关键。受损的衣壳蛋白虽然使NoV失去感染性,但其RNA依然存在,导致了核酸检测假阳性结果的产生。目前,可以通过在PCR扩增之前加入核酸嵌入剂(如单叠氮乙锭和单叠氮丙啶)来达到区分感染性和非感染性病毒颗粒的目的[53]。核酸嵌入剂能够穿透受损的衣壳蛋白,并与RNA共价结合,使得非感染性病毒不能进行RT-qPCR扩增从而区分;最后仍需进一步提升NoV检测的灵敏度,实现快速、高通量检测。核酸检测耗时长,不利于实时检测、免疫学检验的灵敏度和特异性通常较低,且对NoV的分型能力有限,而目前正在开发的可快速检测的生物传感器还没有在实际应用中得以普及。虽然食品中NoV检测研究已取得重大进展,但仍存在一些挑战,需要继续深入研究。
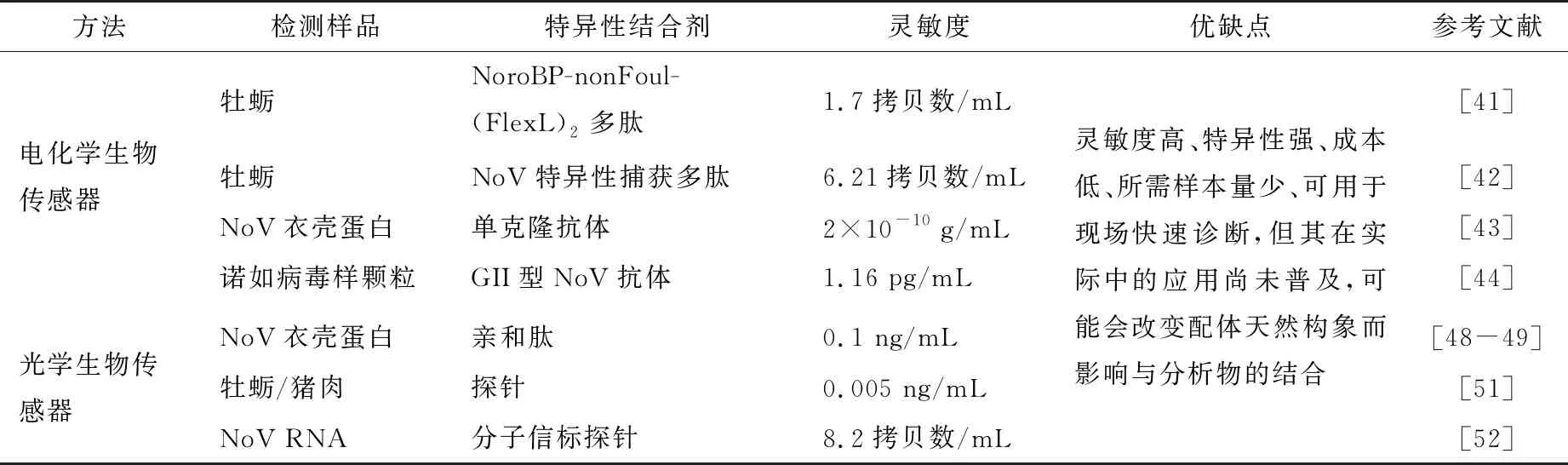
表2 诺如病毒及其代替物检测方法(生物传感器)和评价
