响应面法优化亚临界萃取冰岛刺参内脏油脂工艺
2021-05-10徐梦豪姚艳艳朱纪海赵祥忠
徐梦豪 梁 艳 姚艳艳 朱纪海 赵祥忠
(1. 齐鲁工业大学〔山东省科学院〕食品科学与工程学院,山东 济南 250353;2. 威海长青海洋科技股份有限公司,山东 威海 264300;3. 山东中硕海洋科技有限公司,山东 日照 276800)
冰岛刺参(Cucumariafrondosa),属棘皮动物门(Echinodermata)海参纲(Holothuroidea)枝手目(Dendrochirota)瓜参科(Cucumariidae)[1],主要分布于冰岛、加拿大、俄罗斯、挪威等北大西洋海域。其富含蛋白质[2]、维生素、多糖[3-4]、三萜糖苷[5]和脂类等多种活性成分,具有抗癌[6]、抗血栓[7]、抗炎[8]、抗高血糖[9]、免疫调节[10]等功能。参肠及其性腺组织是冰岛刺参内脏中的主要器官,被统称为海参花[11],其食用历史悠久[12],是珍贵的水产制品之一。冰岛刺参内脏中脂类物质丰富,包含糖脂、磷脂、胡萝卜素、脂溶性维生素以及脂肪酸等脂溶性成分。多不饱和脂肪酸(PUFA)约占内脏中脂类物质的44%,且以EPA为主[13-15]。冰岛刺参在初级加工过程中会留有大量内脏,小部分被制作成干品海参花,但大部分作为饲料进行处理,造成了资源浪费。
亚临界流体萃取技术是一种在饱和压力下,亚临界状态的萃取溶剂与物料在系统内相接触,并经浸提、蒸发脱溶、压缩、冷凝回收等过程,从天然产物中萃取目标组分的一种分离技术,已被广泛应用于各类天然产物的萃取与分离[16],而采用亚临界萃取技术萃取冰岛刺参内脏油脂的工艺尚未见报道。试验拟根据Box-Behnken中心组合试验原理分析方法,优化并建立一种萃取冰岛刺参内脏油脂的新工艺,并与不同萃取方法的油脂进行理化指标与GC-MS分析比较,为开发全新冰岛刺参衍生产品以及提高冰岛刺参内脏附加值提供依据。
1 材料与方法
1.1 原料与仪器
冰岛刺参内脏(含性腺、参肠、胃囊):荣成石岛集团有限公司;
正己烷:色谱级,天津科密欧化学试剂有限公司;
甲醇:色谱级,上海星可高纯溶剂有限公司;
硫酸:分析纯,烟台远东精细化工有限公司。
1.2 仪器与设备
真空冷冻干燥试验机:LG0.2型,新阳速冻设备制造有限公司;
亚临界流体萃取实验室成套设备:CBE-30+5L型,河南省亚临界生物技术有限公司;
色谱柱:TR-FAME型,100 m×0.25 mm×0.20 μm,美国赛默飞公司;
电子天平:HZT-A2000型,福州华志科学仪器有限公司;
高速中药粉碎机:HX-200型,浙江省永康市溪岸五金药具厂;
气相色谱—质谱联用仪:Aglient 7890B GC-5977B MSD型,美国安捷伦公司。
1.3 试验方法
1.3.1 试验流程及操作要点
冰岛刺参内脏清洗→控水→称量→冻干→称量→粉碎过筛→装袋→萃取→GC/MS分析
(1) 样品前处理:将冰岛刺参内脏洗净后进行冻干。冷阱温度-35 ℃,真空度10 Pa,冷冻干燥时间48 h,粉碎过40目筛,阴凉干燥处保存备用。
(2) 萃取条件:按单因素及响应面优化后萃取参数进行。
(3) 油脂甲酯化:根据文献[17]修改如下:取1 mL油脂样品于具塞试管中,加入5 mL 5%硫酸—甲醇溶液,75 ℃水浴甲酯化2 h,冷却,加入2.5 mL正己烷充分振荡,静置分层,取上层清液于玻璃试管中,加入适量无水硫酸钠干燥,收集干燥样品,上机检测。按式(1)计算萃取率。
(1)
式中:
ω——油脂萃取率,%;
M1——油脂质量,g;
M2——样品质量,g。
1.3.2 油脂理化指标测定
(1) 皂化值:根据GB/T 5534—1995。
(2) 过氧化值:根据GB 5009.227—2016。
(3) 碘值:根据GB/T 5532—2008。
(4) 水分及挥发物:根据GB 5009.236—2016。
1.3.3 气相色谱—质谱分析条件 根据廉桂芳[17]的方法并修改。色谱条件:进样量1 μL;载气为氦气,流速1.0 mL/min;进样口温度250 ℃;升温程序:60 ℃保持2 min,以30 ℃/min升温至120 ℃,再以2 ℃/min升温至250 ℃,保持2 min。质谱条件:EI离子源温度230 ℃,电子能量70 eV,接口温度250 ℃,质量扫描范围50~550 amu。
1.3.4 定性分析 样品经GC-MS检测后,利用其所配置的NIST 14标准质谱数据库对样品进行自动检索。
1.3.5 定量分析 按照峰面积归一化法计算各方法所得海参内脏油脂中EPA的相对含量。
1.4 响应面法优化亚临界萃取内脏油脂工艺
1.4.1 单因素试验
(1) 料液比:固定萃取压强0.2 MPa,萃取次数3次,萃取时间30 min,萃取温度40 ℃,考察料液比(m冰岛刺参∶V萃取液)[1∶1,1∶2,1∶3,1∶4,1∶5 (g/mL)]对亚临界萃取冰岛刺参油脂萃取率的影响。
(2) 萃取压强:固定料液比(m冰岛刺参∶V萃取液)1∶2 (g/mL),萃取次数3次,萃取时间30 min,萃取温度40 ℃,考察萃取压强(0.2,0.3,0.4,0.5,0.6 MPa)对亚临界萃取冰岛刺参油脂萃取率的影响。
(3) 萃取次数:固定料液比(m冰岛刺参∶V萃取液)1∶2 (g/mL),萃取压强0.2 MPa,萃取时间30 min,萃取温度40 ℃,考察萃取次数(1,2,3,4,5)对亚临界萃取冰岛刺参油脂萃取率的影响。
(4) 萃取时间:固定料液比(m冰岛刺参∶V萃取液)1∶2 (g/mL),萃取压强0.2 MPa,萃取次数3次,萃取温度40 ℃,考察萃取时间(20,30,40,50,60 min)对亚临界萃取冰岛刺参油脂萃取率的影响。
(5) 萃取温度:固定料液比(m冰岛刺参∶V萃取液)1∶2 (g/mL),萃取压强0.2 MPa,萃取次数3次,萃取时间30 min,考察萃取温度(30,35,40,45,50,55,60 ℃)对亚临界萃取冰岛刺参油脂萃取率的影响。
1.4.2 响应面设计 在单因素试验基础上,选取萃取次数、萃取时间、萃取温度3个因素,利用Design-Expert 10.0 根据Box-Behnken中心组合原理进行三因素三水平响应面设计,以油脂萃取率为评价指标,优化亚临界萃取冰岛刺参内脏油脂的工艺条件。
1.4.3 数据处理 所有试验平行3次,取平均值,采用Origin 8.0软件进行线性回归分析及作图,采用Design-Expert 10.0软件进行响应曲面分析。
2 结果与分析
2.1 单因素试验
2.1.1 料液比对油脂萃取率的影响 由图1可知,随着料液比的逐渐增加,内脏油脂的萃取率先升高后略微下降,当料液比(m冰岛刺参∶V萃取液)为1∶3 (g/mL)时,萃取效果达到最佳,此时萃取率为17.77%。萃取过程中,高浓度的溶质分子会更容易溶出于低浓度的溶剂中,随着溶剂的增大,溶质分子与溶剂会逐渐达到固液溶解平衡。当继续增加溶剂,溶质分子无法通过固液界面进入溶剂相,萃取率下降。同时,过多的萃取溶剂会使溶剂回收过程中损失部分油脂,还会产生溶剂残留过量的问题。
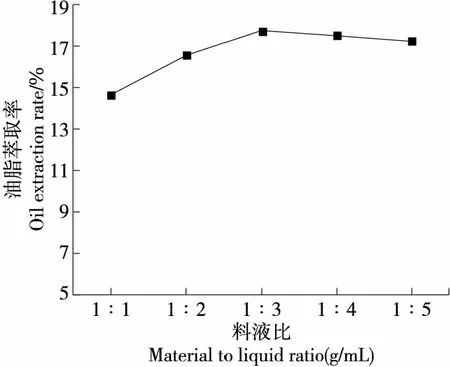
图1 料液比对冰岛刺参内脏油脂萃取率的影响
2.1.2 萃取压强对油脂萃取率的影响 由图2可知,当萃取压强为0.2~0.4 MPa时,油脂萃取率随萃取压强的增加而增大,当萃取压强为0.4 MPa时,油脂萃取率最大为18.77%。萃取压强过高会影响物料中部分油脂的溶解性,同时会使部分溶质分子结构发生改变,变为气态小分子,无法进入液态萃取溶剂。因此整体萃取系统的萃取压强选择0.4 MPa最佳。
2.1.3 萃取次数对油脂萃取率的影响 由图3可知,随着萃取次数的增加,冰岛刺参内脏油脂萃取率不断升高,当萃取次数达3次后,继续增加萃取次数,萃取率变化不显著。其中萃取5次比萃取3次的萃取率仅增加了0.4%,而萃取3次比萃取1次的萃取率增加了8.05%。综合考虑,选取萃取次数为3次较佳。
2.1.4 萃取时间对油脂萃取率的影响 由图4可知,当萃取时间为20~40 min时,萃取时间的延长会显著影响内脏油脂的萃取率,且萃取40 min时的萃取率达17.4%。当萃取时间>40 min时,内脏油脂的萃取率变化较小,萃取时间增加至60 min时,油脂的萃取率仅增加了0.9%。因此,萃取时间选择40 min适宜。

图2 萃取压强对冰岛刺参内脏油脂萃取率的影响
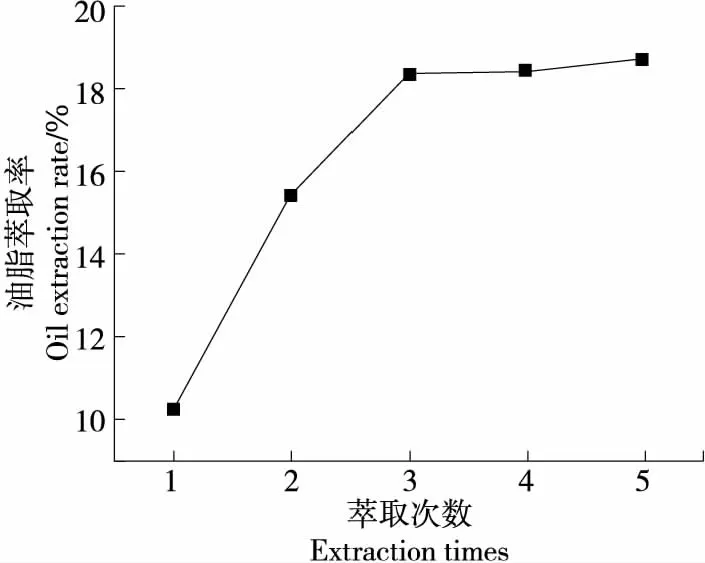
图3 萃取次数对冰岛刺参内脏油脂萃取率的影响

图4 萃取时间对冰岛刺参内脏油脂萃取率的影响
2.1.5 萃取温度对油脂萃取率的影响 由图5可知,当萃取温度为30~45 ℃时,随着萃取温度的升高,油脂萃取率逐渐升高,当萃取温度为45 ℃时,油脂萃取率达最高值17.9%。综上,亚临界萃取冰岛刺参内脏油脂的温度应控制在45 ℃左右。

图5 萃取温度对冰岛刺参内脏油脂萃取率的影响
2.2 响应面试验
2.2.1 响应面试验设计与结果 在单因素试验基础上,以油脂萃取率为评价指标,以萃取次数、萃取时间、料液比为考察因素,根据Box-Behnken中心组合原理进行三因素三水平响应面试验,试验因素水平编码见表1,试验方案与结果见表2。
利用Design-Expert 10.0软件对表2进行回归分析,得回归方程:
R=21.04+1.38A+1.06B+1.27C+0.97AB+0.83AC-0.018BC-0.92A2-0.89B2-0.90C2。
(2)
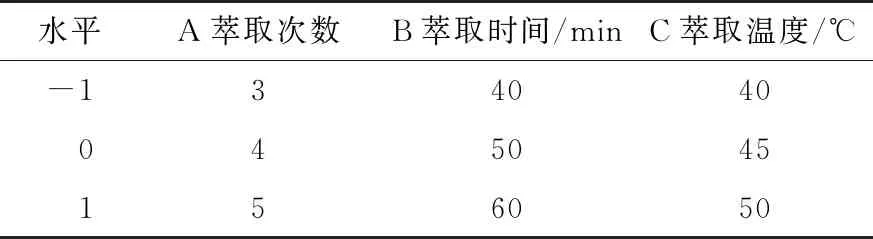
表1 响应面试验因素与水平编码表

表2 响应面试验方案与结果
2.2.3 各因素间的交互作用 由图6~图8可知,萃取次数与萃取时间交互作用最为显著,其次是萃取次数与萃取温度;萃取时间与萃取温度交互作用的响应面趋于平缓,等高线图显示接近于圆,故二者交互作用并不显著,与响应面方差分析结果一致。
2.2.4 萃取工艺条件确定及验证 分析响应面法试验数据可知,冰岛刺参内脏油脂模型的极值点A=0.967,B=0.618,C=0.710。经计算可得最优萃取条件为萃取次数5次、萃取时间56.18 min、萃取温度48.55 ℃、最大萃取率23.41%。对最优条件进行实验验证得萃取率为23.38%,与预测值的相对误差为0.03%,说明响应面法能较好地对冰岛刺参内脏油脂的萃取工艺进行回归分析和优化。
2.3 不同萃取方法油脂的理化指标
由表4可知,亚临界法萃取的冰岛刺参内脏油脂过氧化值低于其他两种方法,说明亚临界工艺的低温萃取对油脂起到了很好的保护作用;同时所萃取出的油脂水分及挥发物少,说明亚临界法的萃取专一性高,有利于油脂的后续加工。综合皂化值及碘值数据,说明亚临界法萃取冰岛刺参内脏油脂具有较大的优势。
2.4 不同萃取方法油脂的GC-MS分析
由图9可知,亚临界法萃取的油脂中EPA(47.568 min 出峰)相对含量达40.7%,溶剂法萃取的油脂中EPA(47.506 min出峰)相对含量为33.3%,酶解法萃取的油脂中EPA(47.755 min出峰)相对含量为39.6%,与其他两种方法相比,亚临界萃取法萃取的油脂的杂质少,且不饱和脂肪酸EPA含量最高。
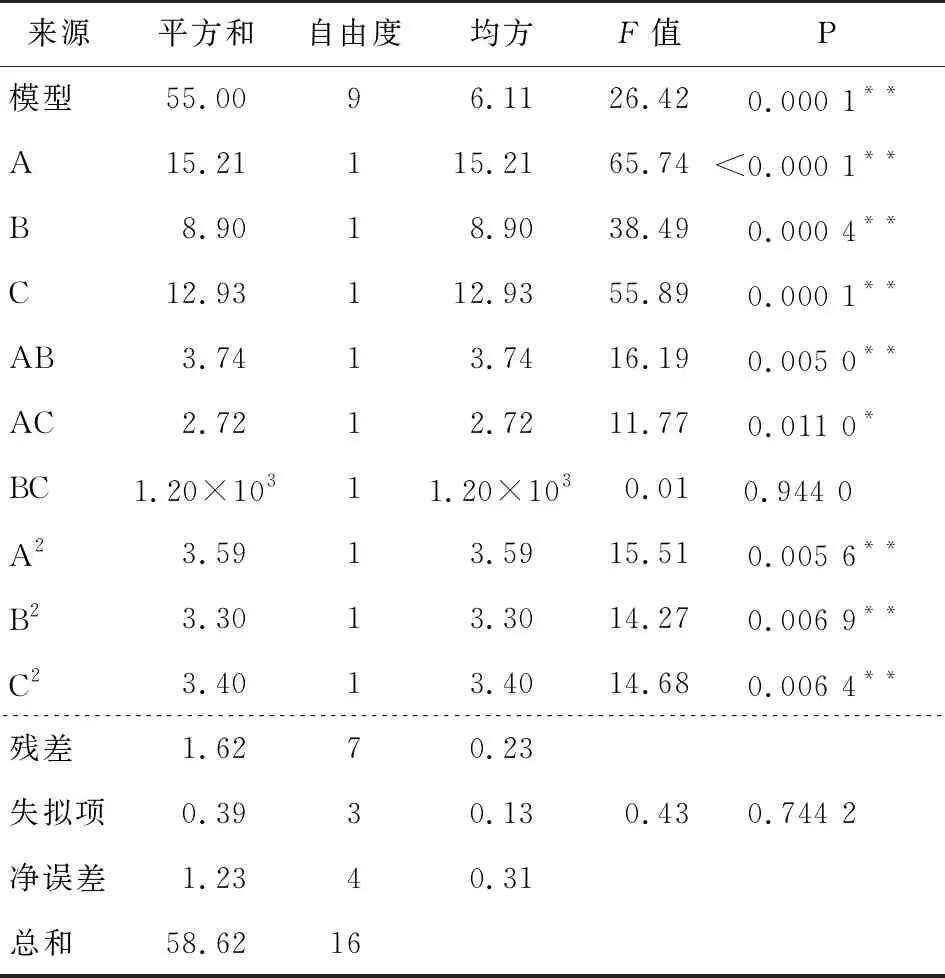
表3 回归模型的方差分析†
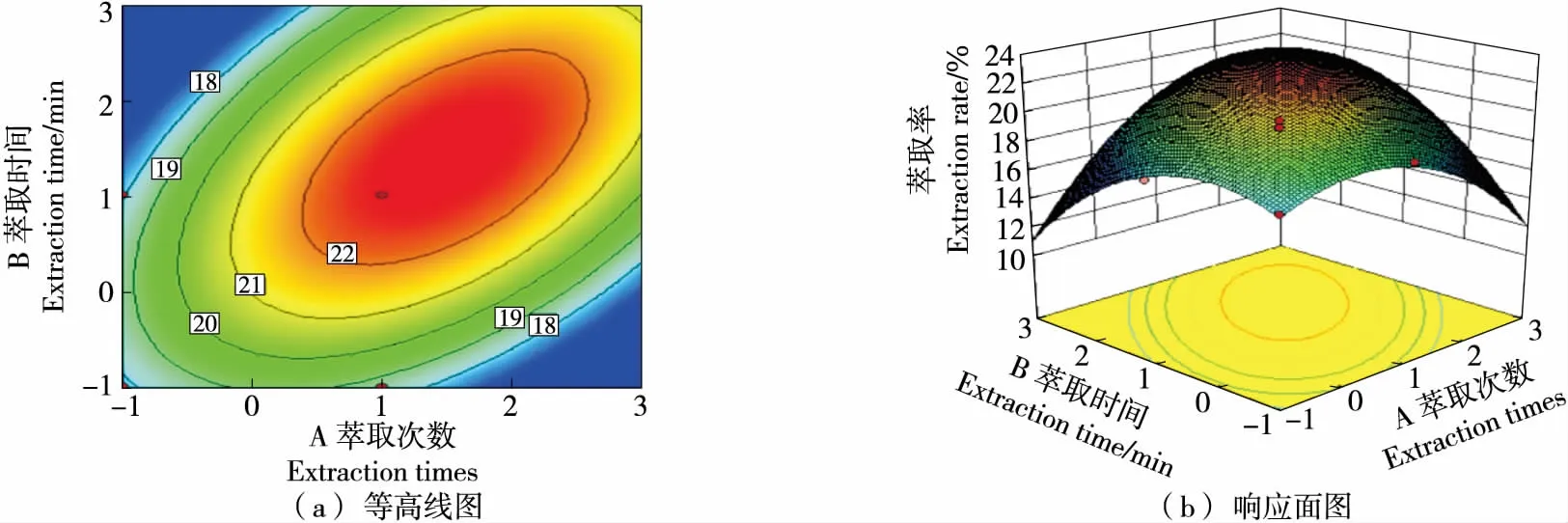
图6 萃取次数与萃取时间的交互作用对冰岛刺参内脏油脂萃取率的影响

图7 萃取次数与萃取温度的交互作用对冰岛刺参内脏油脂萃取率的影响

图8 萃取时间与萃取温度的交互作用对冰岛刺参内脏油脂萃取率的影响

表4 不同萃取方法的油脂理化指标
3 结论
以富含脂类活性物质的冻干冰岛刺参内脏(含性腺、海参肠、胃囊)为原料,利用亚临界工艺进行油脂萃取。结果表明,最佳亚临界萃取工艺条件为料液比(m冰岛刺参∶V萃取液)1∶3 (g/mL)、萃取压强0.4 MPa、萃取次数5次、萃取时间56.18 min、萃取温度48.55 ℃。此工艺条件下的油脂萃取率为23.38%。通过对比不同萃取方法的油脂的理化指标及气相色谱图,发现亚临界法萃取的油脂中的氧化程度低,EPA相对含量达40.7%,说明亚临界法萃取冰岛刺参内脏油脂的工艺效率高,油脂品质更稳定。后续拟开展冰岛刺参内脏油脂成分全面分析,并进行分离纯化。
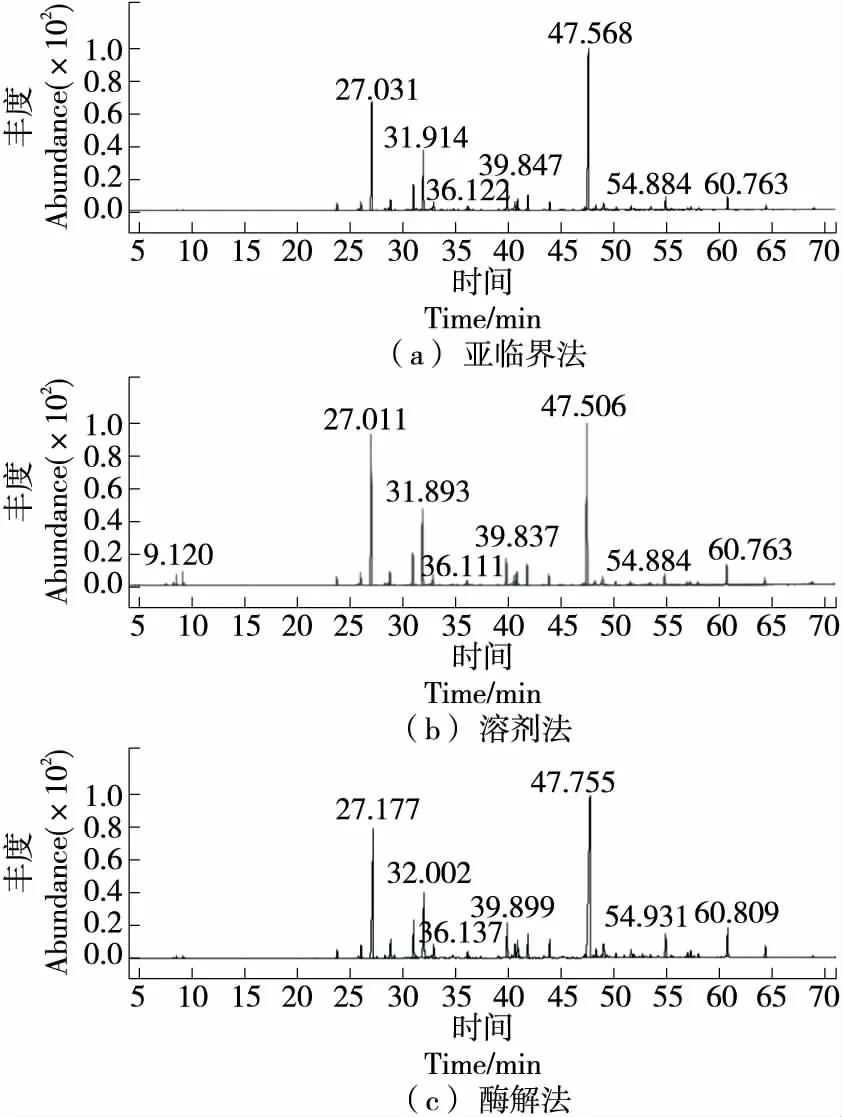
图9 不同萃取方法油脂的GC-MS图谱
