基于二氧化锰纳米片和核酸外切酶I构建荧光适配体传感器检测氯霉素
2021-05-10马鹏飞王周平
马鹏飞 齐 硕 吕 艳 周 游 王周平
(1. 江南大学食品国家重点实验室,江苏 无锡 214122;2. 江南大学食品学院,江苏 无锡 214122)
氯霉素(Chloramphenicol,CAP)是一种广谱抗生素,对革兰氏阳性和阴性菌均有抑制作用,曾被广泛地应用于感染性疾病治疗[1-3]。然而氯霉素对人体有很大的毒副作用,可抑制人体骨髓造血功能从而引起再生性障碍性贫血症等[4-5]。根据中华人民共和国农业农村部第250号公告,氯霉素禁止在食品和动物饲料中使用。由于氯霉素低廉的成本和优异的抑菌效果,目前仍然有一些氯霉素在蜂蜜、牛奶和水产品中违法使用的报道。因此,为了保障公众健康,需要建立一种准确灵敏的氯霉素检测方法。目前广泛使用的氯霉素检测方法有液相色谱—质谱法[6]、酶联免疫法[7]、超高效液相色谱法[8]等,但是这些方法需要专业和经验丰富的技术人员,仪器价格昂贵且检测耗时较长。近年来,科研人员报道了一些基于纳米材料和核酸适配体的新型氯霉素检测方法,包括电化学法[9]、荧光法[10]和比色法[11]等,为氯霉素的检测提供了新思路。
适配体(Aptamer)是通过指数富集配体进化(SELEX)技术筛选得到,长度在10~100个核苷酸范围内的单链DNA或RNA。适配体能够通过结构转换、氢键和疏水相互作用等与生物小分子、金属离子、蛋白质、细胞以及细菌等高效的结合[12-14]。适配体与抗体相比,具有制备简单,易于功能化修饰,稳定性好的优点[15-18]。适配体的这些优点为研制应用于食品安全检测与控制中的传感器提供了基础。如赵旭等[19]研制了一种基于核酸适配体的镉离子可视化检测方法,检测的线性范围为0.1~5.0 ng/mL,检测为0.5 ng/mL。许宙等[20]基于磁性纳米材料,构建了一种酶联增敏适配体传感器检测双酚A,检测限低至0.5 pg/mL。
二氧化锰纳米片(Manganese dioxide nanosheet,MnO2NS)是一种超薄的二维纳米材料,具有优良的荧光淬灭能力,在生物传感,细胞成像和药物输送领域具有广阔的应用前景[21-23],如Wang等[24]基于MnO2NS淬灭有机染料荧光原理,构建了检测microRNA的传感平台,检测限为0.8 nmol/L。核酸外切酶I(Exonuclease I, Exo-I)能够以3末端到5末端方向降解单链DNA,不依赖于特异的核苷酸序列,能够有效地扩增信号进而实现对靶标的检测。
研究拟利用MnO2NS对核酸适配体的荧光淬灭能力,以及Exo-I的酶促靶标循环放大信号作用,构建一种灵敏的氯霉素荧光检测新方法。
1 材料与方法
1.1 材料与仪器
1.1.1 材料与试剂
牛血清白蛋白(BSA)、醋酸锰、氯化钠和氯化钾等:分析纯,国药集团化学试剂有限公司;
FAM标记的氯霉素适配体(5’-FAM-ACTTCAGTGAGTTGTCCCACGGTCGGCGAGTCGGTGGTAG)、核酸外切酶I(Exo-I,20 U/μL):生工生物工程(上海)股份有限公司;
氯霉素、四环素、土霉素、卡那霉素和甲砜霉素:上海阿拉丁生化科技股份有限公司;
全黑96孔微孔板:美国康宁公司;
氯霉素酶联免疫检测试剂盒:百奥森食品安全科技有限公司;
超纯水:18.2 MΩ,由Millipore净水系统制备。
1.1.2 主要仪器设备
酶标仪:BioTek SynergyH1型,美国BioTek 公司;
透射电镜:JEM-2100型,日本电子株式会社;
原子力显微镜:Dimension ICON型,德国布鲁克科技有限公司。
1.2 试验方法
1.2.1 MnO2NS的制备 二氧化锰的合成参照Han等[25]的方法并作改进。取1 mL质量浓度为1 mg/mL的BSA和1 mL质量浓度为0.05 g/mL的醋酸锰置于250 mL的烧杯中,并向烧杯中加入98 mL超纯水至烧杯内溶液总体积为100 mL;将烧杯置于磁力搅拌器上,常温搅拌均匀;50 min后,向溶液中加入浓度为1 mol/L的氢氧化钠溶液,将溶液的pH值调节到8.0;将溶液置于磁力搅拌器上继续搅拌6 h,得到浅黄色的溶液,溶液经离心沉淀后,所得材料沉淀用超纯水清洗两次,在4 ℃冰箱中保存备用。
1.2.2 检测体系的构建 将适配体原液(1 μmol/L)在95 ℃ 加热5 min后,置于室温静置30 min,使适配体形成稳定的空间构象。在1.5 mL的离心管中加入10 μL的适配体原液和10 μL的MnO2NS原液(1 mg/mL),加入180 μL氯霉素结合缓冲液(10 mmol/L Tris-HCl,100 mmol/L NaCl,5 mmol/L KCl,5 mmol/L MgCl2,pH 7.4)使得溶液总体积为200 μL。为了使适配体完全被MnO2NS吸附,适配体与MnO2NS在室温避光条件下,孵育30 min。将5 μL的氯霉素标准品加入到离心管中,同时加入4 μL的Exo-I,37 ℃下避光孵育50 min。最后将100 μL反应液体加入酶标板中,置于酶标仪中检测荧光强度,激发波长485 nm,发射波长528 nm。
1.2.3 MnO2NS质量浓度的优化 MnO2NS的质量浓度与适配体是否被完全吸附有关,如果溶液中有游离的适配体,会造成检测的荧光背景信号高,影响检测性能。在50 nmol/L适配体浓度下,加入不同体积的MnO2NS,使其终质量浓度分别为0.01,0.02,0.05,0.10,0.20,0.30 mg/mL,测定体系荧光强度。
1.2.4 适配体浓度的优化 固定Exo-I的用量和酶切时间不变,在5 nmol/L氯霉素浓度下,加入不同浓度的适配体,使其终浓度分别为5,10,20,50,100,150,200 nmol/L,测定体系荧光强度。
1.2.5 Exo-I用量的优化 固定适配体浓度,MnO2NS质量浓度和酶切时间不变,在5 nmol/L氯霉素浓度下,加入不同体积的Exo-I,使其在检测体系中的用量分别为0.1,0.2,0.3,0.4,0.5,0.6,0.7 U/μL,测定体系荧光强度。
1.2.6 酶切时间的优化 固定适配体浓度,MnO2NS质量和Exo-I用量不变,在5 nmol/L氯霉素浓度下,酶切时间分别为10,30,50,70,90,110 min,测定荧光强度。
1.2.7 实际样品检测 从当地超市购买合格的蜂蜜,用氯霉素适配体结合缓冲液稀释20倍之后,用0.22 μm 滤膜过滤稀释液体。将不同浓度的氯霉素标准品加入滤液,用试验构建的检测方法进行检测,计算实际样品检测加标回收率,并与商用酶联免疫法进行比较。
2 结果与讨论
2.1 检测原理
如图1所示,荧光基团FAM标记的氯霉素适配体首先被MnO2NS吸附,基于荧光能量共振转移效应,适配体标记的荧光被淬灭。当溶液中无氯霉素时,即使加入Exo-I,由于MnO2NS会阻碍酶切,Exo-I无法剪切被二氧化锰吸附的适配体,溶液无荧光恢复。当溶液中存在氯霉素时,适配体特异性地与氯霉素结合后,从MnO2NS表面解离,溶液荧光恢复;在有Exo-I存在的条件下,Exo-I剪切溶液中与氯霉素结合而脱离MnO2NS的适配体。适配体由于被剪切,失去了结构的完整性进而无法与氯霉素结合,释放出来的氯霉素会再次与被MnO2NS吸附的适配体结合,使适配体从MnO2NS表面解离,溶液进一步恢复荧光,从而实现对氯霉素的检测。
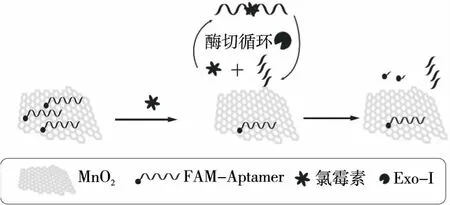
图1 氯霉素检测原理图
2.2 二氧化锰纳米片的表征
图2为MnO2NS的表征图。由图2(a)可知,制备的MnO2NS呈薄片状结构,具有较大的比表面积;由图2(b)和图2(c)可知,制备的MnO2NS厚度大约为1.2 nm,是单层MnO2NS。
2.3 试验条件优化
2.3.1 MnO2NS质量浓度的优化 由图3可知,随着MnO2NS质量浓度的增加,溶液的荧光值减小,当MnO2NS 质量浓度≥0.05 mg/mL时,溶液中适配体的荧光被完全淬灭,表明适配体完全被MnO2NS吸附,无游离的,因此选择0.05 mg/mL为MnO2NS的最佳质量浓度。
2.3.2 适配体浓度的优化 由图4可知,随着适配体浓度的增加,溶液的荧光值增加,当适配体的浓度≥50 nmol/L 时,溶液的荧光值基本达到饱和,说明此时适配体的量已经达到饱和,同时为了节约适配体的使用量,增加检测的经济性,选择50 nmol/L为适配体的最佳浓度。
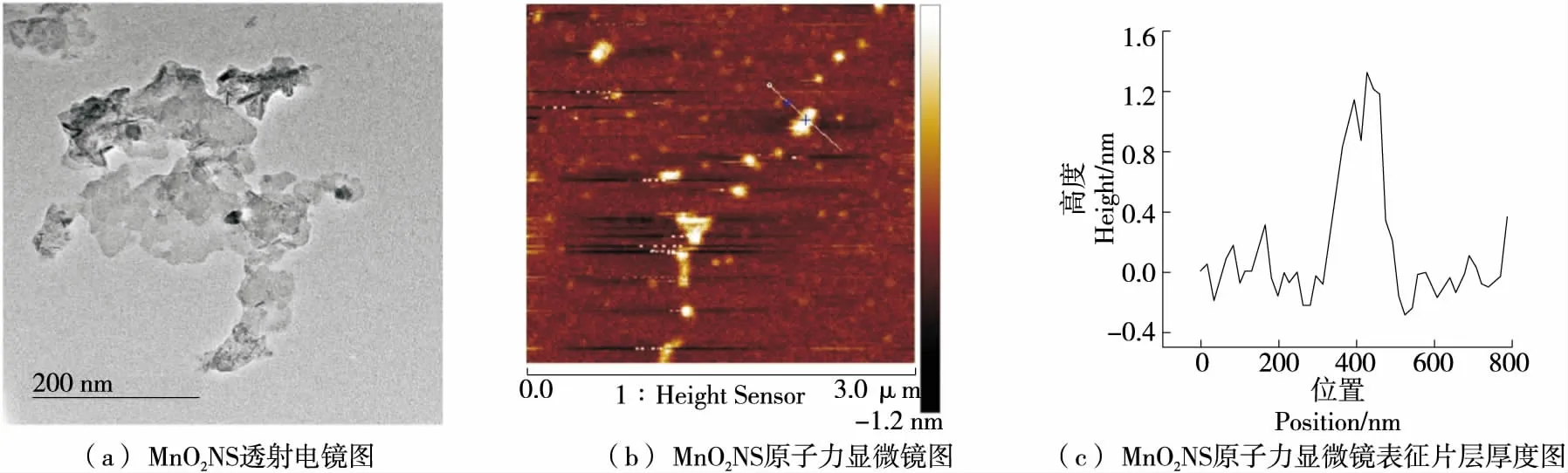
图2 二氧化锰纳米片表征图
2.3.3 Exo-I用量的优化 由图5可知,随着Exo-I用量的增加,更多的适配体从MnO2NS解离,溶液荧光强度增大,当酶在检测体系中的用量≥0.4 U/μL时,溶液荧光强度基本保持不变,说明体系中酶的用量达到饱和,选择0.4 U/μL作为Exo-I的最佳用量。

图3 二氧化锰纳米片质量浓度的优化
2.3.4 酶切时间的优化 由图6可知,随着酶切时间的增加,溶液荧光强度迅速增大,当酶切时间≥40 min时,溶液的荧光值趋于平稳,说明酶切达到饱和;若酶切不充分,体系荧光弱,将影响检测性能;而酶切时间过长,将影响检测效率,因此选择50 min作为最佳酶切时间。
2.4 线性范围与检测限
在最佳的试验条件下,利用构建的检测方法,对不同浓度的氯霉素标准品进行检测,由图7可知,氯霉素的浓度为0.1~80.0 nmol/L时,氯霉素浓度与荧光强度呈良好的线性,校正曲线方程为y=856lgx+1 459(R2=0.995),检出限为0.08 nmol/L(S/N=3)。
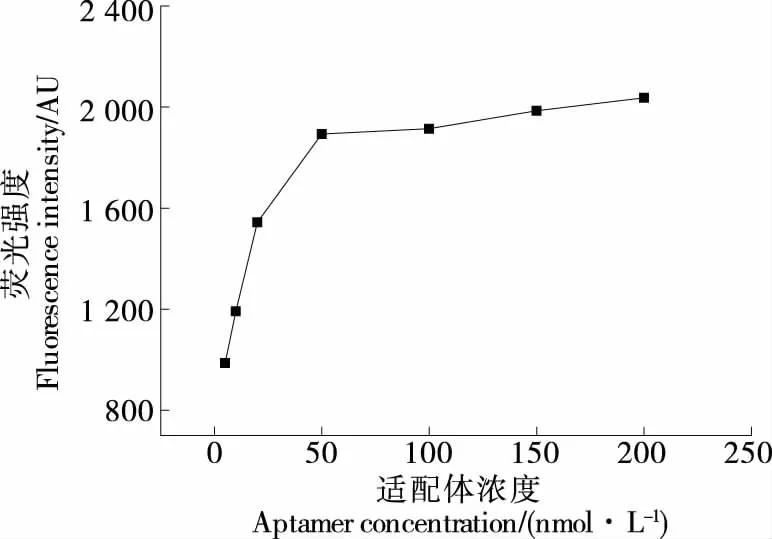
图4 适配体浓度的优化

图5 核酸外切酶I用量的优化

图6 酶切时间的优化
2.5 特异性
为了验证检测方法的特异性,在最优试验条件下,选择甲砜霉素、四环素、土霉素、卡那霉素进行分析检测,浓度均为1 nmol/L。由图8可知,氯霉素与其他抗生素的荧光强度差距明显,表明该适配体传感器具有良好的特异性。
2.6 实际样品加标回收试验
为了验证所构建的适配体传感器在实际样品检测中的准确性,用蜂蜜样品进行加标回收试验,并将检测结果与酶联免疫法进行对比,结果见表1。由表1可知,加标试验回收率为92%~99%,酶联免疫法的回收率为91%~103%,表明方法具有良好的准确性,可用于实际样品检测。
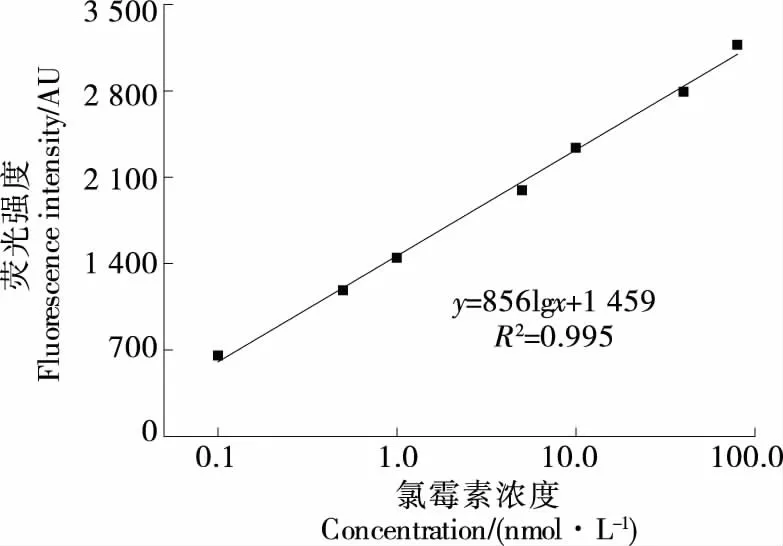
图7 荧光强度与氯霉素的线性关系
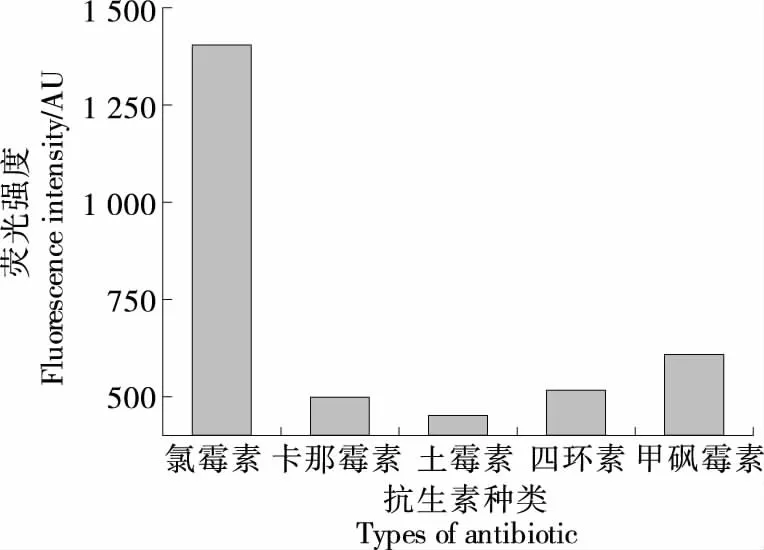
图8 特异性分析
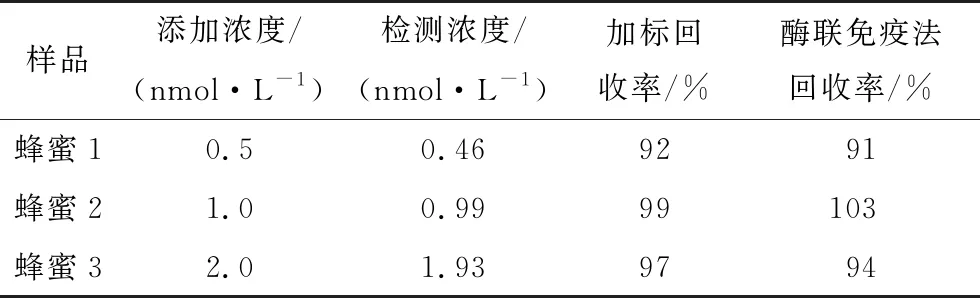
表1 氯霉素加标回收率
3 结论
研究构建了一种基于MnO2NS和Exo-I酶切扩增的方法检测氯霉素,在最优条件下,检测限达0.08 nmol/L。检测方法操作简单,特异性好,灵敏度高,在实际样品检测中加标回收率与商用酶联免疫试剂盒保持一致,具有较强的实用性,但酶的活性会受到温度的影响,后续研究可通过加入一定量的多糖等增强酶的稳定性。
