大孔树脂对二角菱壳多酚的吸附及解吸性能研究
2021-05-10彭莉莎孙梦瑶曹清明龙奇志
袁 欢 彭莉莎 孙梦瑶 曹清明,2 龙奇志
(1. 中南林业科技大学食品科学与工程学院,湖南 长沙 410004;2. 中南林业科技大学特医食品加工湖南省重点实验室,湖南 长沙 410004)
菱角是菱角科菱角属一年生浮叶水生植物,主要品种有两种,即四角菱(TrapaquadrispinosaRoxb.)和二角菱(TrapabispinosaRoxb.)[1],常分布于热带、亚热带和温带地区的淡水湿地、湖泊、池塘、河流缓流河段[2-3]。菱角的果肉可以食用,其营养价值高。但菱角壳往往作为废弃物丢弃,不仅造成植物资源的浪费,而且污染环境。
菱角壳提取物具有多种生物活性,包括抗氧化[4]、降血糖[5-6]、保护肝脏细胞[7-8]、抗癌[9]77-78[10-12]等作用。菱角壳的功能作用主要是由于菱角壳中富含酚酸[13]、黄酮类[6, 14]、多糖[15]、皂苷[9]68、甾体[16]和生物碱[1, 17-20]等活性化合物。Malviya等[21]研究了菱角壳水提物抗氧化活性的物质基础,其中酚类、类黄酮和单宁化合物含量分别为63.81 mg GAE/g·DW,21.34 mg RE/g·DW和17.11 mg TE/g ·DW。吕喆等[22]采用微波萃取法从野生菱角皮和菱角仁中提取到甾醇类化合物,并用高效液相色谱法鉴定其为豆甾醇和β-谷甾醇。Kim等[7]测定了菱角壳水提取物和70%乙醇提取物中总黄酮含量分别为(21.00±1.32),(45.00±1.03) mg CE/g。鞣质是菱角壳中的主要酚类化合物。Huang等[6]从欧菱中分离得到没食子酸和6个可水解单宁。林秋生[9]72-78从无角菱壳中分离得到没食子酸及其二聚体。周光雄等[10]用85%乙醇提取,从菱角壳中分离得到两个主要成分:1,2,6-三没食子酰-没食子酰葡萄糖和1,2,3,6-四没食子酰-没食子酰葡萄糖,进一步研究表明,这两种鞣酸类物质具有抗肿瘤活性。符少莲等[23]运用高效液相色谱法对菱角壳乙酸乙酯萃取部分中的鞣质类化合物进行了测定,1,2,6-三没食子酰-β-D-葡萄糖和1,2,4,6-四没食子酰-β-D-葡萄糖含量分别为85.7,244.0 mg/g。
大孔树脂因其具有多孔性结构,以及表面电性或氢键而具有吸附性。利用其对不同成分的选择性吸附和筛选作用,能够分离、提纯某一种或某一类有机化合物[24-25]。天然产物化合物制备的前处理时,通常会利用树脂去除大部分极性和离子物质[26-27],如糖和酸;食品工业中,为了减少有机溶剂的使用和设备能耗,提高分离效率,也需要用到大孔树脂分离。Pradal等[28]用5种食品级高分子树脂XAD 2、XAD 4、XAD 7、XAD 1180和XAD 16从菊苣渣中回收多酚,在优化的工艺条件下,多酚总回收率提高到50%;白万明等[29]用AB-8大孔树脂对橄榄油加工废液中的橄榄多酚进行富集,其多酚能富集到原来的7.93倍,多酚纯度达到56.44%。吕寒等[30]用弱极性树脂LS-300B11对四角菱50%乙醇提取物进行纯化,多酚的最终浓度为91.7%。二角菱与四角菱的多酚种类[31]和数量[32]差别很大,研究拟对95%乙醇提取液的乙酸乙酯萃取液进行纯化,从7种大孔树脂中筛选出对菱角壳中多酚吸附性能最好的树脂,以期为菱角壳的利用及相关保健食品的开发提供技术支持。
1 材料与方法
1.1 材料与试剂
二角菱壳:湖南益阳,晒干,粉碎后于-4 ℃下保存;
无水乙醇:AR级,天津市风船化学试剂科技有限公司;
石油醚、乙酸乙酯、正丁醇、氢氧化钠:AR级,天津市大茂化学试剂厂;
盐酸:AR级,株洲市星空化玻有限责任公司;
碳酸钠:AR级,天津市科密欧化学试剂有限公司;
福林试剂:AR级,国药集团化学试剂有限公司;
大孔树脂:D101、AB-8、X-5、D3520、DA201、D1300、NKA-2型,0.30~1.25 mm,北京瑞达恒辉科技发展有限公司。
1.2 仪器与设备
可见分光光度计:721型,上海菁华科技仪器有限公司;
旋转蒸发器:RE-5205型,上海亚荣生化仪器厂;
低温循环真空泵:DLSB-FZ型,郑州长城科工贸有限公司;
电子天平:FA1004N型,上海菁海有限公司;
磁力加热锅:ZNCL-DLS190×90型,上海弘懿仪器设备有限公司;
髙速万能粉碎机:LD-Y300A型,上海顶帅电器有限公司;
空气浴振荡器:HZQ-C型,哈尔滨市东联电子技术开发有限公司;
恒温磁力搅拌水浴锅:HCJ-60型,常州市中贝仪器有限公司;
真空冷冻干燥机:Scientz-10N型,宁波新芝生物科技股份有限公司。
1.3 方法
1.3.1 二角菱壳样品的制备 取二角菱壳粉末1 kg,按固液比(m壳粉∶V乙醇)为1∶10 (g/mL)用95%乙醇提取40 min,温度为50 ℃,将残渣过滤,滤液减压浓缩。浓缩液按m浓缩液∶V水=1∶13 (g/mL)用纯水稀释,再依次用石油醚、乙酸乙酯、正丁醇进行萃取,浓缩,得到石油醚、乙酸乙酯、正丁醇浸膏。乙酸乙酯浸膏冻干,得到冻干样品固形物29.4 g,按固形物配制成100 mg/mL的样液备用。
1.3.2 没食子酸标准曲线的绘制 称取25 mg没食子酸,溶于无水乙醇,定容到25 mL(1 mg/mL)。配制成0.02 mg/mL 的标准使用溶液。
分别吸取0.0,0.2,0.4,0.6,0.8,1.0 mL的0.02 mg/mL 没食子酸标准溶液于试管中,用水补至2 mL,各加入福林试剂0.5 mL,摇动混合后静置3 min,加入10%的Na2CO3溶液1 mL,使总体积为3.5 mL。经70 ℃水浴加热10 min后,于725 nm下测定吸光度值。以没食子酸质量浓度(mg/mL)为x轴,吸光度值为y轴,绘制标准曲线。
1.3.3 样品总多酚含量的测定 大孔树脂洗脱过程中样品需要进行总多酚的测定。准确移取适量待测样液于10 mL 具塞试管中,用水补至2 mL,加入0.5 mL福林酚试剂,然后按照标准曲线步骤操作,在725 nm下测得吸光度,代入没食子酸标准曲线中,即可得到大孔树脂洗脱前、后样品中的总多酚含量(表示为mg GAE/g)。
1.3.4 大孔树脂型号的筛选
(1) 大孔树脂的预处理:大孔树脂使用前需经过预处理以将有毒有机聚合物去除。参照文献[33],先用蒸馏水冲洗树脂,再以体积分数95%乙醇将树脂浸泡12 h,然后用蒸馏水冲洗至无乙醇味;分别用质量分数5%的氢氧化钠和体积分数5%的盐酸依次浸泡3 h,每次浸泡后用蒸馏水洗树脂至中性,备用。
(2) 7种大孔树脂的吸附性能比较:准确称取7种不同型号大孔树脂D101、AB-8、X-5、D3520、DA201、D1300、NKA-2各2 g于锥形瓶中(每组3份平行),加入20 mL固形物质量浓度为4 mg/mL的乙酸乙酯部位样品液,于25 ℃、120 r/min的摇床上振摇使其充分吸附12 h,吸取上清液,测定总酚含量,按照式(1)和式(2)计算7种大孔树脂的吸附量、吸附率。将上清液倒入试管中,用少量蒸馏水清洗树脂,过滤,吸干树脂表面水分后,将树脂移至锥形瓶中,加入体积分数70%乙醇溶液20 mL,于相同条件下振荡12 h,取适量上清液,测定吸光度值,用没食子酸标准曲线计算出总多酚含量。按照式(3)和式(4)计算大孔树脂的解吸量和解吸率。
QA=(C0-C1)×V1/m,
(1)
RA=[(C0-C1)/C0]×100%,
(2)
QD=C2×V2/m,
(3)
RD=[C2/(C0-C1)]×100%,
(4)
式中:
QA——吸附量,mg GAE/g;
RA——吸附率,%;
QD——解吸量,mg GAE/g;
RD——解吸率,%;
C0——二角菱壳乙酸乙酯萃取段的初始多酚含量,mg GAE/mL;
C1——吸附后溶液中多酚含量,mg GAE/mL;
C2——解吸后乙醇洗脱液的多酚含量,mg GAE/mL;
V1——使用的样品液体积,mL;
V2——洗脱溶剂体积,mL;
m——树脂吸去水分的质量,g。
1.3.5 大孔树脂静态吸附—解吸条件优化
(1) 上样液固形物浓度对大孔树脂吸附性能的影响:分别称取5份预处理好的D101大孔树脂2 g放入100 mL 锥形瓶中,取乙酸乙酯部位样品液20 mL,固形物含量分别为2,3,4,5,6 mg/mL,于摇床中(25 ℃、120 r/min)振荡进行吸附试验,12 h后取上清液,测定样品中总多酚含量,考察大孔树脂对多酚的吸附量。
(2) 洗脱溶剂(乙醇)体积分数对大孔树脂解吸性能的影响:分别称取5份预处理好的D101大孔树脂2 g放入100 mL锥形瓶中,取固形物浓度为5 mg/mL的乙酸乙酯部位样液20 mL,于摇床中(25 ℃、120 r/min)振荡进行吸附试验,12 h后除去上清液,大孔树脂使用蒸馏水清洗至表面无残留,分别加入20 mL体积分数50%,60%,70%,80%,90%的乙醇溶液,于摇床中(25 ℃、120 r/min)振荡进行解吸试验,12 h后取上清液,测定样品中总多酚的质量浓度,考察大孔树脂对多酚的解吸量。
1.3.6 大孔树脂动态吸附—解吸条件优化
(1) 上样流速对大孔树脂吸附性能的影响:分别称取5份预处理好的D101大孔树脂10 g装入玻璃层析柱(1.8 cm×20 cm)中,取固形物浓度为5 mg/mL乙酸乙酯部位35 mL,上样流速1,2,3,4,5 mL/min进行吸附试验,收集流出液,测定流出液的多酚含量,考察上样流速对吸附率的影响。
(2) 洗脱流速对大孔树脂解吸性能的影响:分别称取5份预处理好的D101大孔树脂10 g装入玻璃层析柱中,取固形物浓度为5 mg/mL的乙酸乙酯部位35 mL,以流速1 mL/min上样,进行吸附试验;用70%乙醇(体积分数)5 BV(柱体积),以洗脱流速分别为1,2,3,4,5 mL/min 进行洗脱,收集流出液,测定流出液的总酚含量,考察洗脱流速对解吸率的影响。
(3) 洗脱体积对大孔树脂解吸性能的影响:分别称取5份预处理好的D101大孔树脂10 g装入玻璃层析柱中,取固形物浓度为5 mg/mL的乙酸乙酯部位35 mL,以1 mL/min 流速上样,进行吸附试验;70%乙醇(体积分数)以4 mL/min,分别用3,4,5,6,7 BV进行洗脱,收集流出液。测定流出液的多酚含量,考察洗脱溶剂体积对解吸率的影响。
1.3.7 最佳工艺的验证与放大 采用上述试验优化的D101大孔树脂的吸附—解吸的最佳工艺条件,对二角菱乙酸乙酯萃取液进行吸附—解吸的验证实验,收集流出液,浓缩,冻干,得到纯化的样品,测定样品总多酚含量,以多酚含量考察样品的纯度。采用与验证实验相同的条件,将D101树脂总量扩大30倍,装于4.0 cm×50 cm 的层析柱中,上样量为1 050 mL,收集流出液,浓缩,冻干,得到放大试验的总多酚含量,考察样品的纯度。
1.3.8 统计分析 每个测定重复处理3次,试验数据采用SPSS 22软件处理,其中P<0.05表示存在显著性差异。
2 结果与分析
2.1 标准曲线的绘制
没食子酸标准曲线如图1所示,计算出标准曲线的回归方程为y=124.05x-0.003 4,R2=0.999 1,在0.001 09~0.005 63 mg/mL范围内吸光度值与没食子酸质量浓度呈良好线性关系。
2.2 样品总多酚含量
按照1.3.3对样品中总多酚含量进行测定,经计算,冻干样品(固形物)中总酚含量为478 mg GAE/g。配制的100 mg/mL 的固形物样液中总酚含量为47.8 mg GAE/mL。
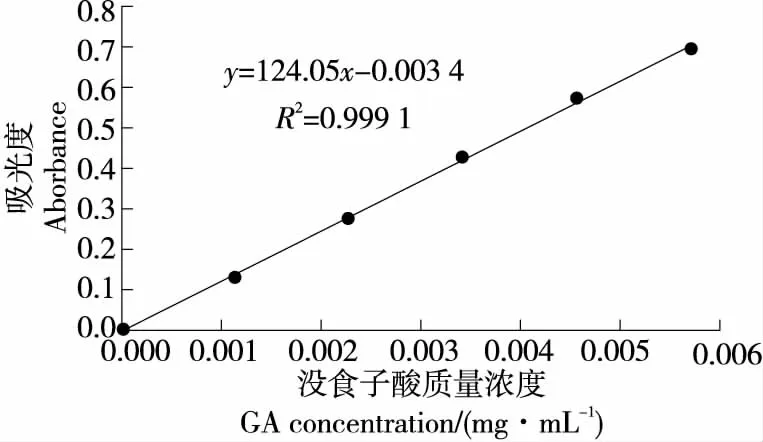
图1 没食子酸标准曲线
2.3 大孔树脂型号的筛选
表1为7种大孔树脂对二角菱壳乙酸乙酯部位中多酚静态吸附及解吸情况,其中D101、D1300、AB-8、D3520型大孔树脂对多酚吸附能力较强,DA-201、D101、D1300大孔树脂的解吸性能较强,但DA-201大孔树脂的吸附性能较低,D1300大孔树脂的解吸率较低,综合考虑,选用D101大孔树脂作为二角菱壳乙酸乙酯部位多酚纯化的材料。
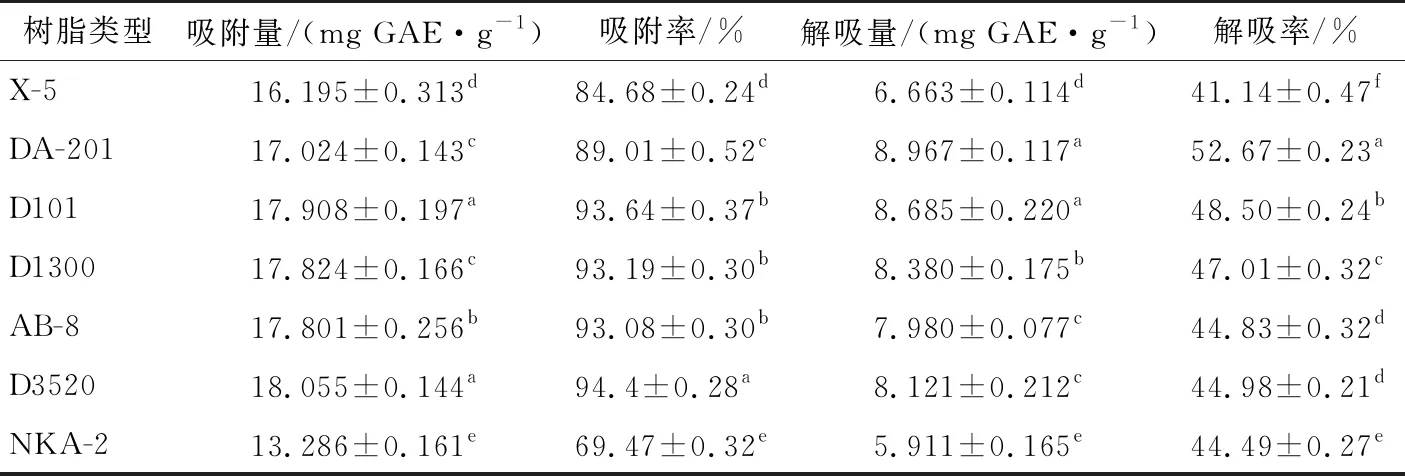
表1 7种大孔树脂对二角菱壳乙酸乙酯部位中多酚静态吸附及解吸†
2.4 D101大孔树脂静态吸附—解吸条件优化
2.4.1 上样液固形物质量浓度对大孔树脂吸附性能的影响 由图2可知,随着上样液固形物质量浓度的增加,D101型大孔树脂对多酚的吸附量先增加后减小,以20 mL 上样,当上样液固形物质量浓度为5 mg/mL时吸附量最大(22.19 mg GAE/g)。原因可能是上样液固形物质量浓度>5 mg/mL时,样液中的其他物质增多,会与多酚物质争夺D101大孔树脂的活性位点[34],造成多酚的吸附量下降;上样固形物质量浓度<5 mg/mL时,样品质量浓度被稀释,多酚含量减少,造成吸附量降低。因此最佳的上样固形物质量浓度为5 mg/mL。
2.4.2 洗脱溶剂(乙醇)体积分数对大孔树脂解吸性能的影响 由图3可知,随着乙醇体积分数的增加,动态解吸量呈先增加后降低的趋势;以20 mL上样,当乙醇体积分数为70%时,动态解吸量最高(22.53 mg GAE/g)。其原因可能为体积分数70%的乙醇更有利于二角菱壳中总多酚的溶解,增加乙醇体积分数可能会影响二角菱壳乙酸乙酯部位中总多酚和大孔树脂之间的相互作用[35]。因此选用洗脱溶剂(乙醇)体积分数为70%。
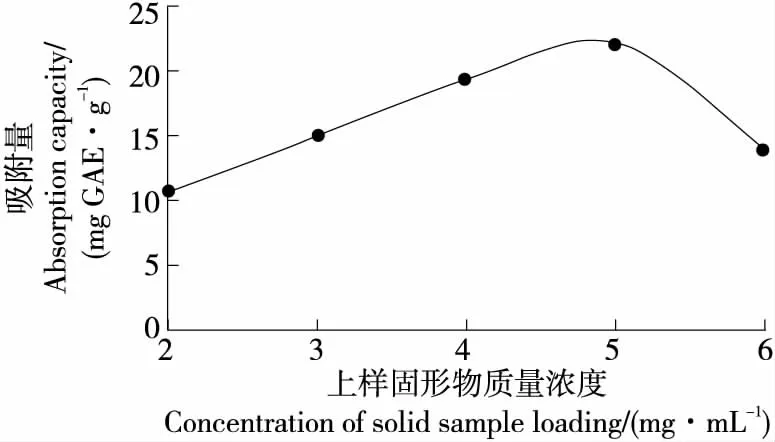
图2 上样浓度对D101大孔树脂吸附性能的影响
2.5 大孔树脂动态吸附—解吸条件优化
2.5.1 上样流速对大孔树脂吸附性能的影响 由图4可知,随着上样流速的增大,动态吸附率逐渐下降;当上样液流速为1 mL/min时,大孔树脂能够充分吸附样品,动态吸附率高达98.65%。这可能是因为上样液流速过快导致上样液在层析柱中停留的时间较短,不能与大孔树脂充分地接触,使得吸附效果不理想[34]。
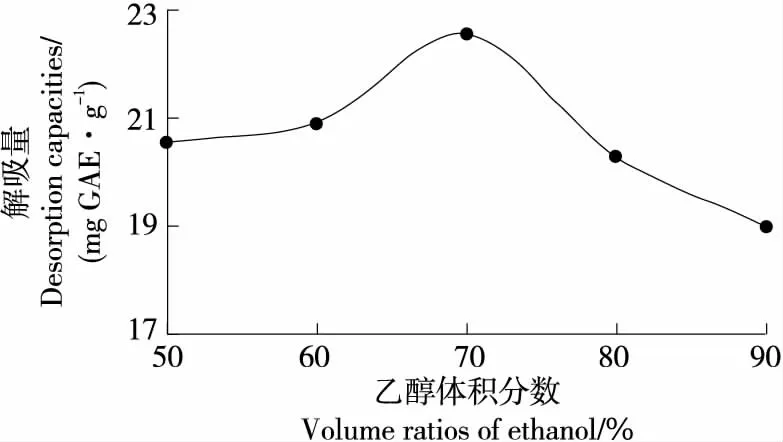
图3 洗脱溶剂(乙醇)体积分数对D101大孔树脂解吸性能的影响
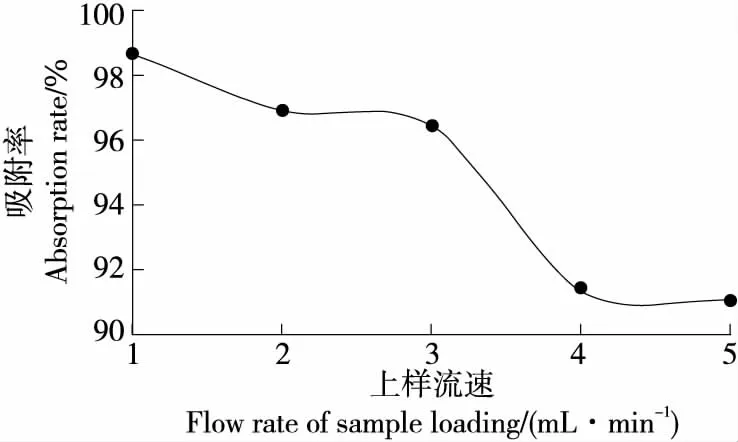
图4 上样流速对D101大孔树脂吸附性能的影响
2.5.2 洗脱流速对大孔树脂解吸性能的影响 由图5可知,随着洗脱流速的增加,动态解吸率呈先增大后减小的趋势;当洗脱流速为4 mL/min时,动态解吸率最高(69.00%)。超过4 mL/min后解吸率降低,可能是因为解吸溶剂通过层析柱速度过快,使得解吸溶剂不能与树脂充分接触,影响了解吸液对样品中总多酚的溶解。因此,最佳洗脱流速为4 mL/min。
2.5.3 洗脱溶剂体积对大孔树脂解吸性能的影响 由图6 可知,当洗脱溶剂体积为5 BV(即60 mL)时,动态解吸率最高(65.31%)。其原因可能是随着洗脱溶剂体积的增加,二角菱壳中总多酚被充分洗脱,再增加洗脱溶剂的体积,解吸能力下降,在实际生产过程中可能会增加生产成本[36]。因此,选择洗脱溶剂体积为5 BV。
2.6 最佳工艺的验证与放大
采用优化的试验条件进行验证实验,其条件为样液固形物质量浓度5 mg/mL,上样流速1 mL/min,以体积分数70%的乙醇溶液为洗脱剂,用4 mL/min的洗脱流速,洗脱5 BV(柱体积);将上样量放大30倍,其他条件不变,进行放大试验。验证实验和放大试验前后,多酚的纯化结果见表2。该条件下多酚含量由478.14 mg GAE/g,纯化到825.21 mg GAE/g,提高了1.73倍。放大试验条件下,纯化效果相当。
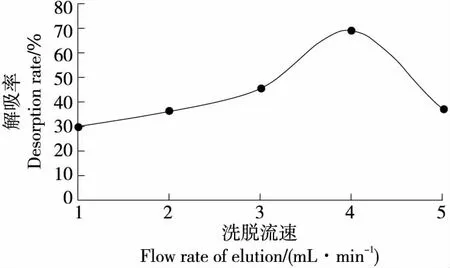
图5 洗脱流速对D101大孔树脂解吸性能的影响
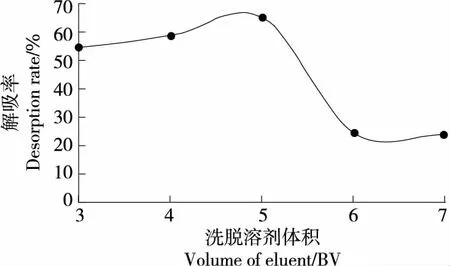
图6 洗脱溶剂体积对大孔树脂解吸性能的影响
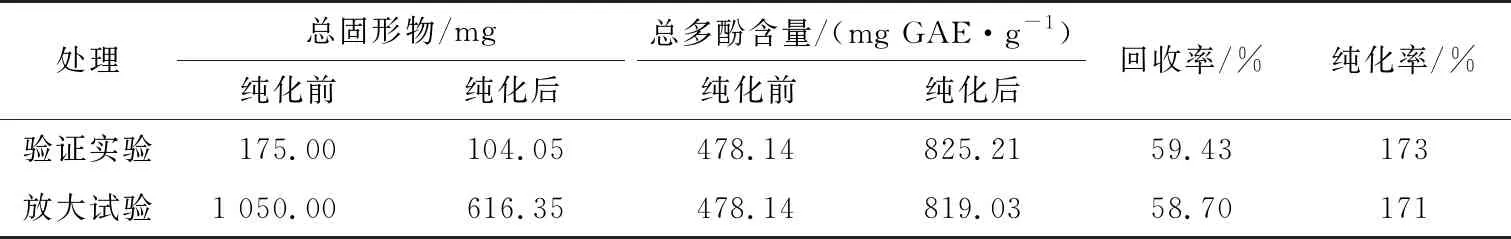
表2 验证实验和放大试验结果
3 结论
试验选用成本相对较低的一些大孔树脂来纯化菱角多酚,通过比较研究,筛选出最优的大孔树脂为D101型大孔树脂,对D101大孔树脂纯化二角菱乙酸乙酯萃取液中的总多酚条件进行优化,在最佳工艺条件下,多酚含量由478 mg GAE/g上升到825 mg GAE/g,提高了1.73倍,因此,D101大孔树脂对二角菱壳乙酸乙酯萃取液中的总多酚有较好的纯化效果。该方法操作简单,成本低廉且效果好,具备推广应用潜力。
