282例胃肠胰神经内分泌肿瘤临床特征及预后分析
2021-05-08李苏艳侯康乔隽邹珂李凯园褚传莲
李苏艳,侯康,乔隽,邹珂,李凯园,褚传莲
(1.潍坊医学院,山东 潍坊 261053 ;2.山东大学附属济南市中心医院,山东 济南 250000;3.山东大学齐鲁医学院,山东 济南 250000;4.山东第一医科大学,山东 济南 250000)
0 引言
胃肠胰神经内分泌肿瘤(Gastroenteropancreatic neuroendocrine tumors, GEP-NETs)是指起源于胃肠道胰腺神经内分泌细胞的一组生长缓慢、低度恶性,能够产生生物活性胺或者多肽激素的异质性肿瘤,约占所有胃肠道肿瘤的8.7%,每年发病率约为0.3/10万[1]。近年来,随着内窥镜、影像学和病理检查的普及和发展,以及临床医生对该病的认识日益提高,GEPNETs的发病率呈上升趋势。目前关于神经内分泌肿瘤的研究缺乏大样本、多中心研究,对该疾病的认识尚不足。本研究回顾性分析了282例GEP-NETs患者的临床资料,以探讨GEP-NETs的临床特点及预后危险因素。
1 资料与方法
1.1 研究对象
回顾性分析2013年1月至2019年11月期间于山东大学齐鲁医院收治的282例患者的临床资料,其中男性149例,女性133例,男女比例1.12:1,发病中位年龄59岁。所有患者均行详尽的术前检查,如内镜、超声内镜、CT、实验室检查等辅助检查,最终经组织活检或术后病理明确诊断,排除病例资料不全的患者。
1.2 诊断方法
参照2010版WHO神经内分泌肿瘤命名分类标准[2]及2013版《中国胃肠胰神经内分泌肿瘤病理诊断共识》[3],将肿瘤分为神经内分泌瘤(neuroendocrine tumor,NET)、神经内分泌癌(neuroendocrine carcinoma,NEC)及混合性腺神经内分泌癌(mixed adenoneuroendocrine carcinoma,MANEC)。组织学分级按核分裂象和Ki67指数分为,G1(NET):核分裂象<2,Ki67指数 <3%;G2(NET):核分裂象 2~20,Ki67指数 3~20%;G3(NEC):核分裂象 >20,Ki67指数 >20%。
1.3 随访
采用门诊、电话、微信及住院复查等方式,每3~6月随访1次,记录患者生存状况。随访截止时间为2020年4月。
1.4 统计学方法
使用R 3.6.1软件进行数据统计分析。连续变量表示为平均值±标准差;计量资料的比较采用卡方检验,不符合卡方检验条件者使用Fisher确切概率法进行比较;采用单因素Cox回归模型和多因素Cox回归模型分析影响预后的因素;生存率分析采用KM绘制生存曲线,log-rank进行组间生存率比较。P<0.05表示差异有统计学意义。
2 结果
2.1 各年龄段男女性别比特征
282 例患者中,2013年确诊 8例,2014年确诊 20例 ,2015年确诊34例,2016年确诊47例,2017年确诊49例,2018年确诊66例,2019年确诊58例。发病例数呈逐年上升趋势,2019年发病例数为2013年的7.25倍。其中,男性患者149(52.8%)例,女性患者133(47.2%)例,男女比例1.12:1。高发年龄在40~60岁,发病中位年龄59(13~82)岁。随着年龄的增高,男性患者的构成比更高(P=0.074)。
2.2 肿瘤直径与病理分级关系
282 例患者肿瘤直径为0.3~10.7cm,按肿瘤大小分为 <1cm、1~2cm、>2cm 三组。按照组织学分级 G1级 141例(50%),G2级93例(33%),G3级48例(17%)。分析肿瘤直径与病理分级的关系结果显示,肿瘤直径与病理分级呈中等程度相关,差异有统计学意义(P<0.001)。见图1。
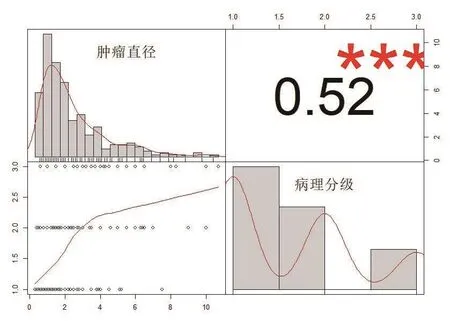
图1 GEP-NETs患者肿瘤直径与病理分级关系
2.3 病理分级与肿瘤浸润深度关系
除外胰腺126例,食管、胃、十二指肠、结直肠156例NETs中,G1级 86例(50%),G2级 34例(33%),G3级 36例(17%)。其中,累及黏膜层24例,黏膜下层88例,肌层15例,浆膜层28例。结果显示,随着病理分级的增加,浸润深度不断加深,差异有统计学意义(P<0.001);见表1。
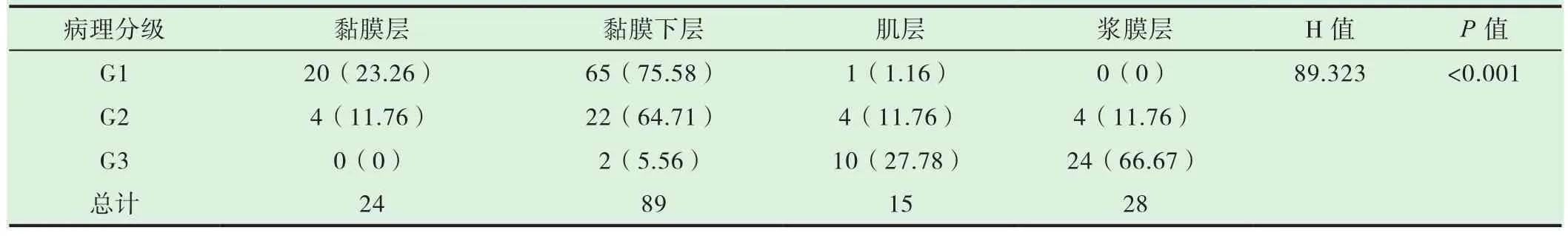
表1 本组GEP-NETs患者病理分级与浸润深度关系
2.4 局部转移、远处转移与病理分级关系
本组患者有26例发生局部转移,25例发生远处转移。其中,G1无局部转移,远处转移1例,G2局部转移9例,远处转移7例,G3局部转移、远处转移各17例。结果显示,存在局部转移、远处转移的患者病理分级更高,差异有统计学意义(P<0.001)。
2.5 免疫组化特征
282 例患者中,高分化神经内分泌肿瘤(NET)234例,低分化神经内分泌癌(NEC)48例,混合性腺神经内分泌癌(MANEC)1例。CgA、Syn、CD56免疫组化染色阳性率分别为 80.6%(221/274)、99.7%(281/282)、88.1%(148/168)、92.1%(152/165)。其中胰腺 CgA、Syn、CD56、CK 免疫组化染色阳性率分别 93.3%、100%、85.4%、84.6%;胃 CgA、Syn、CD56、CK免疫组化染色阳性率分别91.0%、100%、86.3%、95.6%;直肠CgA、Syn、CD56、CK免疫组化染色阳性率分别41.7%、100%、98.0%、97.6%;十二指肠 CgA、Syn、CD56、CK免疫组化染色阳性率分别83.3%、100%、93.0%、100%。不同部位CgA与CD56阳性率差异有统计学意义(P值均<0.05);仅食管出现1例(16.7%)syn阴性病理,余均为阳性;不同部位CK的阳性率差异无统计学意义(P=0.2)。
2.6 预后因素分析
全组病例中,失访14例,死亡21例,中位随访时间25(1~71)月。单因素分析显示年龄、肿瘤直径、部位、病理分级、浸润深度、转移差异均有统计学意义。多因素分析采用lasso回归进行变量筛选,多因素COX纳入是否转移与病理分级,结果显示转移 HR=6.74,95%CI 0.99~45.83,P=0.051,病理分为 G3 HR=10.82,95%CI 1.59~73.69,P=0.015,均是 OS的危险因素。见图3,表2。
3 讨论
本组病例中,男性患者构成比较高。国外有文献报道中年女性患者比例更高[4],美国学者Yao等人[5]研究了美国NENs患者男性发病率较女性高。我国郭林杰[6]等人汇总了1954-2011年国内发表的GEP-NETs相关文献,总结10757例患者发病特点,其中男女比例约为1.19:1,中位发病年龄为52岁。本研究结果显示本男女比为1.12:1,发病高峰在40~60岁。
美国SEER[6]流行病学调查研究显示,小肠是消化系统NEN最常见的发病部位,其次是直肠、结肠、胰腺等;Chan和Luk[7]等人研究表明,胰腺(34.9%)和直肠(33.3%)是消化系统NEN最常见的部位;本研究结果显示胰腺是最常见的部位(44%),其次是胃(25%)和直肠(22%),这与我国焦学龙[8]研究结果一致,但与郭林杰等人[7]研究结果存在较大差异,导致这种差异的原因,分析可能有:①样本量较小,数据存在偏倚;②随着影像学的发展,胰腺肿瘤患者检出率增高;③随着医疗水平提升,对胰腺NETs的认识增加。目前尚不清楚这种差异是否与种族差异有关。
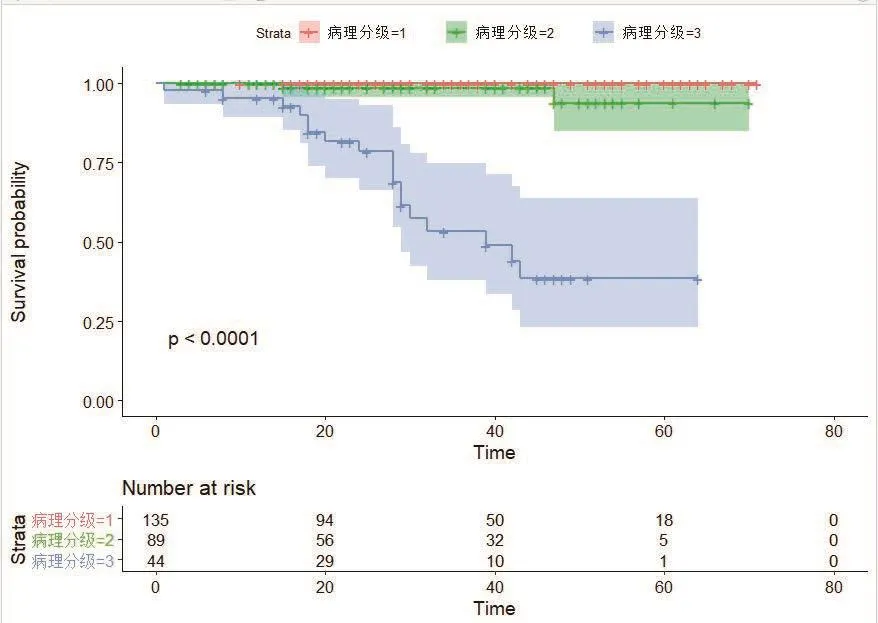
图2 单因素分析GEP-NETs患者病理分级与预后关系
本组病例中,直肠NETs预后较好,其次是胃,胰腺、食管和十二指肠预后较差,小肠病例较少,未纳入统计。有文献报道,原发的食管NEN大多为分化差的NEC[9],本组食管5例均为NEC,发现时均已晚期。本组21例死亡病例中无G1级,G2级2例死亡,余均为G3级,提示预后较好,与Huang[10]等人研究结果一致。
既往研究表明,CgA、Syn阳性率分别为70.6%、94.1%,本研究结果显示,CgA、Syn阳性率分别为80.6%、99.7%,提示CgA具有较高特异性,Syn具有较高的灵敏性。联合CD56、CK等检测有助于提高确诊率。
研究发现,GEP-NETs患者的预后与年龄、病理分型、肿瘤大小、有无转移等密切相关。本研究中肿瘤直径三组之间患者预后差异均有统计学意义,提示肿瘤直径越大,预后越差,与我国谢凤梅[11]等人研究一致。本研究单因素分析,患者年龄、肿瘤大小、部位、病理分级、浸润深度、转移是影响预后的危险因素,与性别无关。这与Chagpar[12]等人研究相符。而邓会岩等人[13]研究显示,性别是影响预后的相关因素。多因素分析显示肿瘤转移与病理分级是预后危险因素,这与郑玉洁等[14]研究结果一致。Chi等人[15]研究表明肿瘤病理分级是预后的独立因素。上述差异可能与样本量较小有关,故有待于建立更大数据库。
由于本研究是一项单中心回顾性研究,样本量小且失访率较高,病例资料不全,导致结果偏倚,因此有必要建立多中心、大样本的研究,以更好地分析 GEP-NETs的临床特征及预后因素。
