红壤不同粒径团聚体对草甘膦农药降解动力学的影响*
2021-05-08辛龙川吴文雪付格娟陈延华王学霞刘东生杨晓梅
辛龙川, 吴文雪, 薛 萐, 付格娟, 陈延华, 王学霞, 刘东生, 杨晓梅,**
红壤不同粒径团聚体对草甘膦农药降解动力学的影响*
辛龙川1, 吴文雪1, 薛 萐2, 付格娟3, 陈延华4, 王学霞4, 刘东生4, 杨晓梅1,2**
(1. 西北农林科技大学资源环境学院 杨凌 712100; 2. 西北农林科技大学水土保持研究所/黄土高原土壤侵蚀与旱地农业国家重点实验室 杨凌 712100; 3. 西安市环境监测站 西安 710100; 4. 北京市农林科学院植物营养与资源研究所 北京 100097)
草甘膦农药的大量喷施, 使其在环境特别是土壤中的残留-累积风险日益突出, 从团聚体粒径角度研究红壤不同粒径团聚体中草甘膦的降解动力学及其相互作用特征仍鲜有报道。基于此, 本研究通过干筛筛分、室内控制培养、液质联用定量分析相结合等探究草甘膦降解残留, 并进一步分析团聚体理化性质与草甘膦降解的关系。结果表明: 1)不同粒径团聚体中, 草甘膦残留量随降解时间不断减小, 且粒径之间降解动力学差异不显著。降解半衰期为15.8~20.6 d, 粒径最小的团聚体(<0.25 mm)中草甘膦的降解半衰期最长, 为20.6 d。草甘膦在土壤中的主要降解产物氨甲基磷酸(AMPA)的含量随着降解时间的增加而增加, 且在第5 d达到峰值, 而后不断减小; 不同粒径团聚体间AMPA含量差异显著(<0.05)。2)相关分析及主成分分析发现, 草甘膦残留量与红壤团聚体中速效磷含量呈显著正相关(<0.05), 而其降解产物AMPA含量与团聚体中酸性磷酸酶活性及N-乙酰氨基-β-葡萄糖苷酶活性呈显著正相关(<0.05)。团聚体粒径与草甘膦残留量间没有显著相关性, 但与AMPA含量显著正相关(<0.05)。此外, 草甘膦降解过程中, 团聚体中有机质含量及β-葡萄糖苷酶、N-乙酰氨基-β-葡萄糖苷酶、酸性磷酸酶活性与团聚体粒径为显著负相关关系(<0.05)。由此表明: 红壤不同粒径团聚体影响草甘膦降解速率, 粒径最小的团聚体(<0.25 mm)中草甘膦农药的降解速率最慢, 但试验结束时, 各粒径红壤团聚体中的草甘膦和AMPA含量均较高, 可能会影响土壤健康及生态环境安全; 此外, 草甘膦降解与土壤磷素密切相关, 后续研究需探讨磷亏缺或丰盈条件下, 草甘膦农药的土壤环境特征, 为后续农田草甘膦环境风险评估提供依据。
土壤团聚体; 草甘膦; 降解动力学; 土壤磷; 红壤
农药是当前全球农业生产中重要的生产资料。草甘膦(C3H8NO5P)因低毒性、非选择性强、见效快等优点被广泛使用, 特别是随着抗草甘膦作物的大面积种植, 草甘膦农药已成为全球使用量最大的除草剂[1]。据统计, 我国草甘膦农药2018年生产量为50万t, 使用量为4万t, 2019年生产量更是达55万t[2]。然而, 随着草甘膦的大量施用, 其在农田[3-4]及周边水域[5-6]中不断累积, 特别是降解产物氨甲基磷酸(AMPA)的检测率显著增加, 并随着雨滴击溅、剥蚀搬运及径流输移进入下游生态系统, 严重威胁着人类健康及生态环境安全。
草甘膦进入土壤后, 因强烈的吸附力, 被固定在土壤颗粒中并参与土壤物理、化学、生物过程。土壤中草甘膦通过微生物降解, 降解主要有两种途径: 其一, 草甘膦在转氨酶的作用下C—N键氧化断裂生成中间产物AMPA; 其二, 草甘膦在C—P裂解酶的作用下生成肌氨酸[7-8], 其中绝大部分降解中间产物为AMPA。草甘膦在土壤中的持久性及降解在一定程度上受土壤理化性质的影响, 与土壤类型、pH、有机质含量、温度、含水量等密切相关, 从而草甘膦在土壤中的半衰期差异较大。Mamy等[9]研究发现, 不同类型土壤中草甘膦的降解速率差异显著(<0.05), 在pH小的砂质黏壤土中的残留量明显高于其他土壤类型, 并且沙土含量较高的土壤中草甘膦的半衰期小于1 d, 黏土含量较高的土壤中草甘膦的半衰期为3.7 d; 而胡继业等[10]研究发现草甘膦在沙质土的半衰期为9.2 d; Yang等[11]研究表明, 草甘膦在中国杨凌黄土中的降解半衰期为3.5 d; 汪立高等[12]对比发现草甘膦在红壤、沙壤和黄壤中的半衰期分别为15.71 d、12.86 d和13.30 d。微生物降解是进入土壤草甘膦衰减的重要途径, 微生物活性及群落特征直接影响着其在土壤中的消散。谢怡等[13]研究发现, 草甘膦在水稻土中的自然降解半衰期为38.72 d, 而灭菌除去原生微生物后, 半衰期可延长至96.27 d。长期施用草甘膦的土壤中, 存在种类繁多的能耐受或降解草甘膦的微生物类群, 如假单胞菌属()、无色菌属()、青霉属()、嗜热菌属()等, 它们能够以草甘膦为碳源、氮源、磷源等生长, 不仅对土壤的物质转化起到推动作用, 同时也可以加速草甘膦农药降解[14]。尚轶等[15]从草甘膦污染土壤中分离得到的菌株G1以草甘膦为唯一的碳源, 草甘膦降解率达71.76%; 石成春等[16]分离得到的黑曲霉B21对草甘膦的降解率达97%; 汤鸣强等[17]分离得到的以草甘膦为唯一碳源、氮源生长的酵母菌ZM-1对草甘膦降解率为85.38%。然而, 基于不同试验研究的条件及研究手段, 草甘膦在土壤中的行为追踪还存在较大的不足, 其衰减及消散仍需进一步研究与探讨。
目前, 针对草甘膦的研究主要集中在土壤类型、整个土体耕层以及环境因素对其降解衰减的影响。然而, 受田间环境的影响, 草甘膦及其降解产物会随着土壤颗粒的剥蚀, 在土壤内部或被地表径流冲刷下搬运、转移并在土壤颗粒上衰减消散, 因此土壤颗粒性质, 特别是土壤团聚体理化特征对其环境行为起着重要作用。潘吉秀等[18]研究表明, 六氯苯、多环芳烃等有机污染物在土壤不同粒径团聚体中的含量随粒径减小先降低后升高, 滴滴涕含量随粒径减小先升高后降低; 黄玉芬等[19]研究了土壤不同粒径团聚体对农药丁草胺的吸附, 发现其吸附能力由大到小依次为黏粒(<0.002 mm)、粉粒(0.002~0.02 mm)、砂粒(0.02~0.05 mm)。Bento等[20]通过风洞模拟试验研究了草甘膦在风蚀过程中的分布及降解情况, 发现不同土壤粒径上草甘膦和AMPA含量差异显著, 且随粒径的增加而降低。然而, Bento等[20]的研究缺乏对不同颗粒团聚体性质的分析, 且风洞试验模拟时间较短, 无法进一步探明草甘膦在颗粒上的降解衰减动力学特征, 从而给后续污染评价带来诸多的不确定性。鉴于此, 本研究采用室内模拟培养试验, 研究红壤不同粒径团聚体中草甘膦的降解动力学及不同粒径团聚体理化性质与草甘膦降解的关系, 为进一步探究草甘膦在土壤团聚体中的衰减规律以及风险评估提供参考依据。
1 材料与方法
1.1 试验土壤
试验选用中国农业科学院祁阳红壤实验站周边农田土壤作为试验土样(0~30 cm, 田间持水量25%), 去除土壤中的枯落物、根系及砾石等杂质, 对大土块进行破碎处理, 并在野外条件下全部过2 mm筛, 风干后带回实验室, 在采集和运输过程中尽量减少对土样的扰动, 以免破坏土壤团聚体。在室内采用干筛法, 将土壤进行筛分, 过筛孔径分别为2 mm、1 mm、0.25 mm、0.05 mm, 其质量比分别为26.01%、49.77%、23.80%、0.42%。筛分过程中, 由于<0.05 mm粒径的土壤较少, 与上一级筛分粒径0.25 mm的土壤混合使用, 从而得到待试土壤粒径为: <2 mm (未筛分土样)、1~2 mm、0.25~1 mm、<0.25 mm, 其基本化学性质如表1所示。

表1 试验用红壤不同粒径团聚体的基本性质
1.2 研究方法
将筛分好的土壤分别放入自封袋中, 调节土壤水分为田间持水量的60%, 然后放入培养箱中, 调节气候箱温度为(25±0.5) ℃, 湿度为(80±2)%, 光照16 h, 黑暗8 h, 培养7 d, 每天进行两次水分调节, 使其土壤含水量保持稳定。预培养结束后, 分别称取4种粒径团聚体57.5 g放入白色塑料盒中(直径为7 cm, 高10 cm), 每种粒径团聚体称取21盒, 喷施配制好的草甘膦溶液, 浓度为15 μg∙g−1, 与土壤混合均匀, 同时设置空白对照试验。在培养期间, 监测土壤水分变化, 并进行每日两次调节, 校对土壤水分含量。在添加农药后的0 d、1 d、3 d、5 d、7 d、14 d和30 d采样, 采样时将培养盒中的土壤混合均匀后全部收集, 同种粒径的团聚体每次采集3盒, 作为试验重复样品。迅速将采集的样品分成两部分, 一部分迅速冷冻保存(−20 ℃), 以测试不同粒径团聚体草甘膦、AMPA含量以及酶活性; 另一部分风干, 用来分析土壤团聚体的理化性质。
1.3 草甘膦与AMPA的测定
1.3.1 试剂
草甘膦和氨甲基磷酸(AMPA)(纯度≥98%)购自美国Sigma-Aldrich公司, 100 μg·L−1的草甘膦同位素内标物(13C2-15N-GLY)和AMPA同位素内标物(13C-15N-AMPA)购自德国Augsburg公司, 氯甲酸-9-芴基甲酯(纯度≥98%)购自瑞士Sigma-Aldrich公司, 十水合四硼酸钠(纯度≥99.5%)购自美国Sigma-Aldrich公司, 氢氧化钾和盐酸(分析纯)购自德国Darmstadt公司, 甲醇和乙腈(色谱纯)购自荷兰All Chemicals公司, 甲酸(纯度≥98%)购自荷兰Gevaar公司, 乙酸铵(色谱纯)购自美国Sigma公司, 氨溶液(纯度25%)购自德国Merck KGaA公司, 试验用水为超纯水。
1.3.2 草甘膦和AMPA的提取和衍生
将2 g不同粒级土壤团聚体加入到50 mL塑料离心管中, 加入10 mL 0.6 mol∙L−1的KOH对土壤样本进行浸提, 经震荡机震荡1 h后放入离心机在3500 r∙min−1下离心15 min。吸取1 mL上清液至10 mL离心管中, 加入80 μL 6 mol∙L−1的HCl调节pH至9左右, 然后加入40 μL的5 μg∙mL−1同位素标记的草甘膦/AMPA混合溶液, 充分混合后加入0.5 mL浓度为5%的硼酸盐缓冲液及0.5 mL 6.5 mmol∙L−1的FMOC-Cl, 震荡试管使溶液充分混合均匀, 在室温条件下衍生反应30 min。衍生反应结束后, 加入50 μL蚁酸, 再次混匀试管内的溶液, 并将0.5 mL的衍生物转移且过0.45 μm膜的测试瓶中待试。标准曲线采用0 μg∙mL−1、0.01 μg∙mL−1、0.02 μg∙mL−1、0.04 μg∙mL−1、0.1 μg∙mL−1、0.2 μg∙mL−1、0.4 μg∙mL−1、1 μg∙mL−1、2 μg∙mL−1和4 μg∙mL−1的标准溶液, 其衍生方式与样品相同[21]。
1.3.3 高效液相色谱-串联质谱法
色谱柱: XBridge™ Shield RP C18色谱柱(孔径3.5 μm, 长度150 mm, 内径2.1 mm)。流动相为溶于超纯水的5 mmol∙L−1NH4Ac (溶剂A, pH=9)和比例为9∶1的MeOH∶H2O溶液(溶剂B, pH=9), 使用25% NH3将pH调整至约9。洗脱程序为: 0~1 min, 100% A∶0 B; 1~6 min, 溶剂B从0到100%线性增加; 6~8 min, 0 A∶100% B; 8~9 min, B从100%线性降低至0; 9~14 min, 100% A∶0 B。柱温为35.0 ℃, 流速为0.4 mL∙min−1, 在1 min内重新建立初始条件, 总运行时间为15 min。使用以下离子源参数在负离子模式下进行电喷雾电离可获得最佳响应: 毛细管电压3500 V, 锥管电压20 V, 离子源温度120 ℃, 脱溶气体温度400 ℃, 气流160~200 L∙h−1(锥管)和580~600 L∙h−1(脱溶), 具体参考Yang等[21]的研究。
1.4 团聚体理化性质测定
团聚体的理化性质测试方法如下: 采用0.5 mol∙L−1NaHCO3溶液浸提, 钼锑抗比色法测土壤样品速效磷含量; 采用重铬酸钾容量法测土壤有机质含量; 采用H2SO4-HClO4消解法测土壤全磷含量; 采用凯式法消解, 凯式定氮仪测定土壤全氮含量; 采用微孔板荧光法测量土壤中β-葡萄糖苷酶(BG)、N-乙酰氨基-β-葡萄糖苷酶(NAG)和酸性磷酸酶(ACP)活性。
1.5 数据统计与分析
基于草甘膦的化学特征, 其在土壤中衰减特征采用一级动力学降解模型拟合(SFO)。
C=C0´e (1)
式中:是时间的草甘膦浓度,0是初始草甘膦浓度(=0),是降解速率常数。
化学污染物的半衰期是评估其是否对环境造成威胁的重要参数, 因此用草甘膦的半衰期(DT50)表征草甘膦在土壤中的残留状况, 并分析其潜在威胁。草甘膦降解半衰期采用式(2)计算。
DT50=ln2/(2)
数据采用SPSS 26.0进行统计分析, 采用单因素方差分析(One-way ANOVA)比较红壤不同粒径团聚体中草甘膦、AMPA含量以及土壤理化性质在相同培养时间的显著性差异, 多重比较采用Duncan法(<0.05); 使用SPSS 26.0进行相关性分析和主成分分析; 运用OriginPro 9.1进行数据绘图并进行数据的拟合。
2 结果与分析
2.1 不同粒径团聚体中草甘膦及AMPA含量特征及降解动力学曲线
红壤不同粒径团聚体中草甘膦与AMPA含量随培养时间的变化差异显著(图1)。在培养初期, 4种粒径团聚体中草甘膦残留量快速下降, 到喷施后的第5 d, 4种粒径团聚体中草甘膦残留量分别降低30.0% (<2 mm)、33.4% (1~2 mm)、37.0% (0.25~ 1 mm)、34.8% (<0.25 mm); 然而随着观测时间的延长, 草甘膦残留量逐渐降低, 各粒径间草甘膦残留量差异不显著(图1A)。相对应的, 4种粒径团聚体中AMPA含量在喷施初期呈快速增长趋势, 各粒径间差异不显著, 且在第5 d达浓度峰值; 之后随着观测时间的推移, AMPA含量逐渐下降(图1B), 各粒径间的含量差异显著(<0.05)。这是因为在加入草甘膦初期, 草甘膦降解生成AMPA, 土壤中AMPA含量开始增加, 但同时AMPA本身也会发生降解, 因此随着观测时间的推移, 其含量逐渐下降。4种粒径团聚体中AMPA的含量峰值分别为2.21 μg·g–1(<2 mm)、2.43 μg·g–1(1~2 mm)、2.14 μg·g–1(0.25~1 mm)和2.47 μg·g–1(<0.25 mm); 但随着时间的推移, AMPA含量随团聚体粒径的增加而增加, 以1~2 mm粒径最高, <0.25 mm粒径最低。
对不同粒径团聚体中草甘膦残留量采用一级动力学模型拟和其降解过程(表2)。结果表明, 不同粒径团聚体中草甘膦的降解动力学符合一级动力学模型,2分别为0.73 (<2 mm)、0.73 (1~2 mm)、0.62 (0.25~1 mm)、0.65 (<0.25 mm)。4种粒径团聚体中, 草甘膦的半衰期分别为18.5 d (<2 mm)、15.8 d (1~2 mm)、17.7 d (0.25~1 mm)、20.6 d (<0.25 mm)。可以看出, 除未筛分土样外, 草甘膦半衰期均随着土壤团聚体粒径的增加而降低, 而<2 mm的未筛分土样的草甘膦半衰期介于0.25~1 mm和<0.25 mm团聚体之间。

表2 红壤不同粒径团聚体中草甘膦降解动力学方程
2.2 不同粒径团聚体理化性质及酶活性
2.2.1 理化性质
4种粒径团聚体土壤理化性质如表3所示。由表3可知, 有机质含量随培养时间的增加波动明显, 特别是喷施草甘膦1~3 d后, 有机质含量下降(除未筛分土样外), 此时其最小值分别为15.84 g∙kg−1(1~2 mm)、16.37 g∙kg−1(0.25~1 mm)和18.04 g∙kg−1(<0.25 mm); 此后逐渐增加, 除未筛分土样在喷施草甘膦7 d后达最大值17.30 g∙kg−1外, 其余粒径团聚体有机质含量均在喷施后5 d达最大值, 分别为16.33 g∙kg−1(1~2 mm)、17.34 g∙kg−1(0.25~1 mm)和19.41 g∙kg−1(<0.25 mm); 随着培养时间的延长, 有机质含量逐渐降低, 在喷施后30 d (未筛分土壤除外)各粒径的含量低于喷施后0 d, 略有减少。<0.25 mm团聚体与0.25~1 mm团聚体、1~2 mm团聚体和未筛分土样的有机质含量差异显著, 土壤粒径小的有机质含量高。
添加草甘膦后, 4种粒径团聚体的全氮含量整体变化相似, 随培养时间增加先上升后下降, 但变化幅度有所不同(表3), <0.25 mm团聚体全氮含量在喷施后1 d达最大值(1.21 g∙kg−1), 其余粒径则在喷施后5~7 d达最大值, 分别为1.15 g∙kg−1(<2 mm)、1.20 g∙kg−1(1~2 mm)、1.10 g∙kg−1(0.25~1 mm)。此后, 随着培养时间的延长, 全氮含量逐渐减小, 喷施农药30 d后各粒径中全氮含量高于喷施后0 d, 略有增加。4种粒径团聚体全氮含量的变化可能是由于不是完全封闭试验, 在草甘膦降解期间, 土壤中有氮的进入与释放, 与土壤中利用氮源的微生物有关。<0.25 mm团聚体与0.25~1 mm、1~2 mm团聚体和未筛分土样的全氮含量差异显著, 土壤粒径小的全氮含量高。
由表3知, 红壤各粒径团聚体间全磷含量差异不显著。同时, 在农药喷施0~1 d后, 速效磷含量达最大值, 分别为0.15 g∙kg−1(<2 mm)、0.15 g∙kg−1(1~2 mm)、0.14 g∙kg−1(0.25~1 mm)和0.15 g∙kg−1(<0.25 mm); 此后逐渐降低, 于喷施后5 d达最小值, 分别为0.12 g∙kg−1(<2 mm)、0.12 g∙kg−1(1~2 mm)、0.13 g∙kg−1(0.25~1 mm)和0.12 g∙kg−1(<0.25 mm); 然而, 随着培养时间的延长, 速效磷含量逐渐增加, 喷施农药30 d后各粒径中速效磷含量与喷施后5 d的含量接近, 且各种粒径间速效磷含量差异并不显著。

表3 喷施草甘膦后不同时间红壤不同粒径团聚体的性质
不同小写字母表示同一指标同一时间不同粒径间差异在<0.05水平显著。Different lowercase letters indicate significant differences among different aggregate sizes for the same index at the same time at<0.05 level.
2.2.2 酶活性
4种粒径团聚体喷施草甘膦后相对于对照的β-葡萄糖苷酶(BG)活性及变化率见图2a与图2b。结果表明: 各粒径间BG活性及变化率变化趋势相似, 随培养时间波动明显, 且存在一定的差异。喷施草甘膦后, 首先抑制BG活性, 之后随培养时间延长, 可能由于微生物对环境刺激的适应性加强, 再加上草甘膦提供了新的碳源, 草甘膦对BG活性由抑制变为激活, BG活性于喷施3 d后达最大值, 分别为38.18 μmol∙kg−1∙h−1(<2 mm)、33.46 μmol∙kg−1∙h−1(1~2 mm)、58.05 μmol∙kg−1∙h−1(0.25~1 mm)、77.35 μmol∙kg−1∙h−1(<0.25 mm)。然而喷施后7~14 d草甘膦对BG活性又表现为明显的抑制作用, BG活性小幅度下降, 与刚喷施时接近。这可能是因为土壤中某些碳源消耗殆尽, 而利用这些碳源的微生物繁殖受到抑制, 但随着培养时间的延长, 抑制作用逐渐减弱, BG活性逐渐恢复到对照水平。在相同培养时间, BG活性随土壤粒径减小而增大, 较小土壤团聚体中含有较高BG活性。
由图2c和图2d可知, 4种粒径团聚体N-乙酰氨基-β-葡萄糖苷酶(NAG)活性及其变化率随时间变化波动明显, 在喷施草甘膦当天, 受草甘膦抑制, NAG活性逐渐下降, 活性变化率于喷施后1 d达最小值, 分别为−59.90% (<2 mm)、−90.64% (1~2 mm)、−73.55% (0.25~1 mm)、−24.48% (<0.25 mm)。之后, 可能部分微生物能够利用草甘膦作为新的氮源, 草甘膦对NAG的抑制作用逐渐减弱并转变为激活, NAG活性变化率于喷施后3 d达最大值, 分别为245.83% (<2 mm)、1047.17% (1~2 mm)、144.09% (0.25~1 mm)、233.82% (<0.25 mm); 此时, NAG活性达最大值, 分别为21.78 μmol∙kg−1∙h−1(<2 mm)、31.68 μmol∙kg−1∙h−1(1~2 mm)、20.48 μmol∙kg−1∙h−1(0.25~1 mm)、27.23 μmol∙kg−1∙h−1(<0.25 mm); 然而随草甘膦不断降解, NAG活性逐渐恢复到对照水平。在整个培养过程中, 各粒径间NAG活性大部分时间随土壤粒径减小而增加; 未筛分土样NAG活性大部分时间介于其他3种土壤粒径之间。
4种粒径团聚体酸性磷酸酶(ACP)活性及变化率见图2e和图2f。ACP活性随时间增加波动明显, 喷施草甘膦后, ACP活性迅速增加, 于第1 d达到峰值, 分别为125.82 μmol∙kg−1∙h−1(<2 mm)、92.50 μmol∙kg−1∙h−1(1~2 mm)、87.34 μmol∙kg−1∙h−1(0.25~1 mm)、162.90 μmol∙kg−1∙h−1(<0.25 mm); 此后ACP活性逐渐下降。而喷施草甘膦后3~30 d与0~3 d变化趋势相似, 于7 d达到峰值, 分别为157.90 μmol∙kg−1∙h−1(<2 mm)、86.14 μmol∙kg−1∙h−1(1~2 mm)、102.83 μmol∙kg−1∙h−1(0.25~1 mm)、193.58 μmol∙kg−1∙h−1(<0.25 mm), 与第1 d活性相比较高; 值得注意的是, 喷施农药30 d后各粒径中ACP活性与喷施后第0 d的活性接近, 趋于增加。不同培养时期, 土壤ACP活性随团聚体粒径的减小而增加。由图2f可知, 在培养过程中, 添加草甘膦对4种粒径团聚体ACP活性大部分时间都表现出抑制作用, ACP活性在试验结束后仍未恢复到对照水平。
2.3 红壤团聚体特征与草甘膦降解特征的相关性
运用SPSS对草甘膦在团聚体土壤中的残留量与团聚体粒径、AMPA含量、速效磷含量、有机质含量、相关酶活性等进行相关性分析(表4), 结果表明: 团聚体粒径与土壤有机质、BG活性、NAG活性、ACP活性显著负相关(<0.05), 但团聚体粒径与草甘膦残留量间没有显著相关性, 团聚体粒径与AMPA含量显著正相关(<0.05)。微生物在降解草甘膦时, 会影响土壤性质。从表4可知, 草甘膦在土壤中的残留量与速效磷含量呈显著正相关(<0.05), 与土壤有机质含量和BG、NAG、ACP活性无显著相关性。AMPA含量与NAG、ACP活性显著正相关(<0.05)。
对草甘膦残留量、速效磷含量、有机质含量、BG活性、NAG活性、ACP活性进行主成分分析, 并提取两种主成分, 其贡献率分别为41.56%和21.24%。不同粒径团聚体草甘膦残留量和速效磷含量、有机质含量、BG活性、NAG活性、ACP活性的主成分得分在第2主成分出现明显的分布差异: <0.25 mm团聚体分布于第2主成分正方向上, 1~2 mm团聚体、0.25~1 mm团聚体分布于第2主成分负方向上(图3a)。而从图3b看出, 对第1主成分起主要作用的指标是BG酶活性、NAG酶活性等, 命名为土壤酶活性; 对第2主成分起主要作用的指标是草甘膦残留量与速效磷含量, 命名为土壤磷含量。
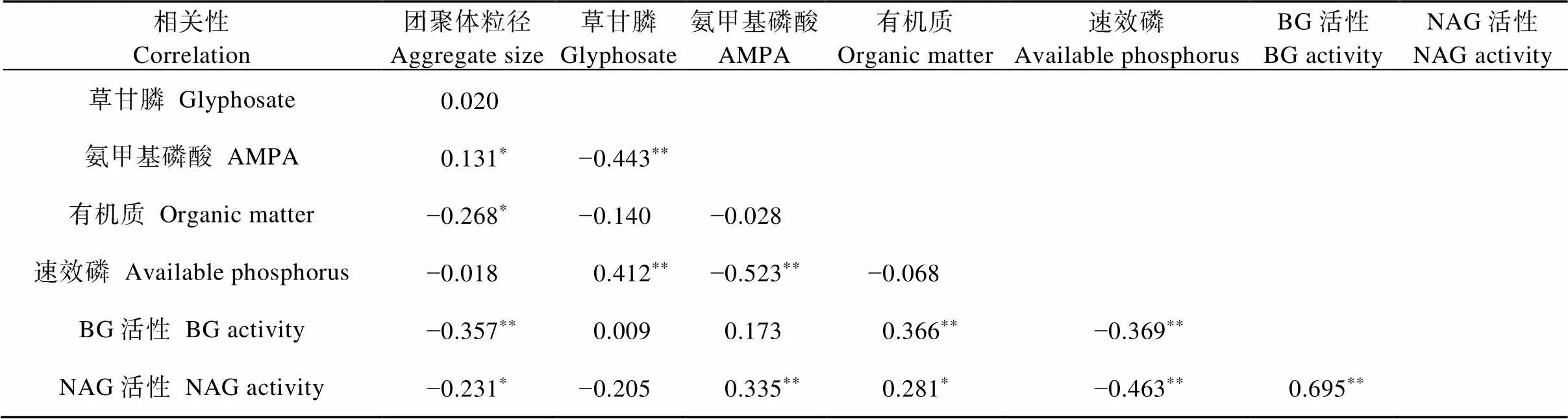
表4 团聚体粒径与草甘膦及氨甲基磷酸(AMPA)含量的相关性分析
BG: β-葡萄糖苷酶; NAG: N-乙酰氨基-β-葡萄糖苷酶; ACP: 酸性磷酸酶。*和**分别表示显著性水平为<0.05和<0.01。BG: β-glucosidase; NAG: N-acetylamino-β-glucosidase; ACP: acid phosphatase. * and ** indicate significant correlation at<0.05 and<0.01 levels, respectively.
Gly: 草甘膦残留量; OM: 有机质含量; AP: 速效磷含量; BG: β-葡萄糖苷酶活性; NAG: N-乙酰氨基-β-葡萄糖苷酶活性; ACP: 酸性磷酸酶活性。Gly: glyphosate residue; OM: organic matter content; AP: available phosphorus content; BG: β-glucosidase activity; NAG: N-acetylamino-β-glucosidase activity; ACP: acid phosphatase activity.
3 讨论
3.1 红壤不同粒径团聚体中草甘膦及AMPA的变化特征
随着草甘膦使用量的增加, 农田土壤中草甘膦及其代谢产物AMPA的出现引发了人们对草甘膦环境风险的高度关注与研究, 而从不同粒径微观尺度研究草甘膦在土壤中的衰减特征有助于更深一步了解草甘膦在土壤中的环境行为和后续评估农田侵蚀性污染风险。不同粒径团聚体特性不同, 对有机污染物的降解、吸附等特征不同, 在养分的保持和供应中的作用不同[22]。有研究发现, 大部分重金属如Cd、Cu、Pb和Zn等在土壤中的含量都随着土壤粒径的减小而增加[23-25], 部分农药如六六六(BHC)、滴滴涕(DDT)等的残留量随土壤粒径的减小而增大[26], 而部分农药如氯丹等的残留量则随土壤粒径的减小先减小后增大[27], 说明土壤粒径对不同污染物的影响不同。本研究结果表明, 红壤不同粒径团聚体中的草甘膦残留量差异不显著, 说明粒径对草甘膦在红壤团聚体中的残留量影响不明显。但喷施后期, 在粒径小的团聚体中, 草甘膦残留量略高于较大粒级的土壤团聚体, 这一结果可能与土壤对草甘膦的吸附有关。研究表明, 草甘膦的吸附过程主要通过配位体交换, 与矿物化合物、有机质等形成络合物。一方面粒径小的团聚体比表面积大, 吸附点位多, 对草甘膦的吸附量相比于粒径大的团聚体不容易达到饱和; 另一方面, 有机质含量与吸附量呈正相关, 而粒径小的团聚体有机质含量高, 草甘膦更容易被吸附, 且吸附后的回收率也相对较低[28]。另外, 草甘膦进入土壤后易降解, 在施用草甘膦2 h内, 草甘膦会立即降解产生AMPA[29]; 同样, Paudel等[30]发现, AMPA会在反应的1 min内形成。本研究在喷施草甘膦当天检测到了AMPA则佐证了这一结论。
Yang等[11]研究表明, 自然条件下草甘膦在黄土中的残留量随时间变化差异显著, 初期快速下降, 随后缓慢下降, 符合一级动力学降解模型, 而AMPA含量则随时间增加先快速上升后逐渐下降, 这一结果与本试验结果类似, 说明草甘膦衰减和AMPA形成与降解在不同土壤类型中的总体差异不大, 但拟合的降解模型的值却与Yang等[11]相比相差1个数量级。本研究拟合结果可以看出, 不同粒径团聚体草甘膦降解动力学拟合参数2均低于0.8; 从初始浓度0可以判断, 模型预测值与其实测值有所差别, 因此在后续研究或模型应用时, 应该考虑预测效率。通过拟合方程, 本研究得到的草甘膦在红壤4种粒径团聚体中的半衰期分别为18.5 d (未筛分土样)、15.8 d (1~2 mm)、17.7 d (0.25~1 mm)、20.6 d (<0.25 mm), 均比Yang等[11]计算的半衰期长, 介于沙土(16.9 d)和黏土(110 d)之间[31], 且半衰期随着团聚体粒径的减小而增大。草甘膦半衰期在不同研究中存在差异的原因可能有两种: 一是在实验室中估计的草甘膦半衰期不能真实反映田间草甘膦的降解, 特别是在环境系统的动态变化[32]。汪立高等[12]报道草甘膦在红壤自然环境下的半衰期为15.71 d, 比本研究在实验室中的模拟结果低; Litz等[33]报道在8 ℃的实验室条件下草甘膦的半衰期为30 d, 其衰减率为0.023 d−1, 但是高温野外条件下草甘膦的衰减更快, 半衰期为7.5~10.5 d。二是不同粒径团聚体性质存在差异(表1), 土壤性质的复杂作用会影响草甘膦在土壤中的降解, 如土壤pH[34]等。
3.2 不同粒径团聚体中草甘膦降解与土壤性质和酶活性的关系
通常来说, 微生物的代谢会影响草甘膦在土壤中的吸附、迁移、降解等, 进而影响土壤的物质转化, 使土壤的一些理化性质发生相应的变化。研究表明, 短期使用93.7 μg∙g−1的草甘膦, 使红壤全氮含量增加, 速效磷、有机质含量减少[34], 这与本研究结果类似。毛美红等[35]研究发现, 长期施用草甘膦的土壤, 有机质有所减少, 但全氮、全磷、速效磷无显著变化; 林德喜等[36]发现喷施1年草甘膦, 土壤性质变化不明显, 而喷施2年, 土壤有机质、全氮等都有不同程度的提高。两个研究同属于长期施用草甘膦对土壤性质的影响研究, 但结果却有所不同,说明草甘膦在土壤中的不断积累对土壤性质的影响是复杂的, 进行风险评估时要关注草甘膦的施用年限。另外, 草甘膦与磷酸盐存在着吸附位点的竞争, 草甘膦的存在占据了磷在土壤上的吸附位点, 且草甘膦浓度越高竞争得到的吸附位点越多[37], 因此速效磷含量随草甘膦的降解而减少, 两者呈显著正相关(<0.05, 表4)。刘合明等[38]研究发现在3种农田土壤中不同粒径团聚体有机碳含量差异显著, 且随粒径减少而增加, 这与本研究结果一致。但马瑞萍等[39]发现有机碳在森林带黄土随着团聚体粒径的减小而先逐渐增加再减少, 在草原带黄土中则随粒径的减小而增加; 同时黄荣珍等[40]研究发现不同作物红壤团聚体有机质随粒径减小先减少后增加再减少。造成这种差异的原因可能有两种: 一是团聚体有机质含量可能因植被方式的变化而不同; 二是筛分选择的粒径不同, 研究的团聚体粒径大小不统一。
土壤酶主要来自于土壤中微生物的生命活动, 参与了土壤中绝大多数生化过程, 在碳、氮、磷循环过程发挥着重要的作用, 与土壤微生物一起对土壤的物质转化起到推动作用[41]。通常认为, β-葡萄糖苷酶(BG)、N-乙酰氨基-β-葡萄糖苷酶(NAG)和酸性磷酸酶(ACP)等是微生物分泌的碳、氮和磷获取酶, 其活性可以作为微生物获取碳、氮和磷的资源分配的替代指标[42-43], 因为其他相关酶的活性通常低于这些酶并与之相关。草甘膦进入土壤后, 会与土壤酶发生反应, 酶活性可能被激活或被抑制, 其特征变化可反映草甘膦在土壤中的环境行为及土壤污染程度[44]。磷酸酶能促进分解各种有机磷化合物。呼蕾等[45]研究发现50~2000 μg∙g−1的草甘膦、邓晓等[46]研究发现50~500 μg∙g−1的草甘膦, 都抑制ACP活性, 且随着草甘膦浓度的增加抑制程度加深。而本研究喷施的草甘膦浓度为15 μg∙g−1, 草甘膦对ACP也表现出抑制作用(图2c), 说明草甘膦在低浓度也抑制ACP活性, 可能是因为草甘膦中存在磷酸基团, 与磷酸酶存在竞争关系, 但需要进一步研究。红壤不同粒经团聚体磷酸酶活性随粒径减小而增大, 这是因为粒径小的团聚体表面吸附有大量的草甘膦, 降低了草甘膦对磷酸酶活性的抑制作用。另外, 草甘膦在降解过程中, BG和NAG活性波动变化大, 草甘膦对其既有激活作用, 也有抑制作用, 但最后两种酶活性均恢复到未喷施草甘膦的水平。
4 结论
1)红壤不同粒径团聚体中草甘膦的衰减符合一级动力学降解模型, 其半衰期分别为18.5 d (未筛分土样)、15.8 d (1~2 mm)、17.7 d (0.25~1 mm)、20.6 d (<0.25 mm), 半衰期随团聚体粒径的减小而增加(未筛分土样外); 而AMPA含量随培养时间增加先上升后下降。不同粒径间草甘膦残留量差异不显著, 而不同粒径间AMPA含量差异显著(<0.05), 随团聚体粒径增大而增加。
2)喷施草甘膦后, 不同粒径团聚体有机质、全氮及速效磷含量变化较大, 特别是速效磷含量随着草甘膦农药的降解呈现强烈的波动, 这可能是因为草甘膦与速效磷在土壤颗粒表面吸附点位类似, 相互之间存在竞争导致的; 但后期随着草甘膦的降解及矿化, 速效磷含量波动相对较小。而受喷施草甘膦影响, 土壤酸性磷酸酶活性明显受到抑制, 而β-葡萄糖苷酶活性表现为先增加后减小的趋势, N-乙酰氨基-β-葡萄糖苷酶活性波动较大。此外, 主成分及相关分析表明, 团聚体粒径与有机质含量及β-葡萄糖苷酶、N-乙酰氨基-β-葡萄糖苷酶、酸性磷酸酶活性呈显著负相关(<0.05), 而团聚体粒径与AMPA含量呈显著正相关(<0.05), 草甘膦在土壤团聚体中的残留量与速效磷含量呈显著正相关(<0.05), 草甘膦的降解与土壤中的磷密切相关。因此, 后续还应探讨磷亏缺或丰盈条件下, 草甘膦的环境特征, 以期为后续农田草甘膦环境风险评估提供依据。
[1] 顾安乐, 柏亚罗. 水稻用农药市场概况、产品开发及重点品种(Ⅱ)[J]. 现代农药, 2018, 17(6): 1–5 GU A L, BAI Y L. The market profile, product development and key products of the rice pesticide[J]. Modern Agrochemicals, 2018, 17(6): 1–5
[2] 杨益军, 张波, 吴江. 全球(中国)草甘膦行业(市场)发展状况及2020年展望[J]. 农药市场信息, 2020, (4): 31–32 YANG Y J, ZHANG B, WU J. Global (China) glyphosate industry (market) development status and 2020 outlook[J]. Pesticide Market News, 2020, (4): 31–32
[3] ALONSO L L, DEMETRIO P M, ETCHEGOYEN M A, et al. Glyphosate and atrazine in rainfall and soils in agroproductive areas of the pampas region in Argentina[J]. Science of The Total Environment, 2018, 645: 89–96
[4] PRIMOST J E, MARINO D J G, APARICIO V C, et al. Glyphosate and AMPA, “pseudo-persistent” pollutants under real-world agricultural management practices in the Mesopotamic Pampas agroecosystem, Argentina[J]. Environmental Pollution, 2017, 229: 771–779
[5] OKADA E, ALLINSON M, BARRAL M P, et al. Glyphosate and aminomethylphosphonic acid (AMPA) are commonly found in urban streams and wetlands of Melbourne, Australia[J]. Water Research, 2020, 168: 115139
[6] 魏琛, 宋丽婧, 杨卫萍, 等. 贵阳市地表水中草甘膦农药残留研究[J]. 环境科学与技术, 2016, 39(3): 126–130 WEI C, SONG L J, YANG W P, et al. Research on glyphosate pesticide residue in surface water in Guiyang[J]. Environmental Science & Technology, 2016, 39(3): 126–130
[7] CARLES L, GARDON H, JOSEPH L, et al. Meta-analysis of glyphosate contamination in surface waters and dissipation by biofilms[J]. Environment International, 2019, 124: 284–293
[8] BORGGAARD O K, GIMSING A L. Fate of glyphosate in soil and the possibility of leaching to ground and surface waters: A review[J]. Pest Management Science, 2008, 64(4): 441–456
[9] MAMY L, BARRIUSO E, GABRIELLE B. Environmental fate of herbicides trifluralin, metazachlor, metamitron and sulcotrione compared with that of glyphosate, a substitute broad spectrum herbicide for different glyphosate-resistant crops[J]. Pest Management Science, 2005, 61(9): 905–916
[10] 胡继业, 赵殿英, 宁君, 等. 气相色谱-氮磷检测器测定草甘膦在土壤和苹果中的残留量[J]. 农药学学报, 2007, 9(3): 285–290 HU J Y, ZHAO D Y, NING J, et al. Determination of glyphosate residues in soil and apple by capillary gas chromatography with nitrogen-phosphorus detection[J]. Chinese Journal of Pesticide Science, 2007, 9(3): 285–290
[11] YANG X M, WANG F, BENTO C P M, et al. Decay characteristics and erosion-related transport of glyphosate in Chinese loess soil under field conditions[J]. Science of The Total Environment, 2015, 530/531: 87–95
[12] 汪立高, 杨仁斌, 魏凤. 土壤中残留草甘膦检测方法及其消解动态研究[J]. 湖南农业科学, 2011, (23): 85–88 WANG L G, YANG R B, WEI F. Detection method and degradation dynamics of isopropylamine salt of glyphosate in soil[J]. Hunan Agricultural Sciences, 2011, (23): 85–88
[13] 谢怡, 陈杰, 黄祥, 等. 降解菌ESG4对草甘膦污染土壤的生物修复研究[J]. 环境影响评价, 2018, 40(5): 84–87 XIE Y, CHEN J, HUANG X, et al. Research on bioremediation of glyphosate contaminated soil bysp. ESG4[J]. Environmental Impact Assessment, 2018, 40(5): 84–87
[14] OBOJSKA A, TERNAN N G, LEJCZAK B, et al. Organophosphonate utilization by the thermophileT20[J]. Applied and Environmental Microbiology, 2002, 68(4): 2081–2084
[15] 尚轶, 沈慧敏, 杨顺义, 等. 草甘膦降解菌的分离及其降解效能研究[J]. 湖北农业科学, 2011, 50(9): 1770–1772 SHANG Y, SHEN H M, YANG S Y, et al. Screening and isolation of bacteria degrading herbicide glyphosate and its degradation efficiency[J]. Hubei Agricultural Sciences, 2011, 50(9): 1770–1772
[16] 石成春, 郭养浩, 王大奈, 等. 草甘膦曲霉生物降解的动力学研究[J]. 中国环境科学, 2005, 25(3): 361–365 SHI C C, GUO Y H, WANG D N, et al. Studies on the kinetics of the biodegradation of glyphosate by[J]. China Environmental Science, 2005, 25(3): 361–365
[17] 汤鸣强, 尤民生. 抗草甘膦酵母菌ZM-1的分离鉴定及其生长降解特性[J]. 微生物学通报, 2010, 37(9): 1402–1409 TANG M Q, YOU M S. Isolation and identification of a glyphosate-resistant yeasty strain (ZM-1) and its optimal growth and degradation traits[J]. Microbiology China, 2010, 37(9): 1402–1409
[18] 潘吉秀, 夏天翔, 姜林, 等. 工业污染土壤中不同粒径下的三种典型有机污染物分布规律研究[J]. 土壤通报, 2014, 45(2): 462–468 PAN J X, XIA T X, JIANG L, et al. Distribution of organic pollutants in different size soil particles from industrial sites[J]. Chinese Journal of Soil Science, 2014, 45(2): 462–468
[19] 黄玉芬, 刘忠珍, 魏岚, 等. 土壤不同粒径有机无机复合体对丁草胺的吸附特性[J]. 土壤学报, 2017, 54(2): 400–409 HUANG Y F, LIU Z Z, WEI L, et al. Effect of soil organo-inorganic compounds different in particle size on butachlor sorption[J]. Acta Pedologica Sinica, 2017, 54(2): 400–409
[20] BENTO C P M, GOOSSENS D, REZAEI M, et al. Glyphosate and AMPA distribution in wind-eroded sediment derived from loess soil[J]. Environmental Pollution, 2017, 220: 1079–1089
[21] YANG X M, WANG F, BENTO C P M, et al. Short-term transport of glyphosate with erosion in Chinese loess soil — A flume experiment[J]. Science of The Total Environment, 2015, 512/513: 406–414
[22] 张菁菁, 温蓓, 单孝全. 中国典型土壤不同粒径级份对六氯苯的吸附行为研究[C]//持久性有机污染物论坛2008暨第三届持久性有机污染物全国学术研讨会论文集. 北京: 中国化学会, 中国环境科学学会, 2008: 83–85 ZHANG J J, WEN B, SHAN X Q. Adsorption behavior of hexachlorobenzene on different particle size fractions of typical soils in China[C]//Proceedings of the Persistent Organic Pollutants Forum 2008 and the Third National Symposium on Persistent Organic Pollutants. Beijing: Chinese Chemical Society, Chinese Society for Environmental Sciences, 2008: 83–85
[23] ZONG Y T, XIAO Q, LU S G. Distribution, bioavailability, and leachability of heavy metals in soil particle size fractions of urban soils (northeastern China)[J]. Environmental Science and Pollution Research, 2016, 23(14): 14600–14607
[24] 龚仓, 徐殿斗, 成杭新, 等. 典型热带林地土壤团聚体颗粒中重金属的分布特征及其环境意义[J]. 环境科学, 2013, 34(3): 1094–1100 GONG C, XU D D, CHENG H X, et al. Distribution characteristics and environmental significance of heavy metals in soil particle size fractions from tropical forests in China[J]. Environmental Science, 2013, 34(3): 1094–1100
[25] FAN J L, DING W X, ZIADI N. Thirty-year manuring and fertilization effects on heavy metals in black soil and soil aggregates in northeastern China[J]. Communications in Soil Science and Plant Analysis, 2013, 44(7): 1224–1241
[26] 李勋光. 农药在土壤中的分布——DDT、BHC量与土粒粒径、有机质量之间的关系[J]. 土壤学报, 1993, 30(1): 88–93 LI X G. Distribution of pesticides in soils — relationship among contents of DDT and BHC, size of soil particle and content of organic matter[J]. Acta Pedologica Sinica, 1993, 30(1): 88–93
[27] 张胜田, 赵斌, 王风贺, 等. 不同粒径土壤对氯丹的吸附性能及其急性毒性[J]. 环境工程学报, 2017, 11(6): 3839–3845 ZHANG S T, ZHAO B, WANG F H, et al. Effects of soil particles on their adsorption performance of chloredane and their acute toxicity[J]. Chinese Journal of Environmental Engineering, 2017, 11(6): 3839–3845
[28] 孙立思, 王娜, 孔德洋, 等. 土壤理化性质对草甘膦残留检测的影响[J]. 生态与农村环境学报, 2017, 33(9): 860–864 SUN L S, WANG N, KONG D Y, et al. Influence of soil physical and chemical properties on detection of glyphosate residue[J]. Journal of Ecology and Rural Environment, 2017, 33(9): 860–864
[29] BENTO C P M, YANG X M, GORT G, et al. Persistence of glyphosate and aminomethylphosphonic acid in loess soil under different combinations of temperature, soil moisture and light/darkness[J]. Science of The Total Environment, 2016, 572: 301–311
[30] PAUDEL P, NEGUSSE A, JAISI D P. Birnessite-catalyzed degradation of glyphosate: A mechanistic study aided by kinetics batch studies and NMR spectroscopy[J]. Soil Science Society of America Journal, 2015, 79(3): 815–825
[31] BERGSTRÖM L, BÖRJESSON E, STENSTRÖM J. Laboratory and lysimeter studies of glyphosate and aminomethylphosphonic acid in a sand and a clay soil[J]. Journal of Environmental Quality, 2011, 40(1): 98–108
[32] LANCTÔT C, ROBERTSON C, NAVARRO-MARTÍN L, et al. Effects of the glyphosate-based herbicide Roundup WeatherMax®on metamorphosis of wood frogs () in natural wetlands[J]. Aquatic Toxicology, 2013, 140/141: 48–57
[33] LITZ N T, WEIGERT A, KRAUSE B, et al. Comparative studies on the retardation and reduction of glyphosate during subsurface passage[J]. Water Research, 2011, 45(10): 3047–3054
[34] 陈望舒. 草甘膦对土壤生态的影响和毒理研究[D]. 扬州: 扬州大学, 2019: 87–88 CHEN W S. Research on the effects of glyphosate on soil ecology and toxicology[D]. Yangzhou: Yangzhou University, 2019: 87–88
[35] 毛美红, 俞婷婷, 傅柳方, 等. 草甘膦对毛竹笋用林土壤理化性质的影响分析[J]. 竹子研究汇刊, 2011, 30(3): 29–32 MAO M H, YU T T, FU L F, et al. The influence of glyphosate on soil physicochemical properties of the shoot-oriented Moso bamboo forests[J]. Journal of Bamboo Research, 2011, 30(3): 29–32
[36] 林德喜, 洪长福, 黄龙发. 杉木幼林地喷施草甘膦后土壤的变化[J]. 土壤, 1998, (2): 100–102 LIN D X, HONG C F, HUANG L F. Soil changes after spraying glyphosate on young Chinese fir woodland[J]. Soils, 1998, (2): 100–102
[37] 周垂帆, 林静雯, 李莹, 等. 磷与草甘膦在酸性土壤中吸附解吸交互作用机制[J]. 农业环境科学学报, 2016, 35(12): 2367–2376 ZHOU C F, LIN J W, LI Y, et al. Competitive adsorption and desorption of glyphosate and phosphate on acid soil[J]. Journal of Agro-Environment Science, 2016, 35(12): 2367–2376
[38] 刘合明, 杨志新, 刘树庆. 不同粒径土壤活性有机碳测定方法的探讨[J]. 生态环境, 2008, 17(5): 2046–2049 LIU H M, YANG Z X, LIU S Q. Methods for determining labile orange matter in different sized soil particles of different soils[J]. Ecology and Environment, 2008, 17(5): 2046–2049
[39] 马瑞萍, 刘雷, 安韶山, 等. 黄土丘陵区不同植被群落土壤团聚体有机碳及其组分的分布[J]. 中国生态农业学报, 2013, 21(3): 324–332 MA R P, LIU L, AN S S, et al. Soil organic carbon and its fractions in aggregates under different plant communities in the hill-gully region of the loess plateau[J]. Chinese Journal of Eco-Agriculture, 2013, 21(3): 324–332
[40] 黄荣珍, 朱丽琴, 黄国敏, 等. 不同整治方式下红壤坡耕地土壤团聚体有机碳的变化[J]. 南昌工程学院学报, 2018, 37(6): 57–62 HUANG R Z, ZHU L Q, HUANG G M, et al. Soil organic carbon change in soil aggregates after different farming practices on slope field in red soil area[J]. Journal of Nanchang Institute of Technology, 2018, 37(6): 57–62
[41] 鲁晶, 杨学春. 草甘膦对环境的影响研究进展[J]. 安徽农学通报, 2017, 23(8): 71–75 LU J, YANG X C. Research progress on environmental impact of glyphosate[J]. Anhui Agricultural Science Bulletin, 2017, 23(8): 71–75
[42] FANIN N, MOORHEAD D, BERTRAND I. Eco-enzymatic stoichiometry and enzymatic vectors reveal differential C, N, P dynamics in decaying litter along a land-use gradient[J]. Biogeochemistry, 2016, 129(1/2): 21–36
[43] DENG L, PENG C H, HUANG C B, et al. Drivers of soil microbial metabolic limitation changes along a vegetation restoration gradient on the Loess Plateau, China[J]. Geoderma, 2019, 353: 188–200
[44] 崔玉侠. 草甘膦与Cu的复合污染及其对土壤酶与微生物碳/氮的影响[D]. 重庆: 西南大学, 2009: 35–38 CUI Y X. Study of combined pollution between glyphosate and Cu and its influence on the soil enzyme and microorganism carbon/nitrogen[D]. Chongqing: Southwest University, 2009: 35–38
[45] 呼蕾, 和文祥, 王旭东, 等. 草甘膦的土壤酶效应研究[J]. 农业环境科学学报, 2009, 28(4): 680–685 HU L, HE W X, WANG X D, et al. Effect of glyphosate on soil enzyme[J]. Journal of Agro-Environment Science, 2009, 28(4): 680–685
[46] 邓晓, 武春媛, 李怡, 等. 土壤微生物种群与酶活性对草铵膦和草甘膦胁迫响应的差异[J]. 农药, 2019, 58(8): 580–583 DENG X, WU C Y, LI Y, et al. Differences in the stress responses of soil microbial populations and enzyme activities to glufosinate-ammonium and glyphosate[J]. Agrochemicals, 2019, 58(8): 580–583
Effects of aggregate size on kinetics of glyphosate degradation in red soil*
XIN Longchuan1, WU Wenxue1, XUE Sha2, FU Gejuan3, CHEN Yanhua4, WANG Xuexia4, LIU Dongsheng4, YANG Xiaomei1,2**
(1. College of Natural Resources and Environment, Northwest A&F University, Yangling 712100, China; 2. Institute of Soil and Water Conservation, Northwest A&F University / The State Key Laboratory of Soil Erosion and Dryland Farming on Loess Plateau, Yangling 712100, China; 3. Xi’an Environmental Monitoring Station, Xi’an 710100, China; 4. Institute of Plant Nutrition and Resources, Beijing Academy of Agricultural and Forestry Sciences, Beijing 100097, China)
With intensive glyphosate application, its residues and consequent risks of soil health and ecological environment safety have received greater attention. The degradation kinetics of glyphosate in red soil aggregates with different sizes, as well as the interaction between physical and chemical properties of soil aggregates and the degradation of glyphosate, have rarely been studied. Thus, in this study, the degradation characteristics of glyphosate in red soil aggregates with different sizes were observed under laboratory conditions by particle pre-sieving, incubation in a controlled climatic chamber, and residue analysis via liquid chromatography-tandem mass spectrometry. The physical and chemical properties of the soil aggregates, such as contents of organic matter, total phosphorus, and available phosphorus, were tested according to the national approved methods and standards. The relationships between the physical and chemical properties of the aggregates and the degradation of glyphosate were further analyzed and compared in the same observation day. The results showed that 1) the glyphosate content decreased in the different aggregate particles during the observation period, following the single first-order kinetic degradation model. However, no significant differences were observed among different aggregate sizes. The half-life time of glyphosate in the different red soil aggregates ranged from 15.8 to 20.6 d, with a longer half-life time in the smallest aggregates (<0.25 mm, 20.6 d). The aminomethylphosphonic acid (AMPA) content, the main metabolite of glyphosate, increased immediately and peaked on the 5thday after glyphosate application, but no differences were found among different aggregates. However, the AMPA content changed and declined significantly in different aggregates after the 5thobservation day (<0.05). The contents of organic matter, total nitrogen, total phosphorus, and available phosphorus in different aggregates varied greatly, especially the available phosphorus content, which decreased with glyphosate degradation. 2) Correlation analysis and principal component analysis of glyphosate, aggregate size, and their properties showed that the residual glyphosate was significantly positively correlated with the content of available phosphorus (<0.05), and the AMPA content was significantly positively correlated with the activities of acid phosphatase and N-acetylamino-β-glucosidase (<0.05). There were no significant relationships between the aggregate size and the residuals of glyphosate, but a significant positive correlation was observed between the aggregate size and the AMPA content (<0.05). Furthermore, during the whole period of glyphosate degradation, the organic matter content, acid phosphatase, N-acetylamino-β-glucosidase, and β-glucosidase showed a significant negative relationship with the soil aggregate size (<0.05). In conclusion, the characteristics of the red soil aggregates affect the degradation kinetics of glyphosate, as well as the persistence of AMPA, especially the residuals in the smallest aggregates (<0.25 mm). The contents of glyphosate and AMPA in the red soil aggregates were still high after 30 days, which may affect soil health. Glyphosate degradation was also closely related to phosphorus in the soil. Therefore, the fate of glyphosate under conditions of phosphorus deficiency or abundant soil should be explored to provide detailed information on glyphosate risk assessment in red soil.
Soil aggregates; Glyphosate; Degradation kinetics; Soil phosphorus; Red soil
10.13930/j.cnki.cjea.200686
辛龙川, 吴文雪, 薛萐, 付格娟, 陈延华, 王学霞, 刘东生, 杨晓梅. 红壤不同粒径团聚体对草甘膦农药降解动力学的影响[J]. 中国生态农业学报(中英文), 2021, 29(5): 910-921
XIN L C, WU W X, XUE S, FU G J, CHEN Y H, WANG X X, LIU D S, YANG X M. Effects of aggregate size on kinetics of glyphosate degradation in red soil[J]. Chinese Journal of Eco-Agriculture, 2021, 29(5): 910-921
X53

* 国家自然科学基金项目(41877072)和陕西省自然科学基金项目(2019JQ-639)资助
杨晓梅, 主要研究方向为农田污染物迁移机理与模型模拟、污染物环境风险评估、土壤侵蚀与污染、土壤质量评估与可持续发展。E-mail: xiaomei.yang@nwafu.edu.cn
辛龙川, 主要研究方向为土壤污染物与微生物互馈作用。E-mail: xinlongchuan@163.com
2020-08-21
2021-01-01
* The study was supported by the National Natural Science Foundation of China (41877072) and the Natural Science Foundation of Shaanxi Province (2019JQ-639).
, E-mail: xiaomei.yang@nwafu.edu.cn
Aug. 21, 2020;
Jan. 1, 2021
