ChCl-EG中铜锡合金的电沉积行为及耐蚀性研究
2021-05-08李奇松钱慧璇付旭孙海静孙杰
李奇松,钱慧璇,付旭,孙海静,孙杰
ChCl-EG中铜锡合金的电沉积行为及耐蚀性研究
李奇松,钱慧璇,付旭,孙海静,孙杰
(沈阳理工大学 环境与化学工程学院,沈阳 110159)
研究氯化胆碱-乙二醇低共熔溶剂中进行不同浓度比例下的铜锡合金电沉积的电化学行为及镀层微观形貌、相组成、耐蚀性能。使用阴极极化曲线对铜锡合金还原行为进行研究,使用扫描电子显微镜以及X射线衍射仪等研究电极电位对银镀层微观形貌的影响及银镀层的相组成,同时采用EDS分析铜锡合金镀层的元素组成。使用极化曲线对铜锡合金镀层的耐蚀性能进行研究分析。在−0.95 V电位时,铜锡发生共沉积。在该电位下,铜以合金形式存在,而锡以合金和单质的形式存在。不同金属离子含量的电沉积体系得到不同成分的镀层。镀液中的铜锡含量明确影响镀层中的铜锡含量,当镀液中铜或锡含量偏高时,镀层质量更好。在ChCl-EG低共熔溶剂中,当CuCl2·2H2O与SnCl2·2H2O的含量(mol/L)分别为0.192:0.048、0.192:0.192、0.048:0.192时,得到的镀层的相组成分别为β-Cu5.6Sn、η-Cu6Sn5+β-Cu5.6Sn、η-Cu6Sn5。随着镀液中锡含量不断增多,其相组成由β-Cu5.6Sn相向η-Cu6Sn5相发生转变,并且在沉积层中出现了锡相。镀液中铜或锡含量偏高时,镀层质量反而更好。耐蚀性测试显示镀液中Sn含量为84.2%时,镀层腐蚀速率最小,镀层的耐蚀性最优。
低共熔溶剂;铜锡合金;电沉积;相组成;耐蚀性
铜锡合金因具有良好的焊接性、延展性、耐腐蚀性等性能而被广泛地应用于物品装饰、焊接、形状记忆材料及电池制备等领域[1-5]。目前,因具有成本低、效率较高等优点,使用水溶液电沉积制备铜锡合金镀层得到了广泛的应用[6-7]。然而,水溶液体系中铜锡合金的电沉积存在氢脆、pH改变及废弃物难处理等问题[8]。因此,具有“绿色溶剂”之称的离子液体进入了研究者的视野,并逐渐应用于铜锡电沉积的研究中[9-10]。
关于离子液体中铜锡合金的电沉积研究,Takayuki等人[11]在双三氟甲磺酰钠-双三氟甲磺酰钾体系中,通过退火处理制备出了不同相组成的铜锡合金,并研究了其稳定性。Sun等人[12]在氯化1-丁基-3-甲基咪唑离子液体中,采用电沉积法制备出了相组成为Cu13.7Sn的单相铜锡合金。
在用于电沉积研究的诸多离子液体中,低共熔溶剂(Deep Eutectic Solvents, DESs)因成本较低且所涉及的组分安全、无危害而受到了越来越多的重视[13-17]。DESs通常由两种或三种组分构成,这些组分通过氢键结合形成共熔物,其熔点远低于任一单独组分[18-19]。制备DESs的原料很容易获得,可以在常温下制备,并且制取过程不需要复杂的化学反应[20]。作为溶剂,DESs具有生物降解性、无毒性、环保等诸多优点[21-22]。关于其电沉积应用方面,研究者们在不同的DESs体系中分别进行了镍[23]、锌[24]、锡[25]等金属的电沉积研究。
本文以氯化胆碱-乙二醇(choline chloride-ethylene glycol,ChCl-EG)低共熔溶剂为基础液,进行了铜锡合金的电沉积。阴极极化曲线有助于深入理解铜锡合金在该体系中的金属离子还原过程,因此本文在不同镀液成分下进行阴极极化测试,并深入讨论镀液成分对金属还原的影响,通过改变溶液中铜锡离子含量的比例,对其电沉积得到的镀层的微观形貌、相组成、耐蚀性进行进一步研究。
1 实验
以ChCl-EG为基础液,加入不同摩尔浓度比(0.192:0.192、0.048:0.192、0.192:0.048)的CuCl2·2H2O及SnCl2·2H2O。使用CS350电化学工作站对电解液进行阴极极化测试,对不同摩尔比体系的铜锡合金电沉积电化学行为进行研究。阴极极化测试及电沉积过程均采用三电极体系,银电极为参比电极,铂电极为对电极,黄铜片为工作电极。对工作电极使用不同型号的砂纸打磨至镜面光滑。测试前,使用丙酮、无水乙醇和去离子水充分清洁所有电极。使用D/max-RB X射线衍射仪进行电沉积镀层的物相测试分析。使用Tafel曲线测试方法对电镀层的耐蚀性进行分析。耐蚀性测试以3.5%NaCl水溶液作为介质,在室温下进行,试样测试面积为1 cm2。测试前,将试样浸入腐蚀介质中静置30 min。
使用VEGA3扫描电子显微镜(scanning electron microscopy,SEM)对金属沉积层的微观形貌进行分析。使用D/max-RB X射线衍射仪(X-ray diffractometer,XRD)对沉积层的相组成进行研究分析。
2 结果与讨论
2.1 铜锡离子在DESs中的电化学还原行为
图1为DESs中分别含有铜离子、锡离子以及铜锡离子共存时的阴极极化曲线。曲线a是镀液体系为ChCl-EG-0.192 mol/L CuCl2·2H2O的阴极极化曲线。从图中可以观察到,曲线上分别在0 V和−1.2 V处存在a1和a2两个还原峰,说明Cu2+在ChCl-EG低共熔溶剂中为两步还原,分别对应于Cu2+/Cu+和Cu+/Cu0的还原过程。Ali等人[3]在ChCl-EG中也进行了Cu2+的电化学行为研究,证明了Cu2+为两步还原。曲线b是镀液体系为ChCl-EG-0.192 mol/L SnCl2·2H2O时所测得的阴极极化曲线。可以观察到,在−0.85 V处存在一个还原峰b1,因此确定Sn2+在ChCl-EG低共熔溶剂中为一步还原,反应式为:Sn2++2e→Sn[5]。曲线c是镀液体系为ChCl-EG-0.192 mol/L CuCl2-0.192 mol/L SnCl2的阴极极化曲线。可以看到,存在c1和c2两个还原峰。c1对应Cu2+/Cu+。c1的峰位置较a1略有偏移,这说明Sn2+的存在影响了Cu2+/Cu+的还原。当两种离子都存在于溶液中时,沉积过程始于0.65 V,比Cu2+沉积电位要更正一些。这是在Cu-Sn电沉积过程中,Sn2+诱导去极化效应导致的结果[2]。这与Bengoa等人在甲磺酸溶液中的研究结果一致[1]。c2对应的还原峰位置介于a2和b1之间,这说明c2这一还原峰可能为铜和锡发生共沉积所致,即c2为铜锡合金的还原峰。

图1 不同镀液的阴极极化曲线
2.2 SEM分析
从图2可以看到,在−0.75 V电位条件下,不同配比的ChCl-EG-CuCl2-SnCl2下所得的镀层微观形貌差异较大。当镀液成分为ChCl-EG-0.192 mol/L CuCl2·2H2O-0.048 mol/L SnCl2·2H2O时,晶体结构排列紧凑,镀层十分致密。在ChCl-EG-0.192 mol/L CuCl2·2H2O-0.192 mol/L SnCl2·2H2O镀液中进行电沉积得到的镀层,表面主要由白色羽毛状物质、白色小颗粒物质和黑色部分组成,并且分布不均匀。在ChCl- EG-0.048 mol/L CuCl2·2H2O-0.192 mol/L SnCl2·2H2O镀液中电沉积得到的镀层,表面可以看到大量的柏树叶状物质,不存在之前的白色小颗粒和黑色部分。再结合EDS结果进行分析发现,镀液中的铜锡含量影响镀层中的铜锡含量,当镀液中铜或锡含量偏高时,镀层质量反而更好。

图2 不同配比的ChCl-EG-CuCl2-SnCl2下所得的镀层形貌及EDS能谱
2.3 镀层的相组成分析
图3及表1分别为在不同镀液成分下所得镀层的XRD衍射图及相组成。在镀液成分为ChCl-EG-0.192 mol/L CuCl2·2H2O-0.048 mol/L SnCl2·2H2O(a)时,镀液中锡含量为1.03%,镀层中主要成分为β-Cu5.6Sn合金相。镀液成分为ChCl-EG-0.192 mol/L CuCl2·2H2O- 0.192 mol/L SnCl2·2H2O时(b),镀液中锡含量为57.2%,此时镀层主要成分为η-Cu6Sn5和β-Cu5.6Sn合金相,此结果和其他作者所报道的相符[1]。当镀液成分改变为ChCl-EG-0.048 mol/L CuCl2·2H2O- 0.192 mol/L SnCl2·2H2O(c)时,即镀液中锡含量为84.2%,随着镀液中锡含量的增加,镀层中合金的主要成分发生了变化,变为η-Cu6Sn5合金相,并且由于镀液中锡离子浓度过高,出现了单独的锡相。表明随着锡含量的增加,其相组成由β-Cu5.6Sn相向η-Cu6Sn5发生转变。
表1 不同条件下得到的镀层的相组成

Tab.1 Phase composition of the coating obtained under different conditions

图3 不同配比的ChCl-EG-CuCl2-SnCl2下所得镀层的XRD图谱
实验结果表明,Sn2+浓度的提高有助于合金的电沉积,而锡离子浓度过高时会导致大量的金属锡被还原,这与电化学分析结果十分吻合。当铜离子浓度过高时,只存在合金相。结合图1可知,在峰c2处,该电位下,Cu2+以合金相进行沉积,没有Cu单质的存在。而Sn以锡单质及合金相的形式存在,所以在该峰处只存在锡及铜锡合金。
2.4 金属盐浓度对阴极极化的影响
图4为不同摩尔比的铜锡离子在DESs中的阴极极化曲线。可以观察到,随着溶液中锡含量的增加,0.45 V处(峰a)的电流密度明显减小,并且峰值向右偏移,这与图1现象一致,进一步证实了该处为Cu2+/Cu+的还原。而在Cu2+浓度为0.192 mol/L时,在0.45 V电位下,电流密度和电位几乎不发生变化,说明Sn2+大量存在才会影响Cu2+的还原过程。
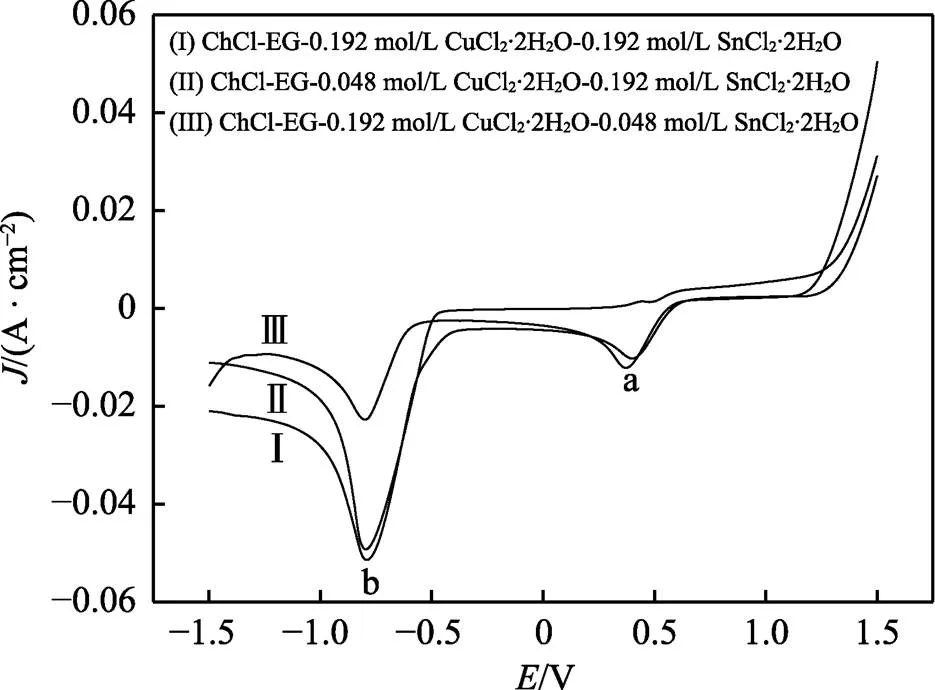
图4 不同配比的ChCl-EG-CuCl2-SnCl2低共熔溶剂阴极极化曲线
从图4中还可以观察到,随着镀液中锡含量的减少,峰b的电流效率明显减小,并且该峰起始沉积电位发生了偏移。这也是由于Sn2+诱导去极化效应所导致[2]。此现象说明在该电位下,镀液中Sn2+含量的减少会影响合金的沉积。而随着镀液中Sn2+含量的增加,该峰的电流密度相近。说明此区间随着铜浓度的减少(镀液中锡含量占比增加),峰值几乎未发生改变。结合图3c说明,由于此处存在大量的Sn2+,出现了锡单质的沉积,即该还原峰为锡单质及铜锡合金的共沉积电位。而Cu2+的浓度减小,对其沉积没有十分明显的影响。镀液中Sn2+含量的提高,有助于合金的沉积。根据以上结果可以确认,适当提高镀液体系中的Sn2+浓度,有助于铜锡合金的共沉积,但过量的Sn2+存在,会导致大量锡金属的还原。
2.5 Sn2+对Cu2+还原行为的影响
图5为ChCl-EG-0.1 mol/L CuCl2·2H2O镀液中加入不同浓度锡离子的阴极极化曲线。从曲线中可以明显观察到两个还原峰a和b。还原峰a为Cu2+/Cu+的还原,还原峰b为锡及铜锡合金共沉积。从还原峰可以看出,随着锡离子浓度增加,峰值电流减小。这可能是由于游离锡离子在电极上产生的吸附作用,抑制了铜离子的还原,导致铜离子还原过电位增大,使峰值电位正移[26]。与还原峰a相反,峰b的峰值电流随锡离子浓度的增加反而增大。在该峰值电位下,由于大量的Sn2+存在,导致了锡金属的还原,使得峰值电流增加。在此处发生的铜锡共沉积涉及锡的欠电位沉积。这个结果导致锡与铜弱结合,从而产生抑制作用,导致峰值电位正移[26]。

图5 不同浓度锡离子在ChCl-EG-0.1 mol/L CuCl2·2H2O低共熔溶剂中的阴极极化曲线
2.6 镀层的耐蚀性分析
为了研究Cu-Sn合金的耐蚀性能,对不同配比的ChCl-EG-CuCl2·2H2O-SnCl2·2H2O溶液中所获得的金属镀层进行了Tafel极化曲线测试,结果如图6所示。金属在同一腐蚀介质中的腐蚀电流越小,即腐蚀速率越低,则耐腐蚀效果越好。表2的数据表明,当镀液成分为ChCl-EG-0.048 mol/L CuCl2·2H2O-0.192 mol/L SnCl2·2H2O(即此时镀液中锡含量为84.2%)时,铜锡合金镀层腐蚀电流密度最小,为1.02×10−5A/cm2。

图6 不同金属成分比例镀层的Tafel极化曲线
表2 极化曲线数据

Tab.2 Data of the polarization curves
3 结论
在ChCl-EG低共熔溶剂中可以进行铜锡合金镀层的电沉积制备。电解液中锡离子的存在会影响Cu2+的还原,导致其还原电流密度明显减小。在铜锡发生共沉积时,铜不以合金形式存在,而锡以合金和单质的形式存在。镀液中Sn2+含量的提高,有助于合金的沉积。在不同摩尔比铜锡离子镀液中所得到的铜锡合金相组成不同,随着锡含量不断增多,其相组成由β-Cu5.6Sn向η-Cu6Sn5发生转变。当镀液成分为ChCl- EG-0.048 mol/L CuCl2·2H2O-0.192 mol/L SnCl2·2H2O时,得到的铜锡镀层的耐蚀性最优。
[1] 蔡险峰, 林直荣. 全光亮氰化铜锡合金在仿金电镀工艺中的应用[J]. 电镀与精饰, 1992(1): 34-35. CAI Xian-feng, LIN Zhi-rong. Application of fully bright copper tin cyanide alloy in gold imitation electroplating process[J]. Electroplating and finishing, 1992(1): 34-35.
[2] 钟云, 何永福, 贺飞, 等. 电镀铜锡合金工艺研究进展[J]. 电镀与环保, 2007, 27(4): 1-3.ZHONG Yun, HE Yong-fu, HE Fei, et al. Research progressof copper-tin alloy electroplating process[J]. Electroplating and environmental protection, 2007, 27(4): 1-3.
[3] 袁国伟, 谢素玲. 铜锡合金代镍电镀工艺的研究进展[J]. 电镀与环保, 2002(4): 3-6. YUAN Guo-wei, XIE Su-ling. Research progress of copper-tin alloy nickel plating process[J]. Electroplating and environmental protection, 2002(4): 3-6.
[4] 郑丽, 罗松, 李祉豪, 等. 新型铜锡合金电镀添加剂的制备[J]. 表面技术, 2018, 47(9): 214-218. ZHENG Li, LUO Song, LI Zhi-hao, et al. Preparation of new additives for copper-tin alloy electroplating[J]. Surface technology, 2018, 47(9): 214-218.
[5] BENGOA L N, PARY P, CONCONI M S, et al. Electrodeposition of Cu-Sn alloys from a methanesulfonic acid electrolyte containing benzyl alcohol[J]. Electrochimica acta, 2017, 256: 211-219.
[6] 左正忠, 何细华. 无氰溶液中电沉积铜锡合金电化学行为的研究[J]. 武汉大学学报(自然科学版), 1996, 42(2): 141-166. ZUO Zheng-zhong, HE Xi-hua. Study on electrochemical behavior of electrodeposition of copper-tin alloy in cyanide-free solution[J]. Journal of the Wuhan University (natural science edition), 1996, 42(2): 141-166.
[7] 郭艳, 曾振欧, 赵洋, 等. 焦磷酸盐溶液体系电沉积白铜锡的电化学行为[J]. 电镀与涂饰, 2014(8): 317-320. GUO Yan, ZENG Zhen-ou, ZHAO Yang, et al. Electrochemical behavior of electrodeposition of copper-tin in pyrophosphate solution system[J]. Electroplating and finishing, 2014(8): 317-320.
[8] SUN Jie, MING Ting-yun, QIAN Hui-xuan, et al. Electrochemical behaviors and electrodeposition of single-phase Cu-Sn alloy coating in [BMIM]Cl[J]. Electrochimica acta, 2019, 297: 87-93.
[9] 詹中伟, 孙志华, 汤智慧, 等. 离子镀铝与离子液体电镀铝涂层性能对比研究[J]. 装备环境工程, 2017, 14(5): 74-81. ZHAN Zhong-wei, SUN Zhi-hua, TANG Zhi-hui, et al. Study on the performance of ionic aluminum plating and ionic liquid coating[J]. Equipment environment engineering, 2017, 14(5): 74-81.
[10] 孙杰, 明庭云, 钱慧璇, 等. BMIMPF6离子液体中铜沉积的电化学行为[J]. 高等学校化学学报, 2018, 39(7): 1497-1502. SUN Jie, MING Ting-yun, QIAN Hui-xuan, et al. Electrochemical behavior of copper electrodeposition in BMIMPF6ionic liquid[J]. Chemical Journal of Chinese Universities, 2018, 39(7): 1497-1502.
[11] YAMAMOTO T, NOHIRA T, HAGIWARA R, et al. Improved cyclability of Sn-Cu film electrode for sodium secondary battery using inorganic ionic liquid electrolyte [J]. Electrochimica acta, 2014, 135: 6067.
[12] SUN Jie, MING Ting-yun, QIAN Hui-xuan, et al. Preparation of black Cu-Sn alloy with single phase composition by electrodeposition method in 1-butyl-3-methylimidazolium chloride ionic liquids[J]. Materials chemistry and physics, 2018, 219: 421-424.
[13] WEI Zuo-fu, QI Xiao-lin, LI Ting-ting. Application of natural deep eutectic solvents for extraction and determination of phenolics in cajanus cajan leaves by ultra performance liquid chromatography[J]. Separation and purification technology, 2015, 149: 237-244.
[14] 侯玉翠, 王震, 任树行, 等. 低共熔溶剂在混合物分离中的应用[J]. 科学通报, 2015(26): 40-49. HOU Yu-cui, WANG Zhen, REN Shu-xing, et al. Application of low eutectic solvent in mixture separation[J]. Chinese science bulletin, 2015(26): 40-49.
[15] LIANA Anicai, AURORA Petica, STEFANIA Costovici. Electrodeposition of Sn and NiSn alloys coatings using choline chloride based ionic liquids—Evaluation of corrosion behavior[J]. Electrochimica acta, 2013, 114: 868-877.
[16] SIM L N, YAHYA R, AROF A K. Infrared studies of polyacrylonitrile-based polymer electrolytes incorporated with lithium bis(trifluoromethane)sulfonimide and urea as deep eutectic solvent[J]. Optical materials, 2016, 56: 140- 144.
[17] 谭婷, 乔鑫, 万益群, 等. 低共熔溶剂新型亲水作用色谱流动相改性剂[J]. 色谱, 2015(9): 934-937. TAN Ting, QIAO Xin, WAN Yi-qun, et al. A novel hydrophilic chromatographic mobile phase modifier with low eutectic solvent[J]. The chromatographic, 2015(9): 934-937.
[18] 胡丽华, 陈砺, 方泳华, 等. 低共熔溶剂的分子结构及物性估算的研究进展[J]. 化学试剂, 2017, 39(9): 937-941. HU Li-hua, CHEN li, WAN Yong-hua, et al. Advances in molecular structure and physical property estimation of low eutectic solvents[J]. Chemical reagent, 2017, 39(9): 937-941.
[19] 白芳, 华超, 李静, 等. 低共熔溶剂在萃取/萃取蒸馏分离中的研究进展[J]. 现代化工, 2017, 37(2): 20-24. BAI Fang, HUA Chao, LI Jing, et al. Research progress of low eutectic solvent in extraction/extractive distillation[J]. The modern chemical industry, 2017, 37(2): 20-24.
[20] WU Ben-pei, WEN Qing, XU Hong, et al. Insights into the impact of deep eutectic solvents on horseradish peroxidase: Activity, stability and structure[J]. Journal of molecular catalysis B: Enzymatic, 2014, 101: 101-107.
[21] DAI Y T, WITKAMP G J, VERPOORTE R, et al. Natural deep eutectic solvents as a new extraction media for phenolic metabolites in Carthamus tinctorius L[J]. Anal chem, 2013, 85(13): 6272-6278.
[22] SWATILEKHA Ghosh, SUDIPTA Roy. Characterization of tin films synthesized from ethaline deep eutectic solvent[J]. Materials science and engineering B, 2014, 190: 104-110.
[23] 谭勇, 张久凌, 孙杰. ChCl-EG低共熔溶剂体系中镍沉积的电化学行为研究[J]. 表面技术, 2018, 47(11): 245- 249. TAN Yong, ZHANG Jiu-ling, SUN Jie. Electrochemical behavior of nickel deposition in ChCl-EG eutectic solvent system[J]. Surface technology, 2018, 47(11): 245-249.
[24] PEREIRA N M, PEREIRA C M, ARAÚJO J P, et al. Zinc electrodeposition from deep eutectic solvent containing organic additives[J]. Journal of electroanalytical chemistry, 2017, 801: 545-551.
[25] NAOKI Tachikawa, NOBUYUKI Serizawa, YASUSHI Katayama, et al. Electrochemistry of Sn(II)/Sn in a hydrophobic room-temperature ionic liquid[J]. Electrochimica acta, 2008, 53: 6530-6534.
[26] SURVILA A, MOCKUS Z, KANAPECKAITE S. Codeposition of copper and tin from acid sulphate solutions containing polyether sintanol DS-10 and micromolar amounts of halides[J]. Electrochimica acta, 2007, 52: 3067-3074.
Electrodeposition Behaviors and Corrosion Resistance of Copper-Tin Alloy Coating in ChCl-EG Deep Eutectic Solvents
,,,,
(School of Environmental and Chemical Engineering, Shenyang Ligong University, Shenyang 110159, China)
The work aims to study the electrochemical behavior, microstructure, phase composition and corrosion resistance of electrodeposited Cu-Sn alloy with different concentration ratio in low eutectic solvent. The cathodic polarization curve was used to study the reduction behavior of copper-tin alloy, the influence of electrode potential on the microstructure of silver coating and the phase composition of silver coating were studied by means of scanning electron microscope (SEM) and X-ray diffraction (XRD), and EDS was used to analyze the element composition of copper-tin alloy coating. The corrosion resistance of Cu-Sn alloy coating was studied by polarization curve. Cu-Sn co-deposition occurs at −0.95 V potential. At this potential, copper exists in alloy form, while tin exists in alloy and elemental form. Electrodeposition system with different metal ion content can obtain different coatings. The content of copper and tin in the plating bath definitely affects the content of copper and tin in the plating bath. In the ChCl-EG deep eutectic solvents, when the content (mol/L) of CuCl2·2H2O and SnCl2·2H2O was 0.192:0.048, 0.192:0.192 and 0.048:0.192, respectively, the phase composition of the obtained coating was β-Cu5.6Sn phase, η-Cu6Sn5phase and β-Cu5.6Sn phase, and η-Cu6Sn5phase. As the tin content in the plating solution increased, the phase composition changed from β-Cu5.6Sn phase to η-Cu6Sn5phase, and the tin phase appeared in the coating. When the copper or tin content in the bath is on the high side, the coating quality is better. The corrosion resistance test showed that the corrosion rate was the lowest when the content of Sn ions in the plating solution was 84.2%, and the corrosion resistance of the coating was optimal under this condition.
deep eutectic solvents; copper-tin alloy; electrodeposition; phase composition; corrosion resistance
2020-04-01;
2021-03-03
LI Qi-song (1996—), Female, Master, Research focus: corrosion science and protection techniques.
孙杰(1971—),男,博士,教授,主要研究方向为金属的腐蚀行为与先进防护。邮箱:jiersun2000@126.com
Corresponding author:SUN Jie (1971—), Male, Ph. D., Professor, Research focus: behaviors of metal corrosion and advanced surface engineering. E-mail: jiersun2000@126.com
李奇松, 钱慧璇, 付旭, 等. ChCl-EG中铜锡合金的电沉积行为及耐蚀性研究[J]. 表面技术, 2021, 50(4): 313-318.
TQ153
A
1001-3660(2021)04-0313-06
10.16490/j.cnki.issn.1001-3660.2021.04.032
2020-04-01;
2021-03-03
辽宁省-沈阳材料科学国家研究中心联合研发基金资助(2019JH3/30100021)
Fund:Supported by Liaoning Province-Shenyang National Laboratory for Materials Science Joint Research Fund (2019JH3/30100021)
李奇松(1996—),女,硕士,主要研究方向为腐蚀科学与防护技术。
LI Qi-song, QIAN Hui-xuan, FU Xu, et al. Electrodeposition behaviors and corrosion resistance of copper-tin alloy coating in ChCl-EG deep eutectic solvents[J]. Surface technology, 2021, 50(4): 313-318.
