外源2,4-表油菜素内酯对镉胁迫下草地早熟禾叶绿素代谢的影响
2021-05-07朱瑞婷牛奎举张娣君马晖玲
朱瑞婷, 牛奎举, 张娣君, 杨 阳, 宋 云, 马晖玲
(甘肃农业大学草业学院, 草业生态系统教育部重点实验室, 甘肃省草业工程实验室, 中-美草地畜牧业可持续发展研究中心, 甘肃 兰州 730070)
镉(Cadmium,Cd)污染是最为普遍的重金属污染,对植物、动物和人类健康具有潜在的危害[1]。植物修复技术可用于去除土壤中的重金属,该技术成本低廉、环境友好,是土壤重金属修复研究中的热点问题,应用前景广泛[2-4]。目前已发现多种Cd超积累植物,如天蓝遏蓝菜(Thlaspicaerulescens)、东南景天(Sedumalfredii)和龙葵(Solanumnigrum)等[5-6],但已发现的超富集植物多为一年生植物,且生物量小,不适于我国北方寒旱地区种植[7]。相对而言,草坪草具有气候环境适应性强,根系致密,多年生,耐地修剪等优点,可以迅速地覆盖地表,防止重金属通过水或风的侵蚀迁移到别处,这些优点使草坪草比其他超富集植物在修复镉污染土壤上具有显著的优越性[7-8]。已有研究表明,草地早熟禾(Poapratensis)、高羊茅(Festucaelata)和多年生黑麦草(Loliumperenne)等冷季型草坪草对Cd具有较强的耐受和富集能力,在80 mg·kg-1Cd处理下,草地早熟禾对土壤Cd的萃取率高达4.64%,而超富集植物龙葵只有0.43%[9-10]。因此,研究Cd胁迫下草坪草生长发育的调控对利用其修复Cd污染土壤具有重要意义。
油菜素甾醇(Brassinosteroids,BRs)是植物体中发现的一类甾醇类植物激素,在植物的正常生长发育和对生物、非生物胁迫适应过程中起着重要作用[11]。2,4-表油菜素内酯(2,4-Epibrassinolide,EBR)是作为外源物质在植物上应用最多的BRs化合物之一[12]。研究表明,外源EBR对植物低温[13]、高温[14]、干旱[15]、盐[16]和重金属[17]胁迫损伤均具有一定的缓解效应。外源EBR可促进逆境胁迫下植物的生长发育,增加叶绿素含量、提高光合能力和增强抗氧化能力[12-15]。叶绿素代谢和植物的光合作用联系密切,但关于外源EBR调控Cd胁迫下叶片的叶绿素合成和降解代谢的研究鲜有报道。
草地早熟禾具有较强的耐Cd性,Cd胁迫可降低草地早熟禾叶绿素含量[8],但Cd胁迫对草地早熟禾叶绿素合成和降解代谢的影响尚不清楚。因此,本试验以草地早熟禾‘午夜’为研究材料,对Cd胁迫和不同浓度EBR处理下的植株叶绿素合成中间产物和叶绿素含量以及叶绿素合成和降解通路相关基因的相对表达水平进行了测定,旨在揭示Cd胁迫下草地早熟禾叶绿素代谢的响应及外源EBR对Cd胁迫下植物叶绿素代谢的调控作用。
1 材料与方法
1.1 试验材料
供试材料为草地早熟禾‘午夜’品种,来自北京克劳沃公司。
1.2 试验处理
将种子播种在直径为9 cm、高度为17 cm的育苗钵中,每组10盆。育苗钵中为营养土、蛭石和沙子,其比例为2∶1∶1,在生长室中培养。生长条件为:白天温度为25℃,时间为16 h,光照强度为6 000 lux,夜晚温度为20℃,时间为8 h,湿度为50%。待幼苗长45 d左右后,选择长势一致的幼苗移栽到水培盒中。移栽7 d后的草地早熟禾植株进行不同浓度的EBR喷施处理和Cd胁迫处理,处理共有5组:(1)CK,Hoagland营养液培养;(2)Cd,含0.5 mM CdCl2·1/2 H20的Hoagland营养液培养(0.114 g CdCl2·1/2 H20溶于1 L Hoagland营养液中);(3)Cd+5 nM EBR,含0.5 mM CdCl2·1/2 H20的Hoagland营养液培养和5 nM的2,4-油菜素内酯预处理;(4)Cd+50 nM EBR,含0.5 mM CdCl2·1/2 H20的Hoagland营养液培养和50 nM的2,4-油菜素内酯预处理;(5)Cd+100 nM EBR,含0.5 mM CdCl2·1/2 H20的Hoagland营养液培养和100 nM的2,4-油菜素内酯预处理。EBR预处理是指在Cd胁迫开始的前3 d对草地早熟禾叶片喷施不同浓度EBR的处理,CK和Cd处理组喷施相同体积的蒸馏水。Cd胁迫处理后1 d,3 d,6 d时采集各处理组草地早熟禾叶片,每处理组4次重复。
1.3 光合色素及叶绿素合成前体物质含量的测定
叶绿素a、叶绿素b和叶绿素总含量用乙醇-丙酮浸提法测定[18-19],称取0.2 g新鲜叶片,将其浸入10 mL提取液中,提取液为乙醇和丙酮溶液(体积比为1∶1),黑暗静置24 h后摇匀,在波长645 nm,652 nm和663 nm下测定吸光值A,并计算出其物质含量。
采用Hodgins和Van Huystee (1986) 的方法[20]测定原卟啉Ⅳ(ProtoⅣ)、镁-原卟啉Ⅳ(Mg-ProtoⅣ)和原叶绿素酸酯(Pchl)的含量。称0.2 g新鲜叶片,分3次加入10 mL的提取液,提取液为丙酮和1%的氨水溶液(体积比为4∶1),冰浴充分研磨后在4℃,12 000 r·min-1下离心18 min,离心结束后吸取上清液分别在不同的波长(575 nm,590 nm和628 nm)下测定吸光值A,并计算其物质含量。
1.4 叶绿素代谢途径相关基因的表达
叶片RNA提取使用天根公司植物RNA提取试剂盒,RNA反转录使用Prime Script RT reagent Kit with gDNA Eraser(Perfect real time)试剂盒,第一步为去除基因组DNA反应,第二步为反转录合成cDNA,稀释20倍作为模板。根据水稻(oryzasativaL.)叶绿体合成酶相关基因的登录号,将本实验室已有和报道的草地早熟禾转录组数据库作为本地数据库[21-22],查找与叶绿素合成酶相关的基因系列,使用NCBI在线网站Prime-BLAST (https://www.ncbi.nlm.nih.gov/tools/primer-blast/)进行引物设计,设计的引物由兰州天启基因生物科技有限公司合成(表1)。表中基因为胆色素原脱氨酶(PpPBGD)、原叶绿素酸酯氧化还原酶(PpPOX)、叶绿素酶(PpCLH)、脱镁叶绿酸a氧化酶(PpPAO)、5-氨基酮戊酸脱水酶(PpALAD)、红色叶绿素分解代谢物还原酶(PpRCCR)、脱镁叶绿素酶(PpPPH)、谷氨酰tRNA合成酶(PpGTS)、Mg-螯合酶D亚基(PpCHLD)、Mg-螯合酶Ⅰ亚基(PpCHLI)。利用试剂盒进行qRT-PCR分析,荧光定量试剂盒来自北京擎科新兴生物技术有限公司。20 μL反应体系如下:模板5 μL,引物1.6 μL,ddH2O 3.4 μL,2×TSINGKE Master Qpcr Mix 10 μL。荧光定量PCR的反应程序为:95℃预变性1 min,50个循环的PCR扩增,包括95℃变性10 s和60℃退火30 s,60℃时采集荧光信号。内参基因为PpACT,每个样品设3次技术重复,基因的相对表达量使用2-ΔΔCT法计算[23]。
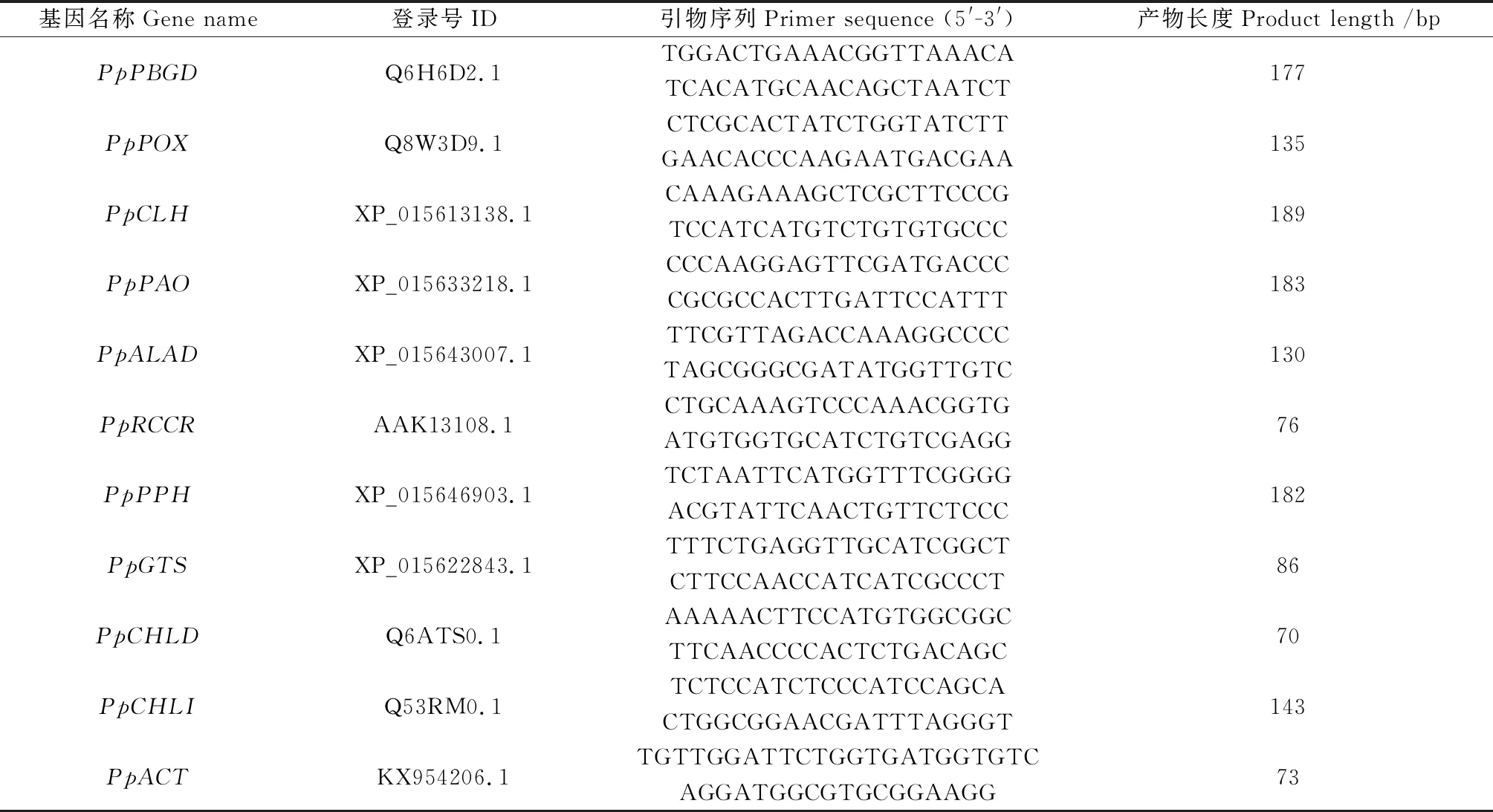
表1 叶绿素合成相关基因的引物系列
1.5 数据分析
使用Excel 2019统计和整理试验数据,利用SPSS 19.0软件对数据进行单因素方差分析,假定方差齐性选择LSD和Duncan,显著性水平为0.05,并用GraphPad Prism 8软件绘图。
2 结果与分析
2.1 外源EBR对Cd胁迫下草地早熟禾叶绿素含量的影响
由图1可知,Cd处理的草地早熟禾叶片的叶绿素a含量在1 d和6 d时显著低于对照(CK)(P<0.05),叶绿素b含量在1 d和6 d时高于CK,但差异不显著。在Cd胁迫处理的第3 d,草地早熟禾叶片的叶绿素a、叶绿素b和总叶绿素含量与CK无显著性差异。在胁迫处理的第6 d,Cd处理的草地早熟禾叶片的叶绿素a和总叶绿素含量较CK分别下降了54.80%和33.23%,叶绿素b较CK增加了14.51%。5 nM和50 nM EBR处理的草地早熟禾叶片的叶绿素a、叶绿素b和总叶绿素含量在Cd胁迫期间(1~6 d)与CK无显著性差异。在Cd胁迫6 d时,100 nM EBR处理的草地早熟禾叶片的叶绿素a和总叶绿素含量显著低于CK(P<0.05),但其含量仍高于Cd处理,说明外源EBR可缓解Cd胁迫导致的草地早熟禾叶片的叶绿素a和总叶绿素含量的降低。

图1 外源EBR对镉胁迫下草地早熟禾叶片的叶绿素a(A)、叶绿素b(B)和总叶绿素含量(C)的影响
2.2 外源EBR对Cd胁迫下草地早熟禾叶绿素合成前体物质含量的影响
如图2所示,Cd处理的草地早熟禾叶片的原卟啉Ⅳ、镁-原卟啉Ⅳ和原叶绿素酸酯含量均显著低于CK(P<0.05)。在Cd胁迫1 d时,草地早熟禾叶片的原卟啉Ⅳ和镁-原卟啉Ⅳ含量的下降幅度最大,分别较CK下降了37.99%和34.36%;在Cd胁迫3 d时,草地早熟禾叶片的原叶绿素酸酯含量的下降幅度最大,较CK下降了34.57%;Cd处理的草地早熟禾叶片的镁-原卟啉Ⅳ和原叶绿素酸酯含量在6 d时下降幅度最小。
外源添加5 ~100 nM EBR可减缓Cd胁迫下草地早熟禾叶片的原卟啉Ⅳ、镁-原卟啉Ⅳ和原叶绿素酸酯含量的下降幅度(图2)。50 nM EBR处理的草地早熟禾叶片的原卟啉Ⅳ含量在胁迫期间(1~6 d)均显著高于Cd处理(P<0.05),胁迫处理6 d与CK无显著性差异。在Cd胁迫3 d时,5 ~100 nM EBR处理的草地早熟禾叶片的镁-原卟啉Ⅳ和原叶绿素酸酯含量显著高于Cd处理(P<0.05),50 nM EBR处理下与CK无显著性差异,说明外源EBR可缓解Cd胁迫导致的草地早熟禾叶片的叶绿素合成前体物质含量的降低。
2.3 外源EBR对Cd胁迫下草地早熟禾叶绿素合成通路基因表达的影响
PpGTS,PpALAD,PpPBGD,PpCHLD,PpCHLI和PpPOR基因编码从谷氨酸到叶绿素a合成生物合成通路的关键酶,由图3可知,Cd处理1 d后可下调PpPBGD,PpCHLD,PpCHLI和PpPOR基因的表达(P<0.05),而PpGTS和PpALAD基因表达水平无明显变化。在Cd处理3 d时,PpGTS,PpALAD,PpPBGD和PpCHLD基因表达水平与CK相比无显著性差异;而在第6 d,Cd处理可诱导PpGTS,PpALAD,PpPBGD和PpPOR基因的上调表达(P<0.05)。该结果说明草地早熟禾叶绿素合成通路基因在短期Cd胁迫下被下调表达,而长期的Cd胁迫可在转录水平上诱导叶绿素合成通路基因的上调表达。
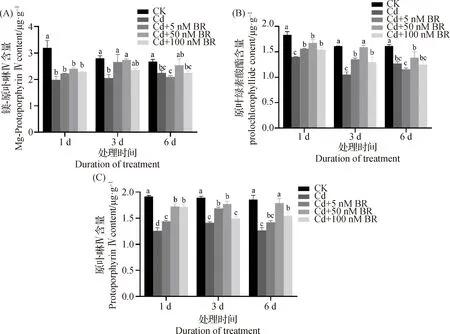
图2 外源EBR对镉胁迫下草地早熟禾叶片的镁-原卟啉Ⅳ(A)、原叶绿素酸酯(B)和原卟啉Ⅳ含量(C)的影响
外源EBR处理可诱导Cd胁迫下草地早熟禾叶绿素合成通路基因的上调表达(图3)。50 nM EBR处理在Cd胁迫1 d可诱导PpGTS,PpALAD,PpPBGD和PpPOR基因的上调表达(P<0.05)。Cd胁迫3 d时,100 nM EBR处理可诱导PpGTS,PpALAD和PpCHLD基因的上调表达(P<0.05),而50 nM EBR处理可诱导PpCHLI和PpPOR基因的上调表达(P<0.05)。Cd胁迫6 d时,5 ~100 nM EBR处理的草地早熟禾PpGTS,PpALAD,PpCHLD和PpCHLI基因表达水平与Cd处理无显著性差异,而PpPBGD和PpPOR基因被诱导上调表达(P<0.05),其中5,50和100 nM EBR处理的PpPOR基因相对表达量分别是Cd处理9.3,4.7和9.4倍,这说明外源EBR可在转录水平上促进Cd胁迫下草地早熟禾叶绿素生物合成通路。
2.4 外源EBR对Cd胁迫下草地早熟禾叶绿素降解通路基因表达的影响
PpCLH,PpPPH,PpPAO和PpRCCR是叶绿素降解通路的关键基因。如图4所示,Cd处理1 d后,PpCLH和PpPPH基因表达水平无明显变化,PpPAO和PpRCCR基因被诱导上调表达(P<0.05),而Cd处理6 d后,PpCLH,PpPPH,PpPAO和PpRCCR基因均被诱导上调表达(P<0.05),其表达水平分别是CK的18.5,12.4,63.5和14.1倍。在Cd胁迫3 d和6 d,外源添加50~100 nM EBR的草地早熟禾PpCLH,PpPPH和PpPAO基因的表达量低于Cd处理(P<0.05),50 nM EBR处理的PpRCCR基因表达水平在第1 d和6 d均低于Cd处理(P<0.05)。这说明Cd胁迫可在转录水平上诱导叶绿素降解,而外源的EBR添加可在一定程度上抑制Cd胁迫引起的叶绿素降解。

图3 外源EBR对镉胁迫下草地早熟禾叶绿素合成通路基因表达的影响

图4 外源EBR对镉胁迫下草地早熟禾叶绿素降解通路基因表达的影响
3 讨论
3.1 草地早熟禾叶绿素代谢对Cd胁迫的响应
在高等植物中,光合色素主要包括叶绿素(叶绿素a、叶绿素 b)和类胡萝卜素,干旱、高温和重金属等非生物胁迫常导致植物光合色素含量的下降和内囊体膜结构的损伤,进而使得光合能力下降[24-26]。本研究结果表明,Cd胁迫可显著地降低草地早熟禾叶片的叶绿素a和总叶绿素含量。叶绿素的含量的降低可能是由于叶绿素中间产物的转化过程受到了阻碍叶绿素的生物合成,进而导致叶绿素含量降低[27-29],也有可能是由于叶绿素的降解所导致的[30]。Cd胁迫下植物叶绿素含量降低的原因尚不清楚,因此,本研究对Cd胁迫下草地早熟禾叶片的叶绿素合成和降解途径都进行了研究。
高等植物叶绿素的生物合成通路主要是:甘氨酸→5-氨基乙酰丙酸→胆色素原→尿卟啉原III→原卟啉Ⅳ→镁-原卟啉Ⅳ→原叶绿素酸酯→叶绿素a[31-32],该过程是由一系列关键酶的催化反应完成的,编码这些酶基因表达的下调可导致酶活性的降低,进而使得该过程的催化反应受阻,降低受阻位点之后的中间产物[33]。前人研究结果表明,高温、干旱和盐碱等逆境胁迫可导致植物叶绿素合成途径受阻[27-29]。本研究对编码叶绿素生物合成通路的关键酶基因进行了分析,发现Cd胁迫初期草地早熟禾PpGTS和PpALAD基因表达水平无明显变化,但PpPBGD,PpCHLD,PpCHLI和PpPOR均被诱导下调表达,其中PpPBGD基因编码酶催化从胆色素原到尿卟啉原III的转化过程,说明Cd胁迫可能导致该转化过程受阻。向丽霞等[28]发现高温胁迫下番茄(Solanumlycopersicum)幼苗叶绿素的合成受阻位点是胆色素原到尿卟啉原III的转化过程,可造成原卟啉Ⅳ、镁-原卟啉、原叶绿素酸酯和叶绿素a的降低,这与本研究结果一致。本研究发现Cd处理的草地早熟禾叶片的镁-原卟啉Ⅳ和原叶绿素酸酯含量在胁迫6 d时较CK下降幅度有所减小,这可能与PpPBGD和PpPOR基因在胁迫后期的上调表达有关,但Cd处理叶绿素a和总叶绿素含量在6 d时的降幅最大,这说明Cd胁迫后期叶绿素含量的降低可能与叶绿素的降解有关。
植物叶片衰老过程中的叶绿素降解过程包括:叶绿素酶催化的叶绿素去植醇基反应;脱镁叶绿素酶催化的去除镁离子反应;脱镁叶绿素酸氧化酶催化的卟啉氧化降解反应;红色叶绿素分解代谢物还原酶催化荧光叶绿素降解中间产物的分解代谢[34]。PpCLH,PpPPH,PpPAO和PpRCCR基因分别编码上述4个步骤的关键酶[35]。在高温诱导的匍匐翦股颖(Agrostisstolonifera)叶片衰老过程中,叶绿素酶(CLH)和脱镁叶绿素酶(PPH)活性显著增高[26]。拟南芥(Arabidopsisthaliana)PPH基因的缺失突变体表现出滞绿的表型,其叶片衰老过程中叶绿素不能够被降解[36]。此外,在小麦(Triticumaestivum)、黄瓜(Cucumissativus)和辣椒(Capsicumannuum)等农作物上的研究表明,低温、高温、盐和干旱等非生物胁迫均可诱导PAO和RCCR基因的上调表达[37-39]。本研究表明Cd处理可诱导PpCLH,PpPPH,PpPAO和PpRCCR基因的上调表达,说明Cd胁迫引起叶绿素的降解。
3.2 外源EBR对Cd胁迫下草地早熟禾叶绿素代谢的调控
外源EBR可通过调节植物的生理代谢过程及生长发育来提高植物在干旱、盐碱、高温和重金属等逆境胁迫的能力[14-17]。已有研究表明外源EBR具有提高逆境胁迫下叶绿素含量的作用[12,16]。Peng等[40]发现外源EBR可提高Cd胁迫下Cd超富集植物龙葵叶片的叶绿素含量。本研究亦发现外源EBR可缓解Cd胁迫导致的草地早熟禾叶绿素a和总叶绿素含量的降低,这说明外源EBR可能对草地早熟禾叶绿素生物合成或者降解途径具有一定的调控作用。
BZR1基因是BRs信号转导途径下游重要的转录因子,可通过调控相应靶标基因的表达来调控不同的生物学过程[41],番茄BZR1基因沉默株系可引起叶绿素的降解[42]。光敏色素作用因子(PIFs)也参与BR信号的调控网络,BZR1-PIF4复合体可调控植物的生物学过程,BZR1也可通过DELLA蛋白与PIF1,PIF3和PIF3互作[43]。已有研究表明,PIF1基因可介导POR基因的表达而直接调控拟南芥叶片叶绿素的生物合成[44]。本研究外源EBR可显著诱导Cd胁迫下草地早熟禾PpPOR基因的上调表达。这说明外源EBR可能是通过BR信号途径介导PIF来调控Cd胁迫下草地早熟禾叶绿素的生物合成。外源EBR可在一定程度上诱导草地早熟禾叶片的叶绿素a合成通路其他关键基因的上调表达,进一步缓解Cd胁迫对草地早熟禾叶片叶绿素合成中间产物及叶绿素含量的抑制,同时,外源EBR可抑制Cd胁迫诱导的叶绿素降解代谢相关基因上调表达。Peng等[40]研究发现外源EBR可诱导逆境胁迫下龙葵叶片叶绿素合成基因的上调表达和降解通路基因的下调表达,这与本研究结果相似。然而,有关外源EBR是如何调控叶绿素合成和降解通路基因的问题有待进一步的研究。
4 结论
Cd胁迫初期,草地早熟禾叶片的叶绿素合成前体物质原卟啉Ⅳ、镁-原卟啉Ⅳ和原叶绿素酸酯含量与CK相比显著降低,PpPBGD,PpCHLD,PpCHLI和PpPOR基因下调表达,叶绿素降解基因PpCLH,PpPPH,PpPAO和PpRCCR基因上调表达,叶绿素a和总叶绿素的含量显著下降。外源5 ~100 nM EBR处理可显著提高Cd胁迫下草地早熟禾叶片的镁-原卟啉Ⅳ和原叶绿素酸酯含量,其中50 nM的EBR可显著提高Cd胁迫下原卟啉Ⅳ、镁-原卟啉Ⅳ、原叶绿素酸酯叶绿素a和总叶绿素的含量,诱导Cd胁迫下草地早熟禾叶绿素合成通路基因的上调表达,使Cd胁迫下草地早熟禾叶片的叶绿素含量恢复到正常水平。
