骨相关细胞来源外泌体miRNA调节骨形成的研究进展
2021-05-07吴雨蒙孙煜昕
刘 波,吴雨蒙,孙煜昕
(江西中医药大学药学院,江西 南昌 330004)
骨骼是一个动态活性组织,它的形成需要各类骨细胞共同参与。骨形成通常始于骨细胞的死亡,释放的生物活性分子,诱导其他存活的骨细胞分泌核因子κB受体活化因子配体(receptor activator of nuclear factor-κB ligand,RANKL),随后破骨细胞前体被趋化蛋白招募,核因子κB受体活化因子(receptor activator of nuclear factor-κB,RANK)和RANKL在其表面结合启动了破骨细胞生成。与此同时,成骨细胞分泌的巨噬细胞集落刺激因子(macrophage-stimulating factor,M-CSF)、单核细胞趋化蛋白l(monocyte chemoattractant protein-1,MCP-1)和RANKL还能募集破骨细胞前体并促进其向破骨细胞分化。破骨细胞吸收破损骨时分泌胰岛素样生长因子(insulin like growth factor,IGF)和转化生长因子-β(transforming growth factor-β,TGF-β)等耦合因子,可促进成骨细胞对骨骼腔隙的填充,当新矿化的细胞外骨基质完全替代吸收的骨基质时,骨形成过程完成[1]。
近年来,大量文献显示,骨组织中的骨髓间充质干细胞(bone marrow-mesenchymal stem cells,BMSCs)、成骨细胞(osteoblast)、破骨细胞(osteoclast)和骨细胞(osteocyte)等产生的外泌体介导了上述骨形成过程。陈长军等[2]全面地介绍了外泌体在骨以及关节疾病中的作用和在再生医学领域中的应用,本文则主要介绍骨相关细胞来源外泌体中的miRNA对骨形成的调节作用。
1 外泌体简介
1.1 外泌体生物学特性外泌体(exosome)是Johnstone等[3]首先在研究网织红细胞成熟过程中发现的,是一种形似杯状直径约30-150 nm的细胞外囊泡(extracellular vesicles,EVs)。其主要来源于细胞膜内出芽形成的多囊泡体(multivesicular bodies,MVBs),经多囊泡体膜与细胞膜融合后释放到细胞外基质,在外环境中通过受体细胞内吞作用、受体配体相互作用及细胞膜相互融合进行摄取,调节受体细胞的生物学活性[4]。外泌体内容物主要有蛋白质、miRNAs、脂质等[5]。不同来源的外泌体均包含膜转运融合蛋白(GTPase、Annexins和 flotillin),四跨膜蛋白(CD9、CD63、CD81和CD82)和热休克蛋白(Hsc70、Hsp 90、Hsp60和Hsp20)等,其中四跨膜蛋白常是区别外泌体与其他细胞外囊泡(微囊泡和凋亡小体)的分子标记物[6]。外泌体脂质双分子层中富含胆固醇、神经酰胺及鞘磷脂等,可防止外泌体内部的RNA、蛋白质等生物活性物质在细胞外环境中被破坏,通过转运这些生物信息分子,在细胞间通讯中发挥了重要作用。
1.2 外泌体的应用Welker等[7]发现慢性丙型肝炎患者血清中可溶性CD81水平显著升高;而Goto等[8]在寻找胰腺癌早期诊断标志物时发现,胰腺癌患者血清外泌体中miR-191、miR-21、miR-451a表达水平比健康人高,上述研究表明,外泌体的分子成分如外泌体相关蛋白和微小RNA等,具有作为分子标记物用于临床诊断的潜力。外泌体可从血液、尿液、唾液、脑脊液等体液中获取[9],研究发现,来自人尿干细胞的外泌体可以促进骨形成相关基因OCN、ALP、RUNX2的表达,而通过转运CTHRC1和OPG抑制破骨的形成[10]。外泌体还具有细胞毒性小、生物相容性好、免疫抑制性低等优点,可作为天然的纳米级药物载体[11]。目前运用外泌体载药有以下几种方式[12]:(1)药物与外泌体共孵育;(2)通过转染试剂或者电转染将药物装载入外泌体中;(3)药物与供体细胞共孵育或者转染供体细胞,供体细胞分泌的外泌体就含有药物。Aqil等[13]便是直接用姜黄素与外泌体共孵育来获得载药外泌体,结果表明,与游离姜黄素相比,载药外泌体组抗炎活性和抗肿瘤活性更高,提高了姜黄素的生物利用度。
2 外泌体miRNA对骨形成的作用
miRNA是一类非编码单链RNA分子,包含19-25个核苷酸[14]。miRNA不稳定易于降解,外泌体中的miRNA有外泌体的包裹,因而对普遍存在的RNA酶,极端温度和pH水平具有更好的耐受性甚至可以在细胞外环境中保存较长时间。受体细胞通过质膜融合和胞吞作用摄取外泌体miRNA并发挥其生物学功能[15]。本文将着重描述骨相关细胞来源外泌体miRNA对骨形成的作用。
2.1 骨髓间充质干细胞来源外泌体miRNA对骨形成的作用骨髓间充质干细胞 (BMSCs)是一类具有自我更新和多向分化潜能的干细胞,在特定条件下可以分化为成骨细胞,BMSCs来源的外泌体可以上调生长因子、骨形态发生蛋白2(bone morphogenetic protein2,BMP2)和TGF-β1,还能使miRNA表达谱朝成骨细胞谱系分化促进骨形成。Xu等[16]首次对人骨髓间充质干细胞成骨分化过程中外泌体miRNA的表达谱进行分析,研究结果显示,let-7a、miR-199b、miR-218、miR-148a、miR-135b、miR-203、miR-219、miR-299-5p和miR-302b表达水平显著升高,而miR-221、miR-155、miR-885-5p、miR-181a和miR-320c表达水平显著降低;对miR-885-5p进一步研究表明,miR-885-5p通过抑制Runx2从而抑制成骨细胞相关基因的表达,可作为BMSCs成骨分化的负调控因子。而Qin等[17]研究表明BMSCs源性外泌体miR-196a在体外能上调成骨相关基因ALP、OCN、OPN和RUNX2的表达从而影响成骨细胞的分化,体内实验结果显示了BMSCs来源外泌体可以增加颅骨缺损的SD大鼠的骨形成。Wang等[18]对人骨髓间充质干细胞成骨分化各阶段分泌的外泌体进行研究,发现成骨分化后期外泌体miRNA的表达存在显著差异,miRNA表达谱分析揭示了外泌体miRNA表达的变化,其中成骨分化负调控因子miR-31、miR-221和miR-144表达水平显著降低,成骨分化正调控因子miR-21则显著升高,表明这些外泌体miRNA参与了成骨分化的调节。以上研究说明,BMSCs源性外泌体miRNA在成骨细胞分化和成骨基因表达的调控中起着至关重要作用,进而影响骨形成。
2.2 破骨细胞来源外泌体miRNA对骨形成的作用在骨形成过程中,除了众所周知的成骨细胞通过RANK/RANKL途径调节破骨细胞生成及骨吸收以外,越来越多的证据表明破骨细胞可以通过ephrinA2/EphA2途径等直接方式或旁分泌等间接方式调节成骨细胞的活动。外泌体miRNA经过旁分泌途径参与成骨细胞和破骨细胞间的信息传递。破骨细胞分泌的富含miR-214-3p的外泌体可定向运输至成骨细胞中,体外实验结果表明破骨细胞源性外泌体miR-214-3p通过靶向成骨转录因子ATF4抑制成骨细胞活性进而抑制骨形成。实时荧光定量PCR结果显示用破骨细胞源性外泌体miR-214-3p处理的小鼠成骨标志基因ALP、OPN、BSP和BGLAP的mRNA水平显著降低,显微CT分析显示骨质量降低和骨小梁结构紊乱,这些结果阐明破骨细胞源性外泌体miR-214-3p可以抑制体内骨形成[19]。
另一项研究表明,破骨细胞分泌的外泌体miR-23a-5p通过靶向RUNX2来抑制成骨细胞的分化。该实验显示破骨细胞源性外泌体miR-23a-5p会抑制成骨细胞的活性,运用N-SMase抑制剂GW4869及Rab27a siRNAs抑制外泌体的释放,发现破骨细胞源性miR-23a-5p对成骨细胞的抑制作用减弱了,提示外泌体对miR-23a-5p作用的发挥具有重要作用;此外,还进一步探讨了破骨细胞源性外泌体miR-23a-5p抑制成骨细胞功能的具体机制,研究结果证明了miR-23a-5p可以靶向抑制成骨分化相关基因RUNX2的表达,通过调控下游信号通路(RUNX2-MT1DP- RUNX2反馈通路)影响成骨细胞分化,进而影响骨形成[20]。
2.3 成骨细胞来源外泌体miRNA对骨形成的作用在Cui等[21]的一项研究中,他们发现成骨细胞可以释放出含有成骨性miRNA的外泌体,这些外泌体被骨髓基质细胞(ST2)摄取,从而促进了骨髓基质细胞向成骨细胞分化。此外,该研究显示转移成骨细胞外泌体后受体ST2细胞中miRNA谱发生显着改变,计算机模拟数据表明,这些改变的miRNA可能会影响调控成骨细胞分化和功能的多个重要途径,例如Wnt信号途径,胰岛素信号途径,TGF-β信号途径和钙信号途径。进一步研究证明了成骨细胞来源的外泌体通过激活Wnt信号通路抑制ST2细胞中Axin1表达并增加β-catenin表达来促进成骨。总之,该研究表明成骨细胞来源外泌体通过转移miRNA影响受体ST2细胞向成骨细胞的分化,进而影响骨形成。
2.4 骨细胞来源外泌体miRNA对骨形成的作用Qin等[22]在研究骨骼与肌肉的相互作用时发现,肌肉细胞分泌的细胞因子(肌生长抑制素)可以促进骨细胞中成骨抑制基因(SOST,DKK1和RANKL)的表达,同时抑制miR-218在Ocy454细胞和其衍生的外泌体中的表达,表明肌生长抑制素(myostatin)通过抑制骨细胞来源的外泌体miR-218抑制成骨细胞的活性及其分化,暗示骨细胞源性的外泌体miR-218可以促进成骨细胞分化。该实验结果显示,经肌生长抑制素修饰的骨细胞源性外泌体抑制了Wnt/β-catenin信号通路,从而抑制成骨细胞的分化和活性。将肌生长抑制素修饰的骨细胞源性外泌体与成骨细胞共培养时发现,共培养组中促进成骨细胞分化的关键调节因子RUNX2和骨钙素的mRNA表达下调,抑制成骨细胞分化的调节因子SOST mRNA表达上调;转染的外源性miR-218通过抑制SOST可完全逆转肌生长抑制素修饰的骨细胞外泌体对成骨细胞分化的抑制作用,证明骨细胞所分泌的富含miR-218的外泌体能够通过激活Wnt信号通路抑制SOST的表达来促进成骨细胞的分化。
2.5 外泌体其他生物活性分子对骨形成的作用外泌体内含物除了miRNA以外,还有蛋白质、脂质及其他生物活性分子,这些生物活性分子也会影响骨形成。最近蛋白质组学研究表明,成骨细胞来源的外泌体包含大量蛋白质,这些蛋白质在成骨相关信号通路如整联蛋白信号通路、mTOR信号通路和真核起始因子2(EIF2)信号通路中高度富集,可能对成骨产生影响[23]。成骨细胞分泌的富含RANKL的外泌体可以靶向运输至单核细胞,在单核细胞表面与RANK结合从而激发破骨细胞形成,间充质干细胞分泌的外泌体通过上调Nfatc1、Trap和Ctsk的表达可以增强这一过程,随后破骨细胞分泌的耦合因子可以促进成骨细胞骨形成,从而构成了一个正反馈通路[1]。
3 小结与展望
外泌体调节骨形成是一个受多种因素影响的复杂过程。骨相关细胞来源的外泌体可以通过调节成骨分化基因(ALP、RUNX2等)、成骨抑制基因(SOST,DKK1和RANKL)以及Wnt/β-catenin信号通路等机制来影响成骨细胞的活性和功能(Fig 1)。目前,骨相关细胞来源外泌体中miRNA作用的靶点尚不明确,尽管计算机模拟数据表明这些外泌体miRNA可以参与调节Wnt信号途径,胰岛素信号途径,TGF-β信号途径和钙信号途径,但是缺少相关文献资料,对其进行验证的研究也较少。因此进一步的研究需深入关注外泌体miRNA发挥调节骨形成的作用靶点。此外,大量文献显示,骨相关细胞中的外泌体不仅可以介导生理情况下骨髓微环境内的细胞间通讯,还参与了骨骼疾病的病理过程。霍春晖等[24]对骨质疏松症患者血清外泌体的蛋白质组学进行研究时发现Integrinβ3、Integrinα2β1、Talin 1和Gelsolin等17个蛋白质的表达量在骨质疏松症组和骨量减少组有显著改变;杜昱和等[25]对骨量减少患者血清外泌体中miRNA进行筛选,结果显示34个miRNA有显著差异。所以,研究在生理及病理条件下骨相关细胞中外泌体的变化情况及其作用的靶点,对阐明骨质疏松症发生发展的分子机制具有重大意义。
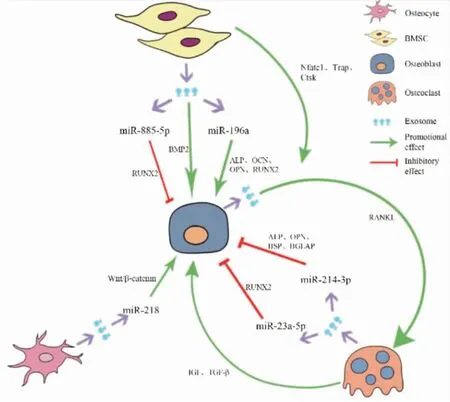
Fig 1 Effects of miRNA in exosomes derived from bone-related cells on osteoblasts
为了逐步实现中医药现代化,促进中医药事业的发展,中医药与外泌体相结合为其提供了新的研究思路。有研究表明,中药可以引起外泌体内含物的改变,进而发挥调控疾病的作用。Yang等[26]研究显示,补阳还五汤干预后间充质干细胞来源的外泌体可以促进内皮细胞中血管内皮生长因子的表达,而且补阳还五汤可以上调外泌体中miR-126的表达并下调miR-221和miR-222的表达,进而增加大鼠脑中的血管生成。张小艺等[27]研究表明梓醇可以促进神经母细胞瘤细胞分泌外泌体且梓醇修饰的外泌体可以保护神经;Wei等[28]研究表明紫草素通过下调肿瘤来源外泌体miR-128的表达抑制乳腺癌MCF-7细胞的增殖等。综上,中药能够改变外泌体的分泌并发挥重要调控作用从而影响疾病的进程。目前,关于中医药通过外泌体对骨质疏松症等疾病作用的报道较少,我们前期研究表明二仙汤防治骨质疏松与促进大鼠骨髓间充质干细胞增殖和骨向分化有关[29],且BMSCs源性外泌体能使miRNA表达谱朝成骨细胞谱系分化[18],但二仙汤对BMSCs来源外泌体的作用尚不清楚。从外泌体角度探讨中医药防治疾病的分子机制将是未来研究方向之一。
