不同煎煮工艺对四君子汤有效成分和免疫调节功能的影响△
2021-05-07吕邵娃郭乔馨尚尔雨吴茜于新郭玉岩杨大宇李永吉孙爽
吕邵娃,郭乔馨,尚尔雨,吴茜,于新,郭玉岩,杨大宇,李永吉*,孙爽*
1.黑龙江中医药大学 药学院,黑龙江 哈尔滨 150040;2.黑龙江省森林保护研究所,黑龙江 哈尔滨 150081
由于现代社会生活节奏的不断加快,饮食不节、劳倦过度及久病体虚等多种因素常导致大量的亚健康人群存在脾虚表现,以不思饮食、神疲乏力、脾虚泄泻及便溏等临床症状为主要特征[1]。四君子汤是治疗该类疾病的经典名方,出自宋代《太平惠民和剂局方》,由人参、茯苓、白术、甘草组成,具有益气健脾的功效,主治脾胃气虚证[2]。有文献记载,四君子汤的水溶性成分主要来源于君药人参和臣药甘草[3]。四君子汤为补气经典方剂,对于慢性胃炎、胃及十二指肠溃疡等疾病疗效显著。能够改善胃肠的消化和吸收功能、增加胃肠推进功能、缓解脾虚证[4]。实验研究表明,四君子汤可通过调整细胞因子间的网络平衡,改善胃肠道的内分泌功能,减轻胃肠黏膜的炎症反应,从而发挥对胃肠黏膜的保护作用[5-8]。古方记载四君子汤提取工艺为:“水一盏,煎至七分”[9]。然而,古代的单位与现代有一定的差异,因此,具体的加水量、煎煮时间、浸泡时间尚不清楚。一般传统提取工艺都以方中有效成分含量、浸出率为检测指标,然而,中药方剂成分复杂,作用机制尚不明确,仅以化学成分作为参考指标并不能全面评价制剂工艺[10-11]。本研究结合《中华人民共和国药典》(以下简称《中国药典》)2015年版的人参和甘草质量标准中含量测定指标,选择四君子汤中人参皂苷Rg1、人参皂苷Re和甘草酸含量及浸出率作为理化指标[12-14]。
根据文献记载,苦寒之药损伤脾胃,连续灌服大黄,会出现与临床相似的“脾气虚”症状[15-17]。已知脾虚可使机体免疫功能降低,而肠道又是发挥局部免疫效应的重要场所,且脾虚可导致胃肠黏膜分泌功能紊乱。因此,本实验选择苦寒泻下法复制大鼠脾虚模型,考察四君子汤提取物对脾虚大鼠肠黏膜CD3阳性细胞占比的影响;采用L9(34)正交试验法,考察不同煎煮工艺参数对四君子汤有效成分及胃肠道免疫调节活性的影响,为四君子汤后续的研究提供参考。
1 材料
1.1 实验动物
SPF级SD大鼠,雌雄各半,体质量为(200±20)g,购于青岛大润富城畜牧有限公司,合格证号:11401300029922,实验动物生产许可证号:SCXK(鲁)2014-0001。所有关于大鼠的实验操作都遵守国际和本地实验动物使用和保护委员会颁布的条例,通过黑龙江中医药大学实验动物伦理委员会审批(审批号为2019092805)。
1.2 试药
四君子汤处方为人参9 g、白术9 g、茯苓9 g和炙甘草6 g。人参、茯苓、白术、炙甘草、大黄均购于哈尔滨市同仁堂大药房,以上饮片经黑龙江中医药大学药学实训教研室吕邵娃教授鉴定为正品,均符合《中国药典》2015年版要求,标本存放于黑龙江中医药大学药学院实验室。
乙腈、甲醇(色谱纯,北京迪科马科技有限公司);甲酸(色谱纯,天津市科密欧化学试剂有限公司);实验用水为娃哈哈纯净水;正丁醇(分析纯,天津市富宇精细化工有限公司);对照品人参皂苷Rg1(批号:wkq17043802)、人参皂苷Re(批号:wkq17963218)、甘草酸(批号:wkq17052701)均购于四川省维克奇生物科技有限公司,以上对照品纯度均大于98%;淋巴细胞分离液(天津灏洋生物制品科技有限公司);CD3-FITC抗体(赛默飞世尔科技公司)。
1.3 仪器
Ultimate 3000型高效液相色谱仪(美国Thermo Fisher公司);JY5002型电子分析天平(上海光学仪器厂);SK8200H型超声波清洗器(北京康林科技有限公司);Mettler AE50型电子天平(瑞士梅特勒-托利多公司);Accuri C6型流式细胞仪(美国BD公司)。
2 方法
2.1 正交试验优选四君子汤最佳提取工艺参数
以人参皂苷Rg1、人参皂苷Re、甘草酸的含量,浸出率及CD3细胞百分率为评价指标,在前期确定最佳煎煮次数为2次后,对影响提取效果的浸泡时间(A)、煎煮时间(B)和加水量(C)进行考察,每个因素下设定3个水平,其因素水平见表1。采用L9(34)表进行正交试验设计,见表2。
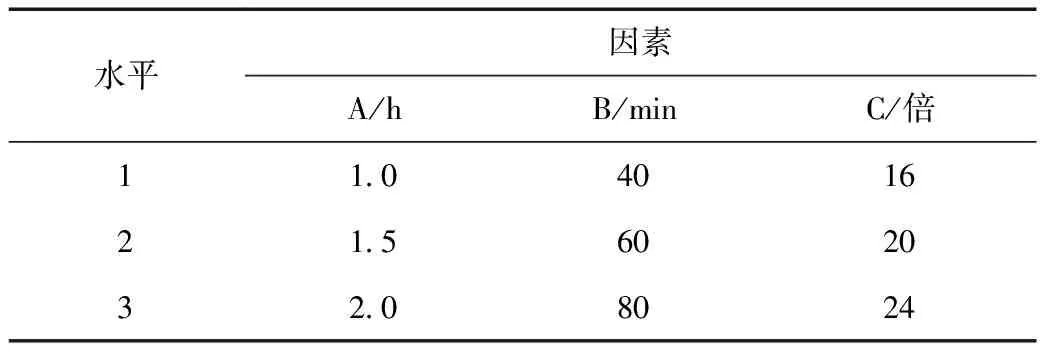
表1 四君子汤提取工艺正交试验设计因素水平
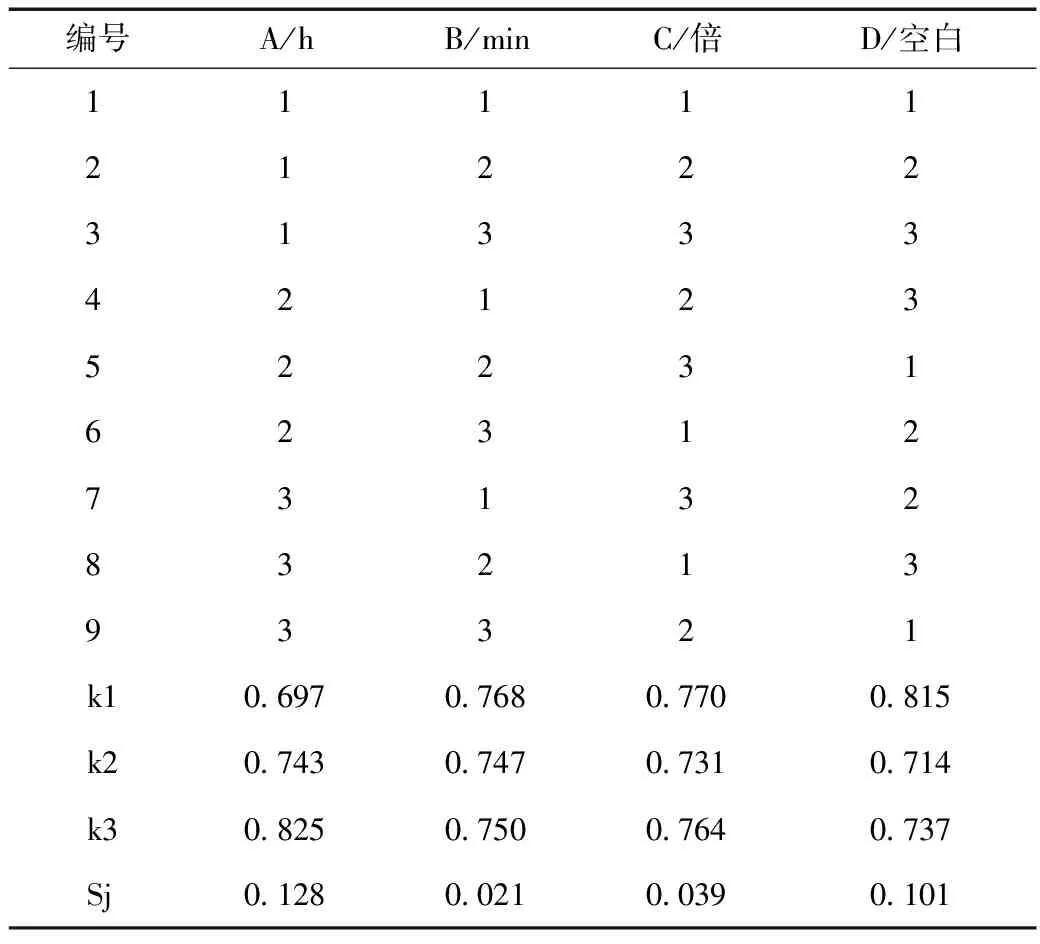
表2 四君子汤提取工艺L9(34)正交试验设计表
2.2 人参皂苷及甘草酸含量测定
2.2.1色谱条件及系统适用性实验 Agela Venusil XBP C18型色谱柱(250 mm× 4.6 mm,5 μm);流动相为水(含0.03%甲酸,A)-乙腈(B),梯度洗脱(0~55.0 min,81%A;55.0~70.0 min,81%~71%A;70.0~110.0 min,71%~60%A);流速:1.0 mL·min-1;柱温:25 ℃;人参皂苷Rg1、人参皂苷Re检测波长为203 nm,甘草酸检测波长为250 nm;进样量:5 μL。
在此色谱条件下,人参皂苷Rg1、人参皂苷Re和甘草酸能与杂质完全分离,并取得较好的峰形和较高的理论塔板数。色谱图见图1。
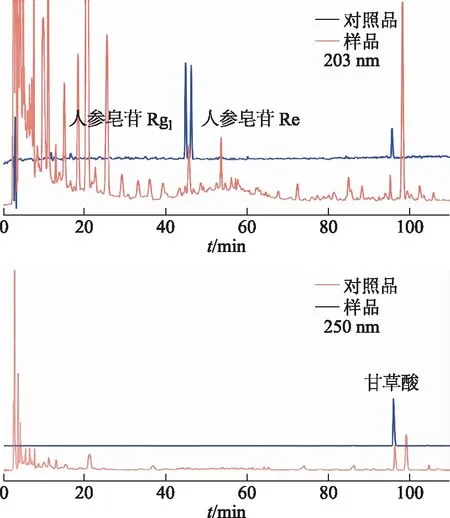
图1 四君子汤供试品与对照品色谱图
2.2.2供试品溶液制备 取2.1项下1~9号提取方法制备的四君子汤药液适量,6000 r·min-1离心10 min(离心半径为8 cm)后取上清液50 mL置于分液漏斗中,用水饱和正丁醇萃取3次,每次50 mL。合并正丁醇液,蒸干,残渣加甲醇适量分次溶解,移至10 mL量瓶中,加甲醇至刻度,作为供试品溶液。
2.2.3对照品溶液制备 称取对照品人参皂苷Rg1、人参皂苷Re及甘草酸适量,加甲醇制成分别含人参皂苷Rg10.236 mg·mL-1、人参皂苷Re 2.580 mg·mL-1和甘草酸1.712 mg·mL-1的对照品溶液,用甲醇定容至刻度,摇匀,即得。
2.2.4方法学考察 精密吸取2.2.3项下人参皂苷Rg1、人参皂苷Re及甘草酸对照品溶液,分别稀释0、2、4、5、10、15倍,配制成系列质量浓度的对照品溶液,分别取5 μL在2.2.1项下色谱条件下进样分析,以对照品质量浓度为横坐标(X),以色谱峰峰面积为纵坐标(Y),得人参皂苷Rg1回归方程为Y=823 149X+ 9 662.1,r=0.999(n=5),人参皂苷Re回归方程为Y=925 963X-19 115,r=0.999(n=6),甘草酸回归方程为Y=3×106X-28 139,r=0.999(n=6)。结果表明,人参皂苷Rg1、人参皂苷Re及甘草酸对照品质量浓度分别在0.016~0.236、0.172~2.580、0.114~1.712 mg·mL-1内线性良好;精密度试验RSD分别为2.17%、1.69%、0.92%,表明仪器精密度良好;分别于0、2、4、8、12、24 h对3种指标性成分进行定量测定,稳定性试验RSD分别为2.27%、2.45%和0.91%;重复性实验RSD分别为2.90%、2.42%和2.22%;平均加样回收率分别为98.75%、100.13%和100.26%,RSD分别为1.82%、0.94%和0.90%。
2.2.5样品测定 精密量取正交试验汤剂1~9号样品,按照2.2.2项下方法制备供试品溶液,进样测定。每份样品重复测定3次,根据线性回归方程,计算样品中各指标性成分平均含量。
2.3 浸出物测定
精密量取2.1项下1~9号提取方法制备的四君子汤药液10 mL(相当于生药量1.40 g),置于已干燥至恒定质量的称量瓶中,在水浴上蒸干后,于105 ℃干燥3 h至恒重,移置干燥器中,冷却30 min,迅速精密称定质量,根据公式(1)计算标准汤剂浸出率[13]。实验重复3次。
浸出率=干膏质量/净药材投入质量×100%
(1)
2.4 药效学实验
2.4.1药品制备 大黄水煎液制备:取一定量的大黄,加10倍水浸泡30 min后,煮沸30 min,滤过。药渣再加7倍量水煮沸30 min,合并滤液并浓缩至生药量为1 g·mL-1。
四君子汤供试品溶液制备:按照正交试验设计工艺对四君子汤进行煎煮,将所得的药液浓缩至生药量为1 g·mL-1。
2.4.2分组与脾虚模型制备 SPF级SD大鼠,雌雄各半,随机分为11组,每组6只,分别为对照组、模型组及实验1~9组。对照组大鼠每次灌胃给予0.9%氯化钠溶液10 mL·kg-1,2次/d,连续给予28 d;其余各组大鼠每次灌胃给予大黄水煎液10 mL·kg-1,2次/d,连续给予14 d,制备脾虚大鼠模型。取造模成功的大鼠随机分组。模型组大鼠于第十五天起每次灌胃给予0.9%氯化钠溶液10 mL·kg-1,2次/d,连续给予14 d;各实验组大鼠均在第十五天造模成功后灌胃给予相应药物,7.56 g·kg-1(以生药量计),连续给予14 d。以上各组大鼠均自由采食和饮水。
2.4.3CD3细胞百分率测定 末次给药后,大鼠腹腔注射10%水合氯醛溶液麻醉后,开腹,距回盲部5 cm处取回肠组织约20 cm,沿中线剪开肠管,用载玻片刮取肠内组织,磷酸盐缓冲液(PBS)溶解后用300目铜网滤过,制成肠组织细胞悬液,3000 r·min-1离心10 min(离心半径为8 cm),去上清液,加PBS 10 mL混匀后滤过2次,加入淋巴细胞分离液3 mL,3000 r·min-1离心10 min(离心半径为8 cm),取白色分层,预冷的PBS洗涤2次,悬浮至1 mL,调整细胞浓度至1×106个/mL左右,取细胞悬液1 mL,取专用试管2支,每管中加入细胞悬液100 μL,然后依次加入CD3-FITC抗体及其同型对照抗体,充分混匀,室温避光孵育30 min。1500 r·min-1离心5 min(离心半径为8 cm),去上清液。用PBS 2 mL洗涤2次,加入PBS 0.5 mL悬起,4 ℃避光1 h内在流式细胞仪上检测,Flowjo 10软件分析数据。

3 结果
3.1 不同煎煮方式四君子汤对脾虚模型大鼠肠组织CD3阳性细胞占比的影响
实验结果见表3和图2。由结果可知,模型组CD3阳性细胞数与对照组相比明显减少,差异有统计学意义(P<0.01)。各治疗组与模型组相比均可在一定程度上提高CD3阳性细胞占比,表明四君子汤可通过增加CD3阳性细胞占比来改善脾虚所致的胃肠免疫功能紊乱的情况。
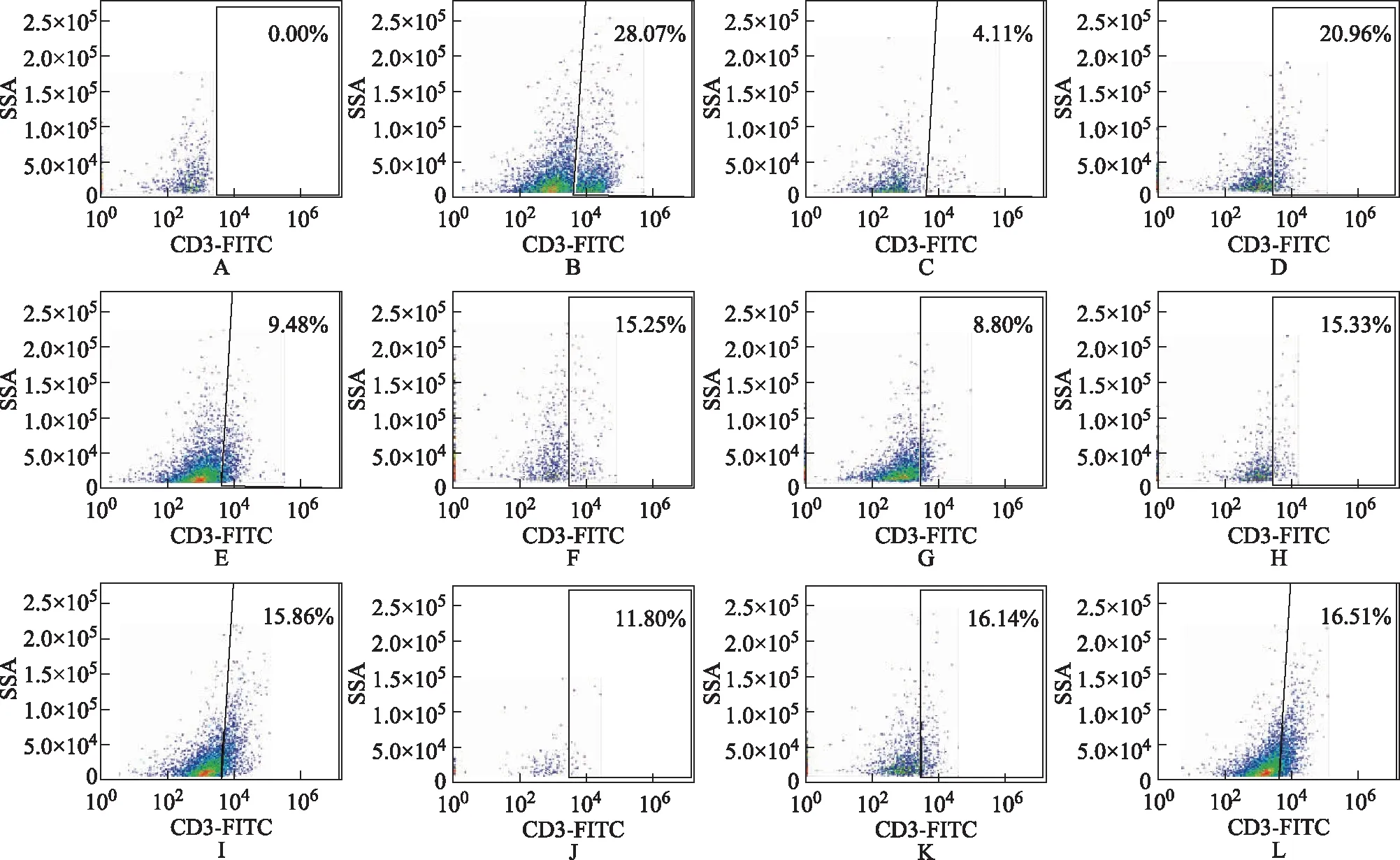
注:A.不加FITC-CD3抗体的空白对照组;B~L.对照组、模型组、实验1~9组。
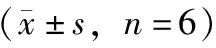
表3 各组大鼠回肠组织中CD3阳性细胞占比
3.2 四君子汤不同煎煮方式对人参皂苷、甘草酸含量及浸出率的影响
随着浸泡时间的延长,汤剂中的主要指标性成分的质量浓度先增加后减小;随着煎煮时间的延长,汤剂中人参皂苷Rg1的含量及浸出物不断增加,而人参皂苷Re和甘草酸的含量不断减小;随着加水量的增加,汤剂中的主要指标性成分的质量浓度及浸出物有所增加。结合各组CD3细胞占比结果,对四君子汤质量进行综合评分及方差分析,实验设计与结果见表4,方差分析结果见表5。
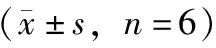
表4 不同煎煮方式四君子汤中人参皂苷、甘草酸质量分数,浸出率及综合评分
由正交试验直观分析表明,3个主要因素对四君子汤质量的影响程度依次是A>C>B,D列是空白列,主要作用是减小误差。再通过表5方差分析表进一步分析,因素A对四君子汤的煎煮工艺有显著影响(P<0.05),故浸泡时间确定为2.0 h。因素B、C对四君子汤煎煮工艺的影响不显著,结合极差的大小,考虑到节约能源和时间的角度等实际生产情况,可以确定最佳煎煮工艺为A3B1C1,即药材浸泡2 h,煎煮2次,每次加8倍量水,每次煎煮40 min。

表5 方差分析表
4 讨论
脾胃是机体与外界进行物质交换的场所,摄取生命活动过程中所必需的营养物质。胃主“受纳”水谷,脾主“运化”水谷精微物质。脾胃虚证是现代临床中较为常见的中医内科疾病,是一组集中反映脾生理功能不足的综合症候群。本课题选择治疗脾胃病证的代表方剂四君子汤作为研究对象,方中所含君药人参主要成分为人参皂苷,具有滋阴强壮、扶正固本的功效,起到健脾养胃、提高患者免疫力的作用;白术为臣药,有健脾燥湿的功效;茯苓为佐药,有抗肿瘤、健脾安神的功效。甘草为使药,甘缓和中,有抗病毒功效;四药相辅,温而不燥,补而不峻,共奏益气健脾之功,故名四君子汤[18]。四君子汤对治疗中医内科疾病脾胃虚证具有积极的作用,有一定的研究意义。
研究表明,脾虚会导致细胞免疫功能调节紊乱[19],而T细胞是机体调节免疫的主要细胞成分。其中,CD3细胞是所有T细胞的重要标志,其分布和数量可以反映肠黏膜局部的细胞免疫及体液免疫功能,在T细胞免疫中起着必不可少的作用[20]。本研究中,大鼠脾虚时,CD3阳性细胞占比显著降低(P<0.01),说明脾虚大鼠血中的T淋巴细胞总数下降,细胞免疫水平明显下降[21]。给药后,与模型组比较,不同煎煮方式的四君子汤对CD3阳性细胞占比有不同程度的回调,细胞免疫水平明显上升,因此将CD3阳性细胞占比作为考察药效学的指标。
在以往关于优化提取工艺参数的研究中,多采用正交设计选取1个或多个化学成分作为评价指标,然而,中药制剂成分复杂,仅考察理化指标具有局限性。因此,本研究将理化指标和药理活性指标相结合,研究不同煎煮工艺对四君子汤有效成分及其胃肠道免疫调节功能的影响,使优化的提取工艺参数更具有评价效力和合理性。实验结果依据极差的大小分析,确定出最佳煎煮工艺,为四君子汤的后续研究提供参考。
