起搏器远程随访OptiVol功能发现肺部感染一例
2021-05-06江晶晶韩宏伟李艺刘志董倩倩侯红梅
江晶晶 韩宏伟 李艺 刘志 董倩倩 侯红梅
患者男性,60岁,因“心悸、乏力5 年”入院。入院后行动态心电图提示“窦性心动过缓(24 h 39 min 总心搏数71 157次),阵发性心房颤动(简称房颤),窦性停搏”;心脏彩超提示:双房扩大(左房前后径41 mm,右房前后径50 mm),二尖瓣轻度返流,三尖瓣轻-中度返流,左室舒张功能减退,左室射血分数0.56。有房颤射频消融及起搏器植入指证。2019年06月04日行CARTO 指导下的房颤射频消融术,次日行永久起搏器植入术(Medtronic,型号A3DR01)(图1),起搏器植入部位于左侧胸部锁骨下,右房电极放置于右心耳(Medtronic,5076-52 cm),右室电极放置于右室心尖部(美敦力,5076-58 cm),术后起搏模式AAIR⇔DDDR,下限频率60次/分,心房心室起搏输出电压均为3.5 V/0.4 ms,起搏/感知房室间期180 ms/150 ms。
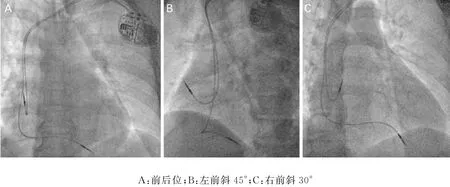
图1 起搏器植入术毕影像
患者2019年06月10日术后复查起搏器参数正常,胸片(图2A)未见异常病变;2019年07月08日至院复查起搏器参数正常,胸片(图2B)提示左上肺少许渗出、可见小片状高密度影,患者无症状,未行处理。2019年10月04日起搏器远程随访监测系统(Medtronic,Mycarelink 25000)传输数据时报警(图3),示自2019年10月03日起OptiVol液体潴留指数超过阈值(60)。行电话随访,患者自觉无明显不适,否认体力下降及下肢水肿,遂建议其至院就诊复查,必要时行胸部CT 平扫。患者于2019年10月09日入院复诊,心脏彩超提示:左房饱满(左房前后径38 mm,右房前后径42 mm),二、三尖瓣轻度返流,左室舒张功能减退,左室射血分数0.56;胸片(图2C)提示左上肺斑片状密度增高影,较2019年07月08 日胸片范围增大。患者拒绝行肺部CT 检查。随后几日患者逐渐出现左侧胸痛、气短及咳嗽咳痰症状,遂于2019年10月15日于当地医院行胸部CT 平扫(无胶片仅存报告)提示:左上肺见条索状、斑片状模糊影,边缘欠清,提示左上肺感染性病变,多考虑为结核(部分纤维增殖灶),未行治疗。2019年10月21日起搏器远程随访监测提示:2019年10月03日至15日OptiVol液体潴留指数超过阈值(图3)。2019年11月06日再次行胸部CT 平扫(图4):左上肺结节、斑片状影,多为感染性病变,结核可能性大,为渗出、增殖化为主,与2019年10月15日胸部CT 比较,左上肺病变有吸收好转。患者2019年10月15日至11月6日之间未行抗感染治疗,2019 年11 月11 日至武汉市结核病防治所住院治疗,结核DNA 测定1 000copies/ml;结核菌涂片(-);纤支镜:左上支气管炎症结核(Ⅰ)? 给予乙胺吡嗪、异烟肼、利福平抗结核、护肝治疗后出院。

图2 起搏器植入术后(2019年)胸片变化
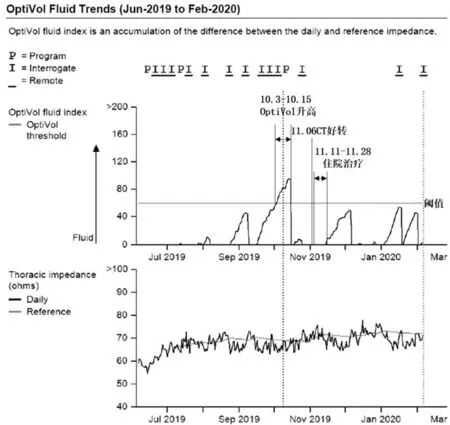
图3 患者OptiVol液体潴留趋势图
讨论 OptiVol技术最早于1996年由华裔学者王励提出,其设计初衷为起搏器通过监测人体胸腔内阻抗(Thoracic impedance)实现心力衰竭(简称心衰)的早期预警[1]。心衰的病理生理表现主要为肺循环与体循环淤血,各浆膜腔可出现积液。当肺淤血或胸腔内出现积液时,富含电解质的血液或积液成为电的良导体,使得胸腔内阻抗下降。具有OptiVol功能的起搏器将定时发放测试脉冲,通过广义欧姆定律算法测定右室电极与金属外壳之间的阻抗(胸内阻抗),当超过设定阈值时则触发警报,若其先于心衰症状出现,则可达到早期预警的效果。OptiVol测试具体运作如下:测试时间为每日中午12时至下午5时,此时间段内每20 min进行一次测试,每次在连续4次心搏中进行脉冲发放。全天采样64次,以平均值记录为当日阻抗实测值。OptiVol液体指数(OptiVol fluid index)是将实测阻抗与参考阻抗之差进行记录,更为直观。OptiVol技术的主要应用如其设计初衷,在慢性心衰的预测方面效果确切,减少慢性心衰患者的住院率及死亡率[2],同时近年来对于参数和算法的改进,使其预测的可靠性与准确性大大提升[3-4]。
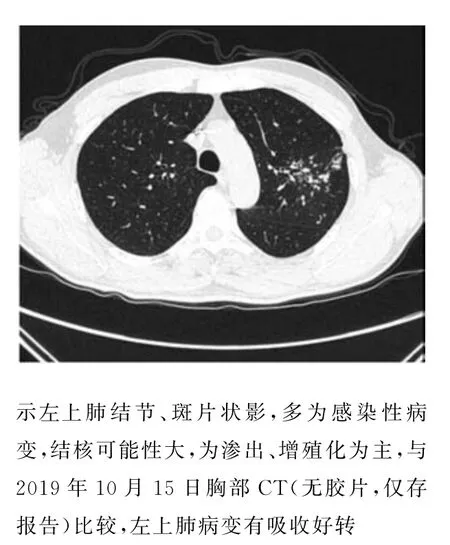
图4 2019年11月06日胸部CT 平扫
随着国内外学者对此技术认识的不断加深,越来越多非心衰的生理或病理情况同样可触发OptiVol预警。从机制上而言,但凡引起测试通路上阻抗降低的因素,如肺炎等胸腔内病变,理论上均可通过OptiVol得以间接体现[5]。Jesel等[6]曾报道一例妊娠过程触发OptiVol预警,其机制可能与妊娠前中期血容量迅速增多有关。Türkoĝlu等[7]亦报道一例肠易激综合征致腹内压升高诱发OptiVol预警的案例,但并未进一步阐明其具体机制,笔者推测,一方面腹内压升高可使膈肌上移,继而挤压胸腔脏器,当肺被挤压时,全肺含气量下降,而后者与胸内阻抗呈正比[5];另一方面,膈肌上抬使得与其接触的心脏与肺在胸腔内的空间结构发生改变,后者亦是影响阻抗的因素之一。除此之外,近年来非心衰领域的OptiVol研究还涉及房性心动过速、室性心动过速、心室颤动等心律失常的预测、先天性心脏病患儿的预后评估以及起搏器植入患者全因死亡的危险分层等领域[8-10]。虽然OptiVol预警功能应用逐渐广泛,但多数为个案报道,缺乏大样本研究,难以对于其他干扰因素进行鉴别与排除,同时部分观点在学术界尚存在争议,故需要理性看待。
本文汇报了一例左上肺肺部感染触发OptiVol功能预警,其机制为肺部炎症引起的局部组织充血及渗出,降低胸内阻抗,目前国内外尚无相关个案报道。值得一提的是,并非双肺病变均可触发OptiVol预警,只有在起搏器测试环路同侧的肺(或胸腔)病变方能影响胸内阻抗[5]。本例患者起搏器囊袋放置于左侧锁骨下,与心腔内的电极形成的测试环路经过左肺,故左肺炎症引起的阻抗改变可以通过OptiVol技术记录。液体潴留指数报警时,应优先考虑是否存在左心功能恶化的可能,病史、症状体征及心脏超声可予以鉴别。另外,患者2019年10月15日影像学提示存在左上肺感染,未予治疗,但随后液体潴留指数即恢复正常,因后未至本院诊室内随访,仅行远程随访,故无2019 年10 月15 日胸部CT 影像学胶片,仅存报告。笔者考虑一方面可能与此次感染存在自限性(2019年11月06日复查CT 提示较前吸收)有关;另一方面,影像学评估肺部感染实际情况存在滞后。液体潴留指数的变化趋势与肺部感染的影像学及病情变化的同步性尚待进一步研究。
