高山兀鹫肠道微生物的分离鉴定与耐药性分析
2021-05-06候建平郑思思海佳怡朱丽琳
候建平 郑思思 龙 鑫 海佳怡 王 稳* 朱丽琳
(1.青海大学省部共建三江源生态与高原农牧业国家重点实验室,西宁,810016;2.青海大学生态环境工程学院,西宁,810016;3.西宁市野生动物疫源疫病监测站,西宁,810001)
全球鹫类仅有23种,中国有8种(占34.8%),是世界上鹫类资源较为丰富的国家之一[1]。早在2015—2016年,中国科学院新疆生态与地理研究所马鸣研究员曾提出拯救“三鹫”之倡议,建议在中国重点保护秃鹫(Aegypiusmonachus)、胡兀鹫(Gypaetusbarbatus)和高山兀鹫(Gypshimalayensis)3种鹫类,目的是以此“三鹫”的保护与科研为典范,发挥示范带动效应,进而推动我国分布的8种鹫类的全面保护。高山兀鹫,又名喜马拉雅兀鹫,在动物分类上,隶属于鹰形目(Accipitriformes),鹰科(Accipitridae)[2]。在保护等级上,高山兀鹫为国家二级保护鸟类,受到法律保护。也被列入濒危野生动植物种国际贸易公约(CITES公约)附录Ⅱ,限制贸易。世界自然保护联盟(IUCN)在2014年将其列入濒危物种红色名录,保护等级为近危(Near Threatened,NT)[3]。在种群数量上,国际鸟类联盟(BirdLife International)给出的高山兀鹫全球种群数量预估数字为66 000—334 000[3]。我国鸟类学者卢欣教授则估计高山兀鹫的全球种群数量约为286 749(±50 559)只,同时估计了我国青藏高原的种群数量为229 339(±40 447)只,最大容纳量可达507 996只[4]。在地理分布上,高山兀鹫集中分布于我国的西部高山、高原地区,包括天山、昆仑山、帕米尔高原、喀喇昆仑山、喜马拉雅山以及青藏高原。国外主要分布于中亚、印度等地。从食物链的角度而言,高山兀鹫以腐为食,享有“自然界清道夫”的美誉,是食物链中不可或缺的一环。由于诸多威胁因素的存在,高山兀鹫野外种群数量呈现下降趋势[5]。目前高山兀鹫全球种群受威胁因素包括:食物缺乏、栖息地破坏、环境污染、盗猎与贩卖、标本制作、电网威胁以及兽药滥用(如双氯芬酸类药物)[6]等。关于高山兀鹫的研究内容多集中在:高山兀鹫的种群分布与记录[5,7],高山兀鹫死亡样本的形态学与组织学研究[8-9],高山兀鹫繁殖生态学的研究[10-12]以及国外研究者开展的双氯芬酸类兽药影响高山兀鹫生理及种群数量的研究[13-15]。
随着高通量测序技术以及生物信息分析手段的巨大进步,肠道微生物组学(gut microbiome)成为当下生命科学的研究热点。越来越多的研究表明,寄生、互利共生、共栖于肠道的微生物与宿主的神经系统、内分泌系统、免疫系统存在相互调控,进而与宿主的生理(发育、免疫稳态、营养物质代谢及维生素合成等)及众多疾病的发生存在关联,甚至影响着宿主的情绪及行为[16]。对于野生鸟类而言,肠道微生物从羽毛护理到卵的孵化等多个层面影响着鸟类宿主的生理及病理过程[17-20]。结合本课题组近年来开展的野生鸟类肠道微生物组学研究,我们提出观点,高山兀鹫的肠道微生物必然是“取之于腐食,用之于腐食”。所谓“取之于腐食”,即腐食中存在的各种微生物会被高山兀鹫摄取,然后定殖于其肠道区域,成为其肠道微生物组的一部分。所谓“用之于腐食”,即经过漫长的进化,受到自然选择并被保留下来的与高山兀鹫宿主达到互利共生状态的肠道微生物组,既可辅助高山兀鹫对腐食进行消化、吸收及代谢;又可辅助高山兀鹫抵抗腐食中出现的病原菌。因此,从肠道微生物的角度阐释高山兀鹫腐食适应机制是一个值得深入探索的研究领域。近年来,国内只有中国疾病预防控制中心传染病预防控制所徐建国院士课题组利用宏分类组学的方法分析了高山兀鹫、秃鹫以及胡兀鹫的肠道微生物谱系,并利用培养的方法得到了高山兀鹫肠道放线菌属(Actinomyces)的新种[21-22]。而国外对鹫类肠道微生物组的研究多集中于红头美洲鹫(Cathartesaura)和黑头美洲鹫(Coragypsatratus)[23-25],关于高山兀鹫肠道微生物组的研究尚未见国外报道。本课题组在国家自然科学基金以及青海省自然科学基金的资助下,解析高山兀鹫肠道微生物组结构,探究高山兀鹫肠道微生物组功能,挖掘高山兀鹫肠道益生菌种资源,以期为高山兀鹫腐食适应性机制研究增添肠道微生物组学层面的新内容。本研究对高山兀鹫新鲜粪便中的微生物进行分离与鉴定,并对获得的菌种进行耐药性检测,这可为进一步研究高山兀鹫肠道微生物的耐药机制提供依据,有助于增添对高山兀鹫生理生态的新认知。
1 材料与方法
1.1 材料
1.1.1 样本采集
本研究在青海省海南藏族自治州兴海县境内(99.922 15°E,35.835 51°N,海拔3 751 m)采集到野生高山兀鹫新鲜粪便。将采集的新鲜粪便样本放入车载冰箱中运回实验室立即处理。
1.1.2 主要仪器
SW-CJ-1FD无菌超净台、Whitley A35厌氧培养工作站、KG-SX-500高压灭菌锅、NRY-2102C恒温培养箱与摇床、ProFlex PCR仪。
1.1.3 主要试剂和培养基
细菌基因组DNA提取试剂盒、2×TaqPCR Master Mix以及DL2000 marker(均购自宝日医生物技术(北京)有限公司)。LB琼脂、LB肉汤、MRS琼脂以及MRS肉汤(均购自青岛高科技工业园海博生物技术有限公司)。
1.1.4 药敏纸片
本研究共使用34种药敏纸片(均购自上海源叶生物科技有限公司)。药敏纸片上分别含有抗生素四环素、复方新诺明、氧氟沙星、新霉素、多粘菌素B、头孢拉定、拉氧头孢钠、苯唑西林、氨曲南、哌拉西林、厄他培南、制霉菌素、诺氟沙星、红霉素、氨苄青霉素、头孢唑林、头孢西丁、头孢呋辛、丁胺卡那、环丙氟哌酸、甲氧苄胺嘧啶、克拉霉素、头孢他啶、左氧氟沙星、吉他霉素、头孢曲松、阿莫西林、强力霉素、林可霉素、克林霉素、妥布霉素、阿奇霉素、青霉素G和链霉素。
1.2 方法
1.2.1 细菌分离与纯化
在无菌条件下,将高山兀鹫粪便样本,放入1 mL无菌水中,3 000 r/min离心5 min。取悬液100 μL,在无菌水中进行10倍梯度稀释,制成10-1至10-9梯度稀释液。分别吸取其中的10-1,10-3,10-5,10-7,10-9稀释液涂布在LB琼脂和MRS琼脂培养基上。分别在有氧以及厌氧培养工作站中,37℃培养24—48 h。然后挑取表征(颜色、大小、形状)不同的单菌落于LB肉汤和MRS肉汤中,分别在有氧以及厌氧培养工作站中37℃培养12 h。再将相应LB肉汤和MRS肉汤中的菌液涂布至LB琼脂和MRS琼脂培养基中,分别在有氧以及厌氧培养工作站中进行第二轮纯化培养。如此反复,经过5轮纯化培养后,最终获取LB琼脂和MRS琼脂中能够在有氧以及无氧条件下生长的纯化的单菌落。
1.2.2 16S rRNA基因的扩增与鉴定
按照细菌基因组DNA提取试剂盒的操作步骤,提取上述纯化后的细菌总DNA,利用细菌的16S rRNA基因常用的扩增引物对(上游引物7F:5′-CAGAGTTTGATCCTGGCT-3′;下游引物1540R:5′-AGGAGGTGATCCAGCCGCA-3′,引物均由生工生物工程(上海)股份有限公司合成)进行PCR扩增。PCR反应体系为:2×TaqPCR Master Mix 25 μL,上下游引物各1 μL,模板DNA 2 μL,ddH2O 21 μL,总体积50 μL。PCR反应条件为:95℃ 5 min;95℃ 1 min,57℃ 1 min,72℃ 2 min,循环35次;72℃ 10 min。4℃保存。阳性对照,用实验室保存的大肠埃希氏菌(Escherichiacoli)菌株的DNA作为模板;阴性对照,用dd H2O作为模板。分别取7 μL上述PCR产物和DL2000 marker,用2%琼脂糖凝胶电泳进行检测,若检测结果中出现约1 500 bp的条带则为阳性。将上述PCR扩增阳性的产物送往生工生物工程(上海)股份有限公司进行测序。
将测序结果利用NCBI的BLAST程序进行序列相似性比对,找到同源性最高的序列,进而确定细菌的分类水平。然后,利用欧洲生物信息研究所(European Bioinformatics Institute,EBI)在线提供的多重序列比对工具Clustal Omega(https://www.ebi.ac.uk/Tools/msa/clustalo/),对每个种包含的多条测序序列进行多重序列比对,目的是剔除掉具有相同序列的测序结果。在此基础上,再将每一种细菌经多重序列比对后的最长序列作为代表性序列提交至NCBI的GenBank数据库。同属细菌16S rRNA基因的相似性为97%—99%;相似性小于97%的为潜在新菌种;同种不同株的相似性大于99%[26]。运用MEGA X软件[27],以maximum composite likelihood模型计算遗传距离,采用邻接法(neighbor-joining,NJ)对测序获得的16S rRNA基因序列构建系统进化树[28],Bootstrap自展1 000次检验进化树拓扑结构置信区间,以痰液弯曲菌(Campylobactersputorumstrain ATCC 33709)为外类群。
1.2.3 生化鉴定
挑取纯培养的单菌落到生理盐水管中,调节麦氏度为0.5,吸取0.5 mL菌液接种于细菌生理生化鉴定管(杭州微生物试剂有限公司)中,放入培养箱37℃培养24—38 h,判定结果。判定依据为《常见细菌系统鉴定手册》[29]。
1.2.4 药敏试验
采用药敏纸片琼脂扩散法(K-B法),将麦氏度为0.5的菌液均匀涂在琼脂培养基上,贴上34种药敏纸片,每一种类的药敏纸片贴3片作为重复。将贴有药敏纸片的培养基,放入培养箱中37℃培养16 h后测量抑菌圈直径,并依据抗菌药物敏感性试验的技术要求(WS/T 639-2018)判定结果[30-31]。以大肠埃希氏菌ATCC25922为质控菌株,若质控菌株的药物敏感度正常,则药敏试验的结果可靠。
2 结果
2.1 细菌分离与纯化
分别利用LB和MRS培养基,在有氧以及厌氧条件下,对高山兀鹫粪便样本中的微生物进行分离与纯化。经过5轮纯化后,根据单克隆形状、颜色和大小的不同,最终挑选119个单克隆。其中包括:MRS培养基(有氧条件)挑选42个单克隆,MRS培养基(无氧条件)挑选15个单克隆,LB培养基(有氧条件)挑选30个单克隆,LB培养基(无氧条件)挑选32个单克隆。
2.2 16S rRNA鉴定结果
对上述119个单克隆菌株提取基因组DNA,PCR扩增16S rRNA基因后,用2%琼脂糖凝胶电泳对扩增产物进行检测。所有扩增产物均检测到电泳条带,且大小在1 500 bp左右,与预期大小相符,可用于后续的一代测序。所有119个单克隆菌株的16S rRNA基因测序全部成功。将所有测序结果利用NCBI的BLAST程序进行序列相似性比对,发现119个单克隆菌株隶属于6个属、8个种,分别是大肠埃希氏菌、藤黄微球菌(Micrococcusluteus)、奥斯陆莫拉氏菌(Moraxellaosloensis)、蜡样芽孢杆菌(Bacilluscereus)、索氏类梭菌(Paeniclostridiumsordellii,以前称为Clostridiumsordellii)以及肠球菌属(Enterococcus)的3个种,蒙氏肠球菌(Enterococcusmundtii)、海氏肠球菌(Enterococcushirae)与耐久肠球菌(Enterococcusdurans)。上述每一个种仅将最长的序列作为代表序列提交至NCBI的GenBank数据库并获得登录号。上述8种细菌的登录号分别为MT740347、MT740350、MT740351、MT740352、MT740353、MT740354、MT740355、MT7 40378。最后,用上述8个种的最长序列构建系统进化树(图1)。
2.3 分离菌的生化鉴定
对上述分离到的8种细菌进行生化鉴定,生化鉴定结果见表1。表1中的8种细菌的生化鉴定结果与各自16S rRNA鉴定结果保持一致。

表1 分离菌株生化鉴定结果

续表1
2.4 分离菌的药敏试验
对上述8个种的代表性菌株进行34种抗生素的药敏试验。结果显示(表2):大肠埃希氏菌对头孢拉定、苯唑西林、制霉菌素、红霉素、吉他霉素、阿莫西林、林可霉素、克林霉素以及青霉素G耐药。藤黄微球菌对复方新诺明、苯唑西林、氨曲南、制霉菌素、氨苄青霉素、头孢唑林、头孢呋辛、甲氧苄胺嘧啶、头孢曲松、阿莫西林、林可霉素以及青霉素G耐药。奥斯陆莫拉氏菌对复方新诺明、苯唑西林、制霉菌素、甲氧苄胺嘧啶、头孢曲松、阿莫西林、林可霉素以及克林霉素耐药。蜡样芽孢杆菌对复方新诺明、多粘菌素B、苯唑西林、氨曲南、制霉菌素、氨苄青霉素、头孢呋辛、甲氧苄胺嘧啶、头孢他啶、头孢曲松、阿莫西林以及林可霉素耐药。索氏类梭菌对复方新诺明、新霉素、制霉菌素、丁胺卡那、甲氧苄胺嘧啶、林可霉素、妥布霉素以及链霉素耐药。蒙氏肠球菌对复方新诺明、新霉素、氨曲南、制霉菌素、丁胺卡那、头孢他啶、林可霉素、克林霉素、妥布霉素以及链霉素耐药。海氏肠球菌对复方新诺明、新霉素、多粘菌素B、头孢拉定、苯唑西林、氨曲南、制霉菌素、头孢呋辛、丁胺卡那、甲氧苄胺嘧啶、头孢他啶、阿莫西林、林可霉素、克林霉素、妥布霉素以及链霉素耐药。耐久肠球菌对四环素、复方新诺明、新霉素、多粘菌素B、头孢拉定、拉氧头孢钠、苯唑西林、氨曲南、厄他培南、制霉菌素、红霉素、头孢唑林、头孢西丁、头孢呋辛、丁胺卡那、甲氧苄胺嘧啶、克拉霉素、头孢他啶、吉他霉素、头孢曲松、阿莫西林、林可霉素、克林霉素、妥布霉素、阿奇霉素以及链霉素耐药。进一步分析发现,这8种代表性菌株对8到26种不等的抗生素表现出耐药性。其中,耐久肠球菌可耐受高达26种之多的抗生素。奥斯陆莫拉氏菌、索氏类梭菌以及大肠埃希氏菌可耐受的抗生素种类较少。从抗生素抑制细菌的角度进行分析,发现本研究中34种抗生素能够抑制的代表性菌株的种类数量在0到8种不等。其中,氧氟沙星、哌拉西林、诺氟沙星、环丙氟哌酸、左氧氟沙星以及强力霉素能够抑制本研究中分离到的所有8种代表性菌株。而制霉菌素以及林可霉素对所有分离到的8种代表性菌株均无抑制作用。
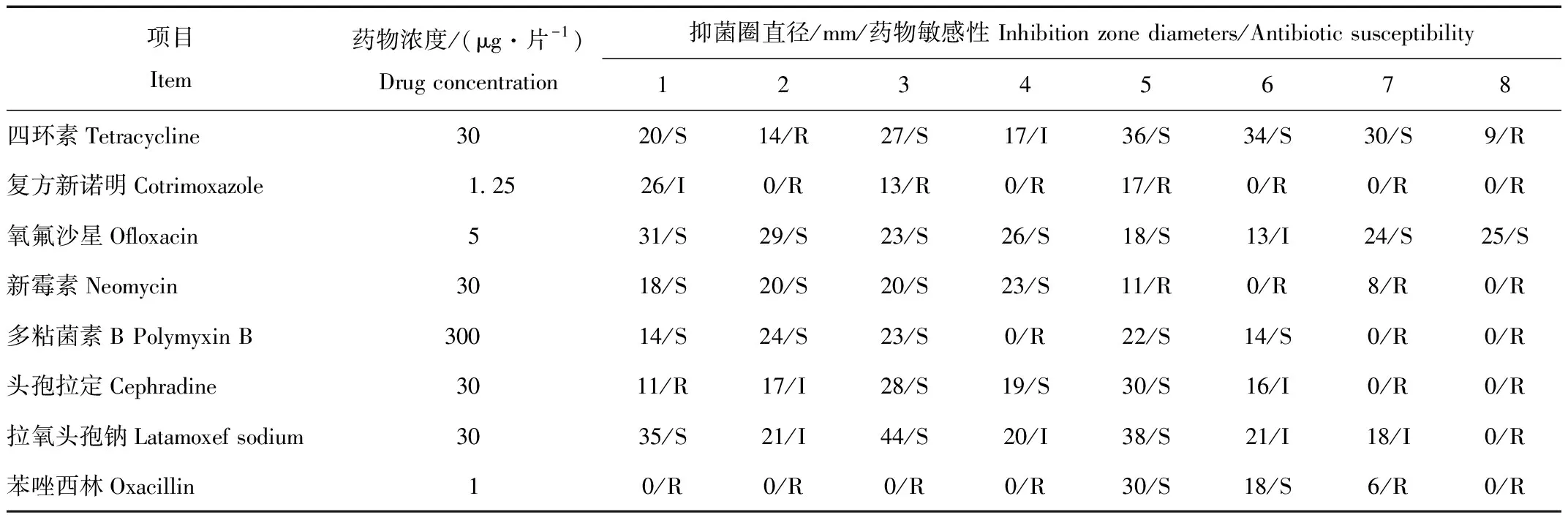
表2 分离菌株药敏试验结果

续表2
3 讨论
高山兀鹫作为食腐鸟类的典型代表,其腐食适应性机制的研究一直备受关注。2014年,丹麦的Roggenbuck等[23]首次从肠道微生物组的角度对比分析了黑头美洲鹫和红头美洲鹫的肠道宏基因组,进而从区别于全基因组测序的另一角度,即肠道微生物组的角度,阐释鹫类腐食适应性机制[24-25]。目前研究认为,肠道微生物与宿主在协同进化过程中[32],与宿主的免疫系统相互调控[33]。肠道微生物一方面促进免疫系统成熟,另一方面辅助宿主抵抗病原菌的侵袭[34]。基于此,本研究在课题组对高山兀鹫肠道微生物组进行高通量测序(数据未发表)的基础上,对高山兀鹫肠道微生物进行分离、培养与鉴定。共分离到119株细菌。进一步根据16S rRNA以及生化鉴定结果,鉴定出8种细菌,隶属于6个属。基于菌株16S rDNA序列的系统进化树显示,6个属形成了6个大的分枝。肠球菌属的3个种形成3个小的分枝。这些系统进化关系分析结果为菌株的后续研究提供了背景资料。此外,这些菌株在GenBank中获得的序列号为菌株作了生物标记,可进一步为菌株的后续产权保护提供依据。8种细菌中,大肠埃希氏菌、奥斯陆莫拉氏菌以及索氏类梭菌是重要的条件致病菌。这也提示我们,高山兀鹫因为独特的食腐习性,容易遭受到病原菌的侵袭。叶妍琳等[35]采集昆明动物园发病死亡秃鹫的心脏、肝脏病灶进行细菌分离鉴定,发现病原菌为黏质沙雷氏菌(Serratiamarcescens)和大肠埃希氏菌。作为条件致病菌,当动物体免疫力下降时,大肠埃希氏菌引发宿主出现严重腹泻和败血症,是危害养禽业以及畜牧业的重要病原菌[36]。有研究表明奥斯陆莫拉氏菌可以导致败血症、脑膜炎、肺炎以及泌尿生殖系统感染[37]。在国内,研究人员从鸭、火鸡、奶牛以及家猪等家禽家畜体内均分离到致病性奥斯陆莫拉氏菌[38]。索氏类梭菌是一种厌氧孢子生成菌,其毒力菌株可在人类中引起水肿、坏疽、低血压和全身中毒性休克,死亡率约为70%[39-40]。这些病原菌与高山兀鹫的相处之道是什么以及这些病原菌随高山兀鹫粪便排出体外后对环境以及环境中其他野生动物的影响,都是值得深入研究的问题。
与上述3种条件致病菌相区别的是,本研究中分离到的其余5种肠道微生物则是具有潜在益生功能的细菌。藤黄微球菌在正常机体中会被吞噬细胞的溶菌酶杀灭[41],因此,多数不致病,少数菌株为条件致病菌[42]。此外,作为细菌型腐乳生产的典型代表菌株,藤黄微球菌在腐乳的生产加工与应用等方面发挥着重要作用[43]。有研究表明藤黄微球菌还可作为潜在益生菌用于尼罗罗非鱼(Oreochromisniloticus)的生产养殖[44]。蜡样芽孢杆菌是国内外常用于畜禽生产上的益生菌之一,张娇等[45]研究发现蜡样芽孢杆菌具有促进肉鸡生长,增强肠道消化酶活性以及促进免疫器官发育等功效。肠球菌属属于乳酸菌(lactic acid bacteria,LAB),目前作为益生菌的研究热点,多种肠球菌菌株已经被广泛应用于各种药物、发酵食品以及微生态制剂[46]。本研究发现的3种肠球菌,蒙氏肠球菌[47]、海氏肠球菌[48-49]以及耐久肠球菌[50],分别都有益生功效的研究。这些潜在益生菌在高山兀鹫食腐食性中的作用是值得深入研究的问题。尤其是这些潜在益生菌能否发挥辅助高山兀鹫消化腐食以及抑制腐食中病原菌的功能,是未来研究的重要内容。
对本研究中分离的菌株进行药敏试验,结果显示,这些菌株对8到26种不等的抗生素表现出耐药性。当细菌长期处于含抗生素的生存环境时,在选择压力下,敏感菌株被抑制或杀灭,而天然耐药或获得性耐药菌株则继续生存、繁殖和克隆传播,进一步导致细菌的耐药性不断增高[51-52]。这些存在于高山兀鹫肠道内的耐药菌株,很可能来自腐食,尤其是家养动物的腐尸。青藏高原地区高山兀鹫的食物主要包括,家牦牛、藏羊、马、驴、狗等5种家养动物和野牦牛(Bosgrunniens)、藏野驴(Equuskiang)、藏羚羊(Pantholopshodgsoni)等3种野生动物,以及人类尸体(来源于藏族人民传统丧葬文化中的天葬)[4]。兽药的使用可能导致家养动物本身的细菌产生耐药性[53-54],进一步通过腐食食物链传递给高山兀鹫等食腐动物。兽药研制过程中,会着重考虑药物对牲畜及人体的影响,而对以腐为食的鹫类等鸟类的影响则缺乏深入的考量与研究。尤其是在死亡家牦牛及藏羊构成高山兀鹫主要食物来源的青藏高原地区,该类研究极度缺乏。一方面,我们不清楚哪些药物被广泛用于青藏高原地区的畜牧业养殖中;另一方面,这些药物是否已经在家牦牛及藏羊体内形成了残留;最后,这些药物残留是否已经富集到高山兀鹫等食腐鸟类体内,最终对高山兀鹫等食腐鸟类的生理及种群状况构成威胁。积累药物残留对食腐鸟类定性与定量影响的数据,进而反馈到药物研发环节,最终实现药物的生理安全与生态安全共赢,这些都是需要进行深入系统研究的问题。本研究选用的34种抗生素,增加了对高山兀鹫菌株耐药性的新认识,对其保护具有重要意义。
