泛素结合酶UBE2T基因在布鲁氏菌感染过程中的作用
2021-05-06印双红张俊波蔡春连王丽蓉陆安法陈创夫
印双红,张俊波,易 萌,蔡春连,张 红,王丽蓉,陆安法,陈创夫
(1 铜仁学院 a大健康学院,b 贵州省梵净山地区生物多样性保护与利用重点实验室,c 农林工程与规划学院,贵州 铜仁 554300;2 铜仁市动物疫病预防控制中心,贵州 铜仁 554300;3 石河子大学 动物科技学院,新疆 石河子 832000)
布鲁氏菌病是一种在全世界范围内广泛分布的人畜共患传染病[1],家畜患病可引起生殖系统疾病,常引起流产、不孕、空怀等;人感染布鲁氏菌后可引发关节炎、脑膜炎、心肌膜炎等,表现为持续性感染。目前,人们对布鲁氏菌的致病机制还不清楚。
泛素(ubiquitin,Ub)是一种蛋白质,广泛存在于真核细胞中,由76个氨基酸构成,分子质量较小,而且氨基酸序列高度保守,从酵母细胞到人类只相差3个氨基酸[2]。泛素化修饰是蛋白质翻译后修饰的重要形式,泛素化过程需要泛素激活酶(ubiquitin activation enzyme,E1)、泛素结合酶(ubiquitin conjugation enzyme,E2)和泛素连接酶(ubiquitin protein ligase,E3)3种酶的参与,其中泛素结合酶E2T(ubiquitin-conjugating enzyme e2t,UBE2T)是E2家族成员之一,其有一个16~18 ku的保守结构域(泛素结合结构域),延伸序列在C末端,属泛素家族中的第二类结合酶[3]。大量研究证明,细胞内UBE2T表达增高在肿瘤的发生、发展中起重要作用,与乳腺癌[4]、肝癌[5]、骨髓癌[6]及肺癌[7]等的发生发展关系密切。
泛素蛋白酶体系统(Ubiquitin-proteasomesystem,UPS)被有些病毒利用,参与病毒感染、增殖、释放与免疫逃逸等各个阶段[8-9],例如羊口疮病毒可利用某种机制干预UPS的信号调控途径,有效抑制胞内信号传导和CD8+T细胞活化,以庇护病毒粒子成熟和释放[10]。
E2在胞内菌李氏特菌的增殖中起着重要的调节作用[11],本课题组前期研究表明,类泛素SUMO-1 影响胞内布鲁氏菌的增殖[12],由于E2在类泛素SUMO-1修饰中发挥重要作用,因此笔者推测E2在布鲁氏菌增殖过程中也发挥着重要作用。本研究以UBE2T为研究对象,对其进行沉默和过表达,研究UBE2T在布鲁氏菌感染过程中的作用,旨在为布鲁氏菌的致病机制研究提供参考。
1 材料与方法
1.1 材 料
胎牛血清和Opti-MEM细胞培养液,购自GIBCO公司;酵母提取物和蛋白胨,购自上海生工生物工程技术服务有限公司;曲拉通X-100(TritonX-100)细胞裂解液、小鼠白细胞介素6(IL-6)、白细胞介素18(IL-18)、γ-干扰素(IFN-γ)和白细胞介素-1β(IL-1β) ELISA试剂盒,均购自上海依科赛生物制品有限公司;SYBR Green Ⅰ荧光染料,购于罗氏公司;半胱氨酸天冬氨酸蛋白水解酶3(Caspase-3)活性检测试剂盒和乳酸脱氢酶(LDH)活性检测试剂盒,购自碧云天生物技术公司;小鼠巨噬细胞RAW264.7,购于北纳生物科技有限公司;转染试剂Lipofectamine RNAiMAX、Lipofectamine 2000和总RNA提取试剂Trizol,购自Invitrogen公司。
羊种布鲁氏菌疫苗株M5-90,由新疆地方与民族高发病教育部重点实验室提供;pLVX-puro载体和大肠杆菌DH5α,由梵净山特色动植物资源重点实验室保存。
1.2 UBE2T基因过表达RAW264.7细胞的构建
1.2.1 过表达载体pLVX-puro-UBE2T的构建 通过NCBI获得小鼠UBE2T基因序列(GenBank登录号:NM_026024.3),引入EcoR Ⅰ/BamH Ⅰ酶切位点,送通用生物系统(安徽)有限公司合成基因片段。将合成的UBE2T基因片段与pLVX-puro载体进行连接(16 ℃连接过夜),构建UBE2T基因过表达质粒pLVX-puro-UBE2T。将pLVX-puro-UBE2T转化到大肠杆菌DH5α感受态细胞中,37 ℃摇床培养1~2 h,8 000 r/min离心2 min,弃上清,沉淀均匀涂布于氨苄青霉素(Ampr)抗性平板(Ampr含量100 g/mL),于37 ℃培养过夜。提取质粒pLVX-puro-UBE2T,进行PCR和EcoR Ⅰ/BamH Ⅰ双酶切验证。
设计pLVX-puro载体和pLVX-puro-UBE2T的共同检测引物:F.5′-CACGCTGTTTTGACCTCCAT-3′,R.5′-GGATGTGGAATGTGTGCG-AG-3′。质粒pLVX-puro和pLVX-puro-UBE2T PCR验证反应体系为20 μL:2×ESTaqMasterMix 10.0 μL,pLVX-puro-UBE2T或pLVX-puro 1.0 μL,上下游引物各1.0 μL,ddH2O 7.0 μL。PCR反应条件: 94 ℃ 5 min;95 ℃ 30 s,55 ℃ 40 s,72 ℃ 40 s,循环30次;72 ℃ 7 min。反应结束后,取二者PCR产物进行1%琼脂糖凝胶电泳分析。质粒pLVX-puro-UBE2TEcoR Ⅰ/BamH Ⅰ双酶切验证体系为40 μL:EcoR Ⅰ限制性内切酶2.0 μL,BamH Ⅰ限制性内切酶2.0 μL,重组质粒pLVX-puro-UBE2T 20.0 μL,10×H Buffer 4.0 μL和ddH2O 12.0 μL。反应结束后,取酶切产物进行1%琼脂糖凝胶电泳分析。
1.2.2 过表达效果的检测 用6孔板培养小鼠巨噬细胞RAW264.7(培养基为含体积分数10%胎牛血清的Opti-MEM),1 mL/孔,待密度为1×106mL-1时,更换培养基为不含血清的Opti-MEM培养基(1 mL/孔),将细胞分为PBS对照组、pLVX-puro空质粒组和pLVX-puro-UBE2T过表达质粒组。取2支灭菌的EP管,一管加入10 μL Lipofectamine 2000和240 μL Opti-MEM;另一管加入15 μL质粒(pLVX-puro或pLVX-puro-UBE2T)或PBS(PBS对照组)和235 μL Opti-MEM,混匀后室温孵育5 min。将上述2个EP管中的液体混合并混匀,室温孵育15 min。将上述混合液全部加入各组细胞的6孔板内,放回培养箱培养;4 h后在6孔板中加入含体积分数20%胎牛血清的Opti-MEM培养基(2 mL/孔),继续培养48 h后收集细胞,用Trizol一步法提取细胞总RNA,反转录合成cDNA,利用实时荧光定量PCR(qRT-PCR)检测UBE2T基因过表达效果。从NCBI网站GenBank上查找UBE2T和内参甘油醛-3-磷酸脱氢酶(GAPDH)基因序列(GenBank登录号分别为NM_026024.3和NM_008084.3),采用Primer Premier 5.0软件设计特异性引物(表1),引物由上海生工生物工程技术服务有限公司合成。以GAPDH为内参,在罗氏LightCycler 480实时荧光定量PCR仪上进行qRT-PCR,反应体系为:2×SYBR Green Master Mix 10 μL,cDNA模板2 μL,上、下游引物各1 μL,双蒸水6 μL。PCR反应条件:95 ℃ 5 min;95 ℃ 15 s,58 ℃(UBE2T)或60 ℃(GAPDH) 30 s,72 ℃ 30 s,40个循环;72 ℃ 7 min。试验设以PBS处理的RAW264.7细胞为对照。每组细胞3个重复,采用2-ΔΔCt法进行相对表达量分析。

表1 UBE2T和GAPDH的qRT-PCR引物Table 1 Primers of qRT-PCR of UBE2T and GAPDH
1.3 UBE2T沉默表达RAW264.7细胞的构建
1.3.1 小干扰RNA(siRNA)的设计 依据siRNA的设计原则,由上海吉玛制药技术有限公司针对UBE2T基因序列设计3对阳性siRNA片段(UBE2T-379-siRNA、UBE2T-599-siRNA、UBE2T-661-siRNA)和1对阴性siRNA片段(表2)。
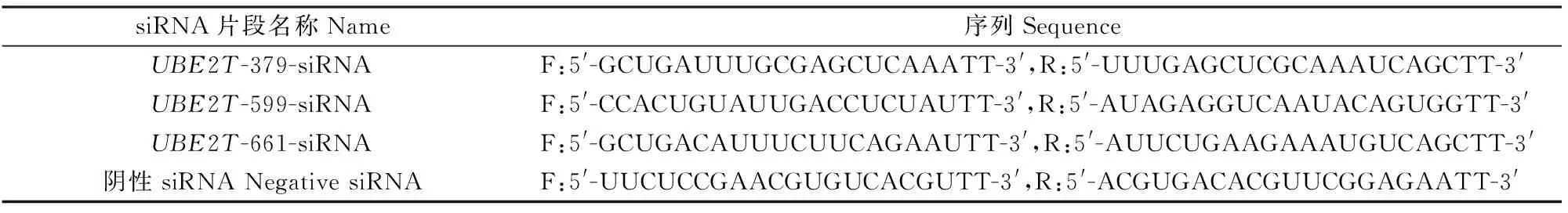
表2 UBE2T siRNA序列Table 2 Sequences of UBE2T siRNA
1.3.2 沉默表达效果的检测 用六孔板培养小鼠巨噬细胞RAW264.7(培养基为含体积分数10%胎牛血清的Opti-MEM),1 mL/孔,待密度为1×106mL-1时,更换培养基为不含血清的Opti-MEM培养基(1 mL/孔),将细胞分为PBS对照组、阴性siRNA组、UBE2T-379-siRNA干扰组、UBE2T-599-siRNA干扰组和UBE2T-661-siRNA干扰组。取2支灭菌的EP管,每管分别加125 μL Opti-MEM,然后一管加入7 μL Lipofectamine RNAiMAX,另一管加入12.5 μL siRNA(UBE2T-379-siRNA、UBE2T-599-siRNA、UBE2T-661-siRNA或阴性siRNA)或PBS(PBS对照组),混匀后室温孵育5 min。将上述2个EP管中的液体混合并混匀,室温孵育15 min。将上述混合液全部加入各组细胞的六孔板内,放回培养箱培养,4 h后在6孔板中加入含体积分数20%胎牛血清的Opti-MEM培养基(2 mL/孔);继续培养48 h后,以GAPDH为内参,利用qRT-PCR检测UBE2T基因沉默表达效果,具体试验方法同1.2.2节。
1.4 UBE2T沉默或过表达对RAW264.7细胞活性的影响
采用四甲基偶氮唑盐(MTT)试验检测,将UBE2T-661-siRNA和pLVX-puro-UBE2T质粒分别转染RAW264.7细胞,培养细胞至对数生长期,用2.5 g/L胰蛋白酶消化细胞,用含体积分数10%胎牛血清的Opti-MEM培养基配成单个细胞悬液,以每孔103~104个细胞的量接种于96孔培养板中,每孔总体积为200 μL,边缘孔用无菌的PBS填充。弃去上清,每孔加入150 μL DMSO溶液,置摇床上低速振荡10 min,使结晶充分溶解,在酶联免疫检测仪490 nm处测量各孔的吸光值,具体操作见说明书。试验设正常培养的RAW264.7细胞为对照,重复3次。
1.5 羊种布鲁氏菌M5-90感染对相关基因表达的影响
采用qRT-PCR法,检测M5-90感染对RAW264.7细胞UBE2T基因相对表达量的影响,以及对过表达或沉默表达UBE2T基因的RAW264.7细胞中含pyrin结构域NOD样受体家族3(NLRP3)和半胱氨酸天冬氨酸蛋白水解酶1(Caspase-1)基因相对表达量的影响。从NCBI网站GenBank上查找NLRP3和Caspase-1基因序列(GenBank登录号分别为NM_145827.4和NM_009807.2),采用Primer Premier 5.0软件设计特异性引物(表3),UBE2T和GAPDH的引物相关信息见表1,引物由上海生工生物工程技术服务有限公司合成。

表3 NLRP3和Caspase-1的qRT-PCR引物Table 3 Primers of qRT-PCR of NLRP3 and Caspase-1
取RAW264.7细胞,用羊种布鲁氏菌M5-90感染(感染复数(MOI)为100),于感染后4,8,12和24 h后收集细胞,用Trizol一步法提取细胞总RNA,反转录合成cDNA。以GAPDH为内参,在罗氏LightCycler 480实时荧光定量PCR仪上对各时间点UBE2T的表达水平进行qRT-PCR检测,具体方法见1.2.2节。试验设以PBS处理的RAW264.7细胞为对照。
取转染pLVX-puro-UBE2T和UBE2T-661-siRNA的RAW264.7细胞,用羊种布鲁氏菌M5-90感染(MOI为100),于感染后24 h收集细胞,用Trizol一步法提取细胞总RNA,反转录合成cDNA。以GAPDH为内参,在罗氏LightCycler 480实时荧光定量PCR仪上对NLRP3和Caspase-1表达水平进行qRT-PCR检测,具体方法同1.2.2节。同时设正常RAW264.7细胞及转染pLVX-puro空质粒、阴性siRNA、PBS处理的RAW264.7细胞为对照。
1.6 UBE2T沉默或过表达对细胞内布鲁氏菌增殖的影响
取1.5中M5-90感染的5组细胞,37 ℃共孵育1.5 h后,PBS洗除未感染的胞外细菌,添加含有50 μg/mL庆大霉素的DMEM培养基以杀死胞外菌,PBS漂洗,更换无抗生素的细胞培养液,孵育4,8,12和24 h时用体积分数0.2%的TritonX-100裂解细胞,室温放置12 min以释放胞内菌,对裂解液倍比稀释,涂布固体平板,进行活菌计数,结果以活菌数的常用对数表示。试验重复3次。
1.7 UBE2T沉默或过表达对LDH、Caspase-3活性及相关细胞因子的影响
取1.5中M5-90感染24 h的5组细胞,按照试剂盒说明书检测LDH水平、Caspase-3活性,利用ELISA方法检测IL-6、IL-18、IL-1β和IFN-γ等细胞因子的水平。试验重复3次。
1.8 数据统计分析
试验所得数据均利用SPSS 17.0统计软件进行单因素方差分析(one-way ANOVA),结果以“平均值(Means)±标准差(SD)”表示。
2 结果与分析
2.1 过表达载体pLVX-puro-UBE2T构建及表达效果的验证
2.1.1 pLVX-puro-UBE2T的构建 由图1可知,PCR获得254 bp的pLVX-puro片段和881 bp的pLVX-puro-UBE2T片段,与预期结果相符。由图2可知,pLVX-puro-UBE2T经EcoRⅠ/BamH Ⅰ双酶切后获得627 bp的目的基因条带,片段长度与预期结果相符。PCR和EcoR Ⅰ/BamH Ⅰ双酶切结果表明,pLVX-puro-UBE2T构建成功。

M.DL2000 DNA Marker;1.pLVX-puro PCR产物;2.pLVX-puro-UBE2T PCR产物M.DL2000 DNA Marker;1.Products of pLVX-puro by PCR;2.Products of pLVX-puro-UBE2T by PCR图1 重组载体pLVX-puro-UBE2T的PCR验证Fig.1 PCR verification of recombinant plasmid pLVX-puro-UBE2T
2.1.2 过表达效果的检测 由图3可知,pLVX-puro-UBE2T质粒转染组UBE2T的表达量极显著高于PBS对照组(P<0.01);UBE2T在空质粒组pLVX-puro中的表达量与PBS对照组相似。结果表明,pLVX-puro-UBE2T质粒可过表达UBE2T。
2.2 siRNA干扰UBE2T基因表达效果的验证
由图4可知,UBE2T-379-siRNA、UBE2T-599-siRNA和UBE2T-661-siRNA干扰组UBE2TmRNA的相对表达量均极显著低于PBS对照组(P<0.01),干扰效率分别为58%,62%和84%。结果表明,UBE2T的最佳干扰片段为UBE2T-661-siRNA。

1.PBS对照组;2.pLVX-puro空质粒组;3.pLVX-puro-UBE2T过表达质粒组。与PBS对照组相比,图柱上标*表示差异显著(P<0.05),标**表示差异极显著(P<0.01),下图同1.PBS control group;2.pLVX-puro empty plasmid group;3.pLVX-puro-UBE2T overexpression plasmid group.Compared with the PBS control group,*represents significant difference at P<0.05,and ** represents significant difference at P<0.01.The same below图3 UBE2T过表达效果的检测Fig.3 Effects of overexpression of UBE2T gene
2.3 沉默和过表达UBE2T基因对RAW264.7细胞活性的影响
由图5可知,UBE2T-661-siRNA干扰组、pLVX-puro-UBE2T过表达质粒组RAW264.7细胞与正常细胞相比活性均在90%以上,表明沉默或过表达UBE2T基因均不影响巨噬细胞的活性,可以进行后续试验。
2.4 布鲁氏菌感染对UBE2T、NLRP3和Caspase-1基因相对表达量的影响
由图6可知,在8,12 和24 h,M5-90感染组RAW264.7细胞UBE2TmRNA的相对表达量均极显著高于对照组(P<0.01),表明M5-90感染可提高细胞UBE2T的表达量。
由图7可知,与PBS对照组细胞相比,pLVX-puro-UBE2T过表达组细胞NLRP3的表达量显著降低(P<0.05),而Caspase-1的表达量显著升高(P<0.05);UBE2T-661-siRNA干扰组细胞的NLRP3表达量极显著升高(P<0.01),Caspase-1表达量显著升高(P<0.05)。pLVX-puro空质粒组与阴性siRNA对照组细胞的NLRP3和Caspase-1表达量均无明显变化。结果表明,沉默UBE2T提高了M5-90介导的NLRP3和Caspase-1的表达,而过表达UBE2T抑制M5-90介导的NLRP3表达,提高M5-90介导的Caspase-1表达。

1.正常细胞对照组;2.PBS对照组;3.pLVX-puro空质粒对照组;4.pLVX-puro-UBE2T过表达质粒组;5.阴性siRNA对照组;6.UBE2T-661-siRNA干扰组1.Normal cell group;2.PBS control group;3.pLVX-puro empty overexpression control plasmid group;4.pLVX-puro-UBE2T overexpression plasmid group;5.Negative siRNA control group;6.UBE2T-661-siRNA interference group图7 M5-90感染对沉默或过表达UBE2T基因的RAW264.7细胞中NLRP3和Caspase-1基因相对表达量的影响Fig.7 Effects of overexpression and silence of UBE2T gene on relative expression levels of NLRP3 and Caspase-1 genes of RAW264.7 cells infected with M5-90
2.5 沉默和过表达UBE2T基因对胞内布鲁氏菌增殖的影响
由图8可知,在12和24 h,转染UBE2T-661-siRNA片段的RAW264.7细胞内M5-90数量显著低于PBS对照组(P<0.05);在所有观察时间点,转染pLVX-puro-UBE2T质粒的RAW264.7细胞内M5-90数量显著高于PBS对照组(P<0.05)。结果表明,沉默UBE2T可抑制胞内M5-90的增殖,而过表达UBE2T可促进胞内M5-90的增殖。
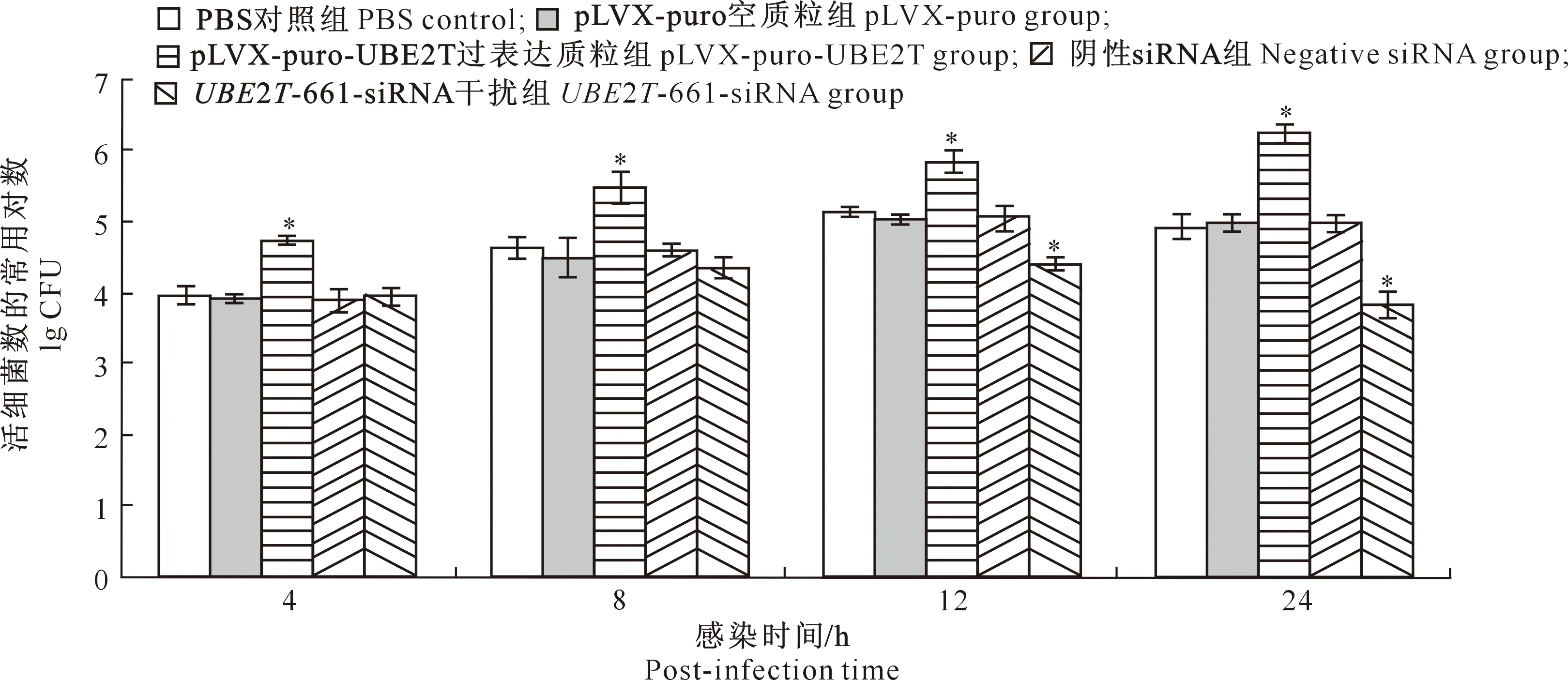
图8 沉默或过表达UBE2T对RAW264.7细胞内布鲁氏菌增殖的影响Fig.8 Effects of overexpression and silence of UBE2T gene on intracellular replication of Brucella in RAW264.7 cells
2.6 沉默和过表达UBE2T基因对M5-90感染细胞的LDH、Caspase-3水平及IL细胞因子的影响
2.6.1 LDH水平 由图9可知,与PBS对照组相比,pLVX-puro-UBE2T质粒组RAW264.7细胞的LDH水平极显著升高(P<0.01),UBE2T-661-siRNA干扰组RAW264.7细胞的LDH水平显著降低(P<0.05)。pLVX-puro空质粒组与阴性siRNA组细胞的LDH水平均无明显变化。结果表明,沉默UBE2T可抑制M5-90介导的LDH水平,而过表达UBE2T可提高M5-90介导的LDH水平。

1.PBS对照组;2.pLVX-puro空质粒组;3.pLVX-puro-UBE2T过表达质粒组;4.阴性siRNA对照组;5.UBE2T-661-siRNA干扰组。下图同1.PBS control group;2.pLVX-puro empty plasmid group;3.pLVX-puro-UBE2T overexpression plasmid group;4.Negative siRNA control group;5.UBE2T-661-siRNA interference group.The same below图9 沉默和过表达UBE2T对M5-90感染的RAW264.7细胞LDH水平的影响Fig.9 Effects of overexpression and silence of UBE2T on LDH levels of RAW264.7 cells infected with M5-90
2.6.2Caspase-3活性 由图10可知,与PBS对照组相比,pLVX-puro-UBE2T质粒组RAW264.7细胞的Caspase-3活性显著降低(P<0.05),UBE2T-661-siRNA干扰组Caspase-3活性显著升高(P<0.05),pLVX-puro空质粒组与阴性siRNA组细胞的Caspase-3活性均无明显变化。结果表明,沉默UBE2T可提高M5-90介导的Caspase-3活性,而过表达UBE2T可抑制M5-90介导的Caspase-3活性。

图10 沉默和过表达UBE2T对M5-90感染的RAW264.7细胞Caspase-3活性的影响Fig.10 Effects of overexpression and silence of UBE2T on Caspase-3 activity of RAW264.7 cells infected with M5-90
2.6.3 IL细胞因子水平 由图11可知,与PBS对照组相比,pLVX-puro-UBE2T质粒组RAW264.7细胞的IL-18水平无明显变化,而IL-1β水平显著降低(P<0.05);UBE2T-661-siRNA干扰组IL-18水平无明显变化,而IL-1β水平显著升高(P<0.05);pLVX-puro空质粒组与阴性siRNA组细胞的IL-18和IL-1β水平均无明显变化。结果表明,沉默UBE2T可提高M5-90介导的IL-1β水平,而过表达UBE2T可抑制M5-90介导的IL-1β水平。
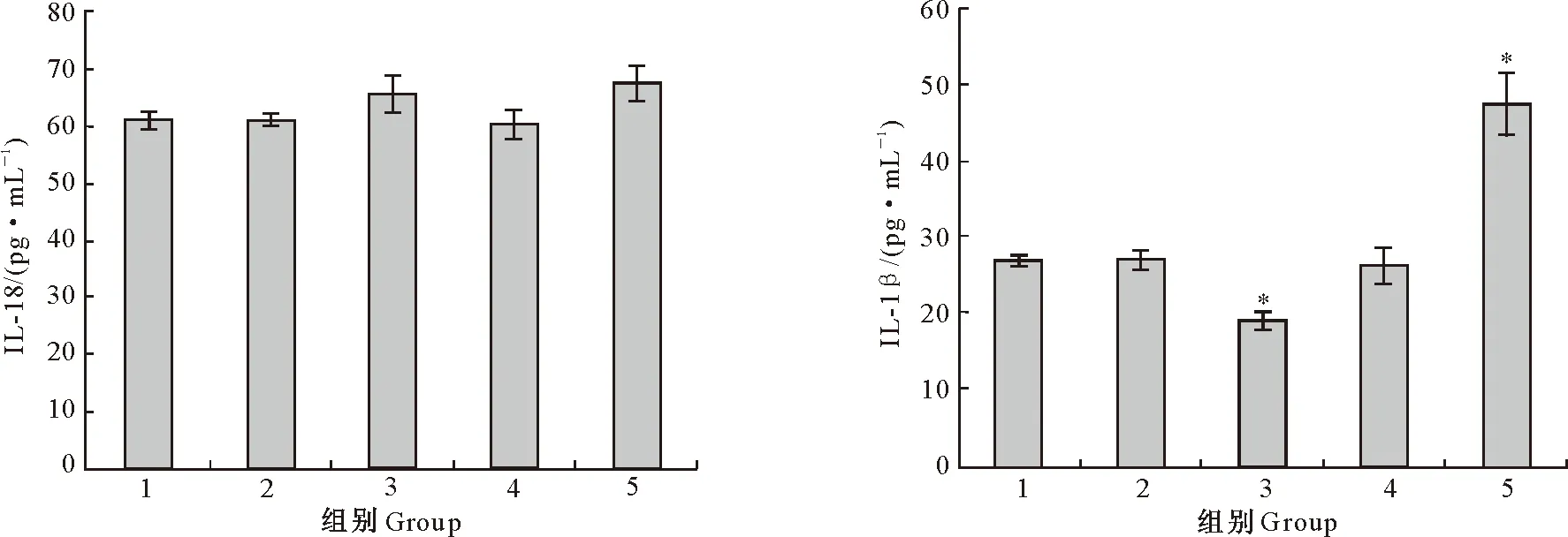
图11 沉默和过表达UBE2T对M5-90感染的RAW264.7细胞IL-18及IL-1β水平的影响Fig.11 Effects of overexpression and silence of UBE2T gene on levels of IL-18 and IL-1β of RAW264.7 cells infected with M5-90
由图12可知,与PBS对照组相比,pLVX-puro-UBE2T质粒组RAW264.7细胞的IFN-γ水平显著降低(P<0.05),而IL-6水平无明显变化;UBE2T-661-siRNA干扰组IFN-γ和IL-6水平均显著升高(P<0.05);pLVX-puro空质粒组与阴性siRNA组细胞的IFN-γ和IL-6水平均无明显变化。结果表明,沉默UBE2T可提高M5-90介导的IFN-γ和IL-6水平,而过表达UBE2T可抑制M5-90介导的IFN-γ水平。

图12 沉默和过表达UBE2T对M5-90感染的RAW264.7细胞IFN-γ及IL-6水平的影响Fig.12 Effects of overexpression and silence of UBE2T gene on levels of IFN-γ and IL-6 of RAW264.7 cells infected with M5-90
3 讨 论
非特异性免疫在抵御病原微生物早期感染过程中发挥着至关重要的作用,其中巨噬细胞和单核细胞均能快速识别入侵的病原菌,进而释放大量的促炎因子,引发炎症反应,但布鲁氏菌可利用巨噬细胞表面的特殊结构而逃避布鲁氏菌Toll样受体(Toll-like receptors,TLRs)的识别与补体第三组分(C3)的活化,因此不能激发强烈的非特异性免疫反应[13-15]。固有免疫系统模式识别受体共有4类,即TLR、NOD样受体(NLR)、凝集素样受体(CLR)和解旋酶样受体(RLR),其中TLR和NLR是识别病原微生物并诱导炎症的受体[16]。NLRP3炎症小体是识别配体并诱发慢性炎症反应的关键,NLRP3主要表达于嗜中性粒细胞、单核巨噬细胞和一些初级免疫细胞中,主要分布在细胞间质及细胞膜中[17]。存在于胞内的部分NLR激活后形成巨大的蛋白复合体“炎症小体”,激活Caspase-1,进而对IL-1β和IL-18等炎症因子的前体形式进行切割,使其成熟并释放至胞外,引起炎症反应。NLRP3炎性小体是迄今为止结构和功能最为明确的炎性小体,主要由NLRP3、ASC和Caspase-1共同组成[18-19]。本研究发现,沉默UBE2T表达可提高M5-90介导的IL-1β水平及NLRP3和Caspase-1基因的表达;过表达UBE2T可提高M5-90介导Caspase-1基因的表达,抑制IL-1β水平和NLRP3基因的表达。该结果表明,UBE2T可调控胞内布鲁氏菌介导的炎症反应。
目前,有关病毒感染与细胞泛素蛋白酶体系统(UPS)作用的相关研究较多,泛素能作为病毒的胞内目标,主要是由于其作为蛋白翻译后修饰者,普遍参与细胞周期[20]、胞吞作用[21]和DNA修复[22]等复杂的细胞过程。针对猪源布鲁氏菌胞内生存机制与UPS关系的研究表明,一方面猪源布鲁氏菌S2的感染促进了巨噬细胞泛素及蛋白酶体的表达;另一方面,泛素蛋白酶体系统功能的增强,显著降低了猪源布鲁氏菌S2的早期感染,但对于中后期感染作用不明显;而感染后期利用蛋白酶体抑制剂乳胞素(Lactacystin)抑制巨噬细胞蛋白酶体功能,却可显著降低猪源布鲁氏菌S2的胞内增殖能力[23],这种情况可能是因为泛素蛋白酶体功能的抑制在一定程度上促进了巨噬细胞自体吞噬系统的活化,从而增强了巨噬细胞的杀菌能力[24]。目前,关于UPS中E2的研究主要集中在肿瘤疾病方面,在病原方面的研究较少,本研究探讨了E2中的UBE2T在RAW264.7细胞内布鲁氏菌增殖过程中的功能,发现布鲁氏菌M5-90在感染后8,12和24 h可激活UBE2T的表达,沉默UBE2T表达可抑制胞内M5-90的增殖,过表达UBE2T可促进胞内M5-90的增殖。结果表明,UBE2T在布鲁氏菌增殖中发挥重要作用。
IFN-γ是抗布鲁氏菌感染免疫反应中关键性的细胞因子[25],主要由活化后的NK、CD4+和CD8+T细胞产生,其作用主要是促进CD8+和CD4+T细胞的聚集,增强细胞的抗原呈递能力。IL-6是一种具有多种效能的细胞因子,可诱导T细胞合成分泌IL-2和诱导B细胞分化为浆细胞并促进抗体的分泌[26]。本研究表明,沉默UBE2T表达可提高M5-90介导的IFN-γ和IL-6水平;过表达UBE2T可抑制IFN-γ水平,因此可知UBE2T可调控布鲁氏菌介导的IFN-γ和IL-6水平。
