荧光蛋白mNeonGreen,mKOk作为FRET传能对在研究植物蛋白质互作中的应用分析
2021-04-30王亚琴李宗迪李晨羊李云琴胡涛谢礼周雪平
王亚琴 李宗迪 李晨羊 李云琴 胡涛 谢礼 周雪平
关键词蛋白质互作;荧光共振能量转移;mNeonGreen;mKOk
荧光共振能量转移技术(fluorescence reso-nance energy transfer,FRET)是指两个相互靠近的荧光发色基团中,一个分子吸收一定频率的光子被激发到更高的电子能態的同时,通过偶极子相互作用,将能量向另一分子转移(即发生能量共振转移)的现象。这种现象的发生有两个前提条件:一是两个荧光发光基团中一个荧光基团(供体分子)的发射光波长需与另一个荧光基团(受体分子)的激发光波长存在重叠区域;二是供体分子和受体分子之间的距离必须在1~10nm之间。由于荧光共振能量转移现象需要在这两个较为苛刻的条件下才能发生,且对供体和受体间的距离和空间取向高度敏感,因而可以作为检测蛋白质之间直接相互作用的有效工具。
青色荧光蛋白(cyan fluorescent protein,CFP)与黄色荧光蛋白(yellow fluorescent protein,YFP)是目前蛋白质相互作用研究中应用最广泛的FRET对,但CFP/YFP对存在一定的不足,如CFP和YFP会发生快速、多速率、可逆的光漂白,YFP可在一定条件下光转化为青色荧光,CFP可以被YFP的激发光波长激发出荧光等原因造成CFP/YFP对背景干扰较大。此外,许多报道表明基于CFP和YFP的FRET,当生物化学反应微弱或比较短暂时,会对FRET检测效率产生一定的挑战。因此,找到一对低背景干扰且能量转移效率高的荧光蛋白对,对于FRET的检测至关重要。
mNeonGreen是一种来源于文昌鱼Branchios-toma lanceolatum的新型绿色荧光蛋白,最大激发光和发射光的波长分别为504、517 nm,mKOk是一种来源于石珊瑚Verrillofungia concinna的新型橙色荧光蛋白,最大激发光波长和发射光波长分别为551、563 nm,研究发现,mNeonGreen和mKOk荧光蛋白相较于传统的绿色和橙色荧光蛋白具有更强的荧光强度。目前关于将这两种荧光蛋白用于FRET检测还未见报道。基于此,本研究在植物细胞中验证mNeonGreen-mKOk荧光蛋白对是否适用于FRET技术检测,并探索一套基于FRET技术检测植物蛋白间相互作用的体系。
1材料与方法
1.1材料
本氏烟Nicotiana benthamiana野生株系型由本实验室留种繁殖;大肠杆菌Escherichia coli菌株DH5a,农杆菌Agrobacterium tume faciens菌株C58C1,含FLAG和MYC标签的植物表达载体pGD-FLAG、pGD-MYC均由本实验室保存;REMl.1为实验室保存质粒;mKOk、mNeonGreen荧光蛋白由尚亚生物有限公司合成;FLAG、MYC标签抗体购自Sig-ma公司;二抗购自ABclonal公司;KOD OneTM PCRMaster Mix购自TOYOBO公司;ClonExpress II OneStep Cloning Kit、ClonExpress MultiS One Step Clo-ning Kit购自Vazyme公司;Kan、Rif抗生素购自上海生工生物工程有限公司。
1.2方法
1.2.1 FRET载体构建
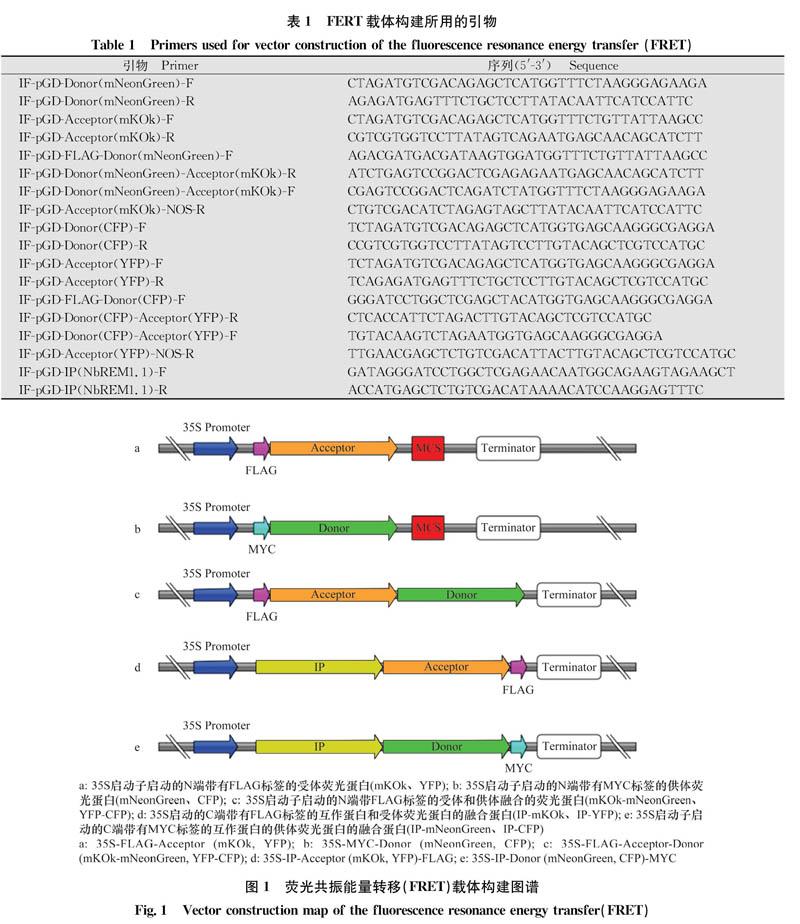
以供体荧光蛋白(donor)和受体荧光蛋白(accep-tor)为模板,分别设计特异性引物IF-pGD-Donor-F/IF-pGD-Donor-R、IF-pGD-Acceptor-F/IF-pGD-Accep-tor-R(表1),得到去除终止密码子且带有与pGD载体同源序列的基因片段,而后将得到的PCR产物利用单片段同源重组的方法分别克隆到pGD-35S-MYC和pGD-35S-FLAG载体上,得到pGD-35S-MYC-Donor和pGD-35S-FLAG-Acceptor(图1a,b)。再以Donor和Acceptor为模板,分别设计特异性引物IF-pGD-FLAG-Donor-F/IF-pGD-Donor-Acceptor-R、IF-pGD-Donor-Acceptor-F/IF-pGD-Acceptor-NOS-R,得到带有同源序列的Donor和Acceptor片段,而后将PCR产物利用多片段同源重组的方法克隆到pGD-35S-FLAG载体上,得到载体pGD-35S-FLAG-Acceptor-Donor(图1c)。以待检测的互作蛋白(interacting protein,IP)为模板,设计特异性引物IF-pGD-IP-F/IF-pGD-IP-R,得到去除终止密码子且带有与载体同源序列的基因片段,再利用同源重组的方法将PCR产物分别克隆到带有供体和受体荧光蛋白的载体上,得到载体pGD-35S-IP-Ac-ceptor-FLAG、pGD-35S-IP-Donor-MYC(图1d,e)。构建好的载体在测序正确后,电激转化到农杆菌菌株C58C1中。
1.2.2农杆菌在本氏烟上的瞬时表达
将构建好的农杆菌置于含有Kanq-Rif的双抗YFP液体培养基中,28℃,220r/min培养12 h,取2mL菌液于12000r/min下离心30s,而后加入1mL润缓冲液重悬菌体,调节OD至0.8左右,室温静置2~3h。静置好的菌液分别浸润本氏烟叶片,于25℃下培养36~48h。
1.2.3蛋白提取、SDS-PAGE及Western blot分析
取约0.10g本氏烟叶片,经液氮处理后研磨成粉末,加入200μL植物蛋白质提取缓冲液,振荡1min使样品与提取缓冲液充分混合反应,12000 r/min离心5min,取上清,加入50/μ5×loading buffer,95℃金属浴5min后使蛋白变性。将制备好的蛋白样品进行SDS-PAGE电泳,电泳结束后,取下凝胶,转至硝酸纤维素膜(NC膜)上,用TBST缓冲液对封闭后的膜洗3遍,每次5min,加人事先配制好的一抗溶液,在摇床上轻晃孵育1h,用TBST缓冲液洗膜3遍,每次5~10min。加入HRP标记的二抗,在摇床上孵育1h,用TBST缓冲液洗膜3~5次,每次5min,最后用Luminate Forte WesternHRP substrate(Millipore)进行化学显影。
1.2.4激光共聚焦显微镜检测FRET效率
样品制备:检测样品为共表达供体荧光蛋白mNeonGreen/CFP-IP和受体荧光蛋白mKOk/YFP-IP及融合表达mNeonGreen-mKOk、CFP-YFP的本氏烟叶片;质控样品为单独表达供体荧光蛋白mNeonμGreen/CFP-IP或受體荧光蛋白mKOk/YFP-IP的本氏烟叶片。采用敏化发射法(sensitized emissionFRET,SE-FRET)检测FRET现象。该法是通过供体的激发光去激发供体,若供体和受体的空问距离在1~10nm范围内,供体的发射光就能激发出受体的荧光,则可以检测到FRET信号。检测步骤如下:
第一步:调试参数。首先设定供体荧光和受体荧光的扫描参数。由于mNeonGreen供体荧光的激发峰和发射峰分别为504、517nm mKOk受体荧光的激发峰和发射峰分别为551、563 nm,因此采用488 nm波长的激发光激发mNeonGreen荧光蛋白,并采用490~550nm波长的发射光接收发射光;对于受体mKOk荧光蛋白,采用561nm波长的激发光进行激发,并采用575~625nm波长的发射光检测发射光信号。另外,当FRET荧光蛋白对变为CFP/YFP时,由于CFP供体荧光的激发峰和发射峰分别为436、476 nm,YFP受体荧光的激发峰和发射峰分别为516、529nm,因此采用405nm波长的激发光可以激发出CFP的荧光,并采用455~515nm波长的发射光接收发射光,YFP的荧光可以采用514nm波长的激发光进行激发,采用520~620nm波长的发射光进行检测。
第二步:采用多轨道(multi track)FRET图像采集模式。其中,Track中有两个通道,待检测的蛋白均用供体的激发光进行激发,通道工收集供体荧光的发射信号,通道Ⅱ收集FRET的发射信号。TrackⅡ只有一个受体荧光的通道,采用受体的激发光进行激发,并使用这个通道单独收集受体荧光的发射信号。调整激发光的强度,获得理想的荧光图像。
第三步:FRET效率的分析。从获得的FRET荧光图像中,选择感兴趣的区域(ROD,采用Xia和Liu的方法,利用卡尔蔡司AIM软件的LSMFRET软件自动计算出每个ROI的FRET效率,即N-FRET值。
第四步:统计学分析。采用t检测的方法分析试验组和对照组的N-FRET值是否存在差异,利用GraphPad Prism 7软件进行统计分析。
2结果与分析
2.1荧光蛋白mNeonGreen、mKOk的光谱分析
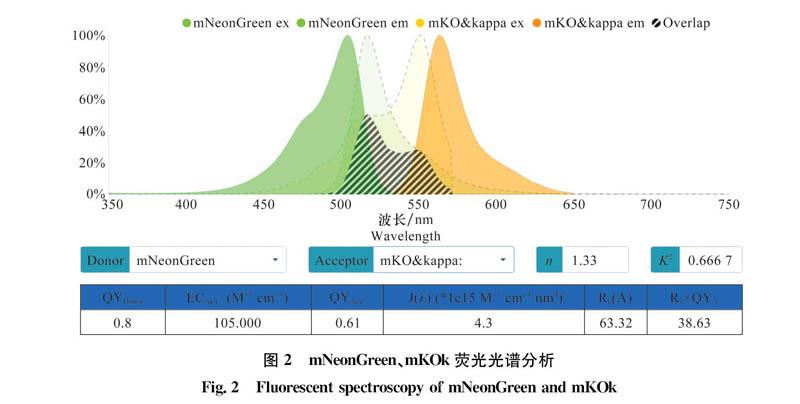
通过在线网站(https://WWW.fpbase.org/fret/)对mNeonGreen和mKOk的荧光光谱进行分析,结果显示,mNeonGreen最大激发光和发射光的波长分别为504、517 nm,mKOk最大激发光波长和发射光波长分别为551、563nm,且二者的光谱存在重叠区域(图2),其中mNeonGreen可作为供体荧光,mKOk作为受体荧光。
2.2重组载体鉴定
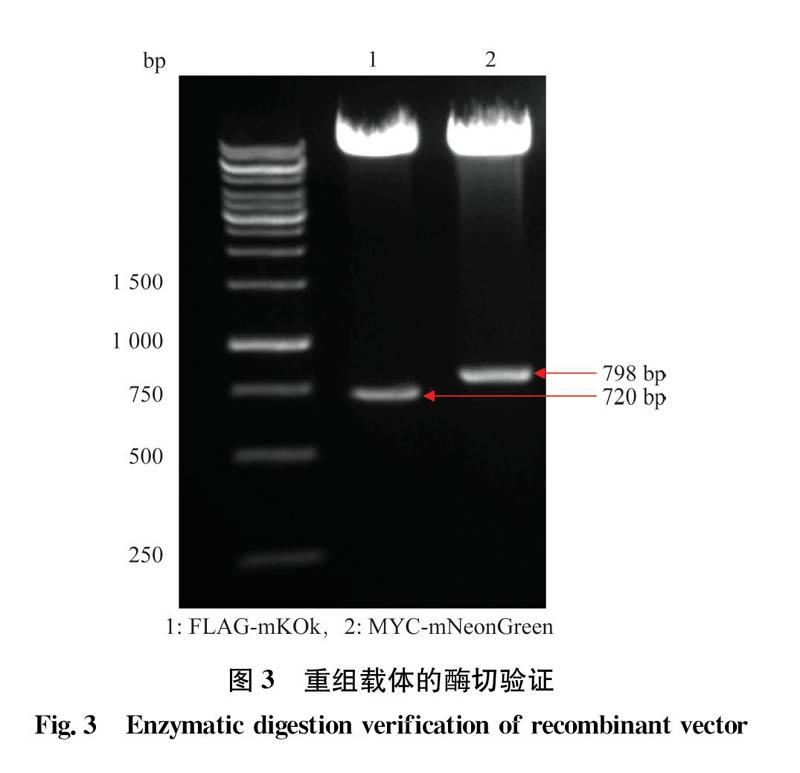
以荧光蛋白mNeonGreen,mKOk为模板,利用设计的特异性引物,通过PCR扩增和酶切筛选获得的阳性克隆,经测序验证正确后,对相应的目的片段进行双酶切,酶切产物经1%的琼脂糖凝胶电泳,得到大小分别为798 bp和720 bp的特异性条带(图3),与已报道的目标基因大小符合,证明荧光蛋白mNeon-Green.mKOk分别成功地插入到目的载体上。
2.3重组蛋白鉴定
将构建好的荧光蛋白载体在本氏烟叶片上进行瞬时表达,36~48h后提取蛋白并进行Westernblot分析,利用MYC和FLAG抗体分别进行检测,结果显示,MYC和FLAG抗体可检测到mNeon-Green和mKOk的条带,用FLAG抗体可检测到融合蛋白的条带(图4),证实所构建的荧光蛋白载体可以在本氏烟叶片中成功表达。
2.4 mNeonGreen/mKOk荧光蛋白对适用于FRET技术检测
将C58Cl-pGD-mNeonGreen-MYC、C58Cl-pGD-mKOk-FLAG等比例混合后浸润野生型本氏烟,作为阴性对照组,将融合表达载体C58C1-pGD-FLAG-mNeonGreen-mKOk浸润野生型本氏烟叶片,作为阳性对照组,在本氏烟叶片上瞬时表达48h后进行FRET效率检测。
为了排除串色对FRET效率计算的干扰,首先收集仅表达供体mNeonGreen和受体mKOk的FRET图像作为校正因子(图5a,b),计算出串扰系数,用于后续的FRET效率分析,该计算过程由卡尔蔡司自带的LSM FRET软件完成。
用波长为488nm激发光和490~550nm发射光检测共表达供体mNeonGreen和受体mKOk以及表达融合蛋白mNeonGreen-mKOk的本氏烟叶片,均可以获得mNeonGreen荧光图像(图5c,d,mNeonGreen通道);用波长561nm激发光和575~625nm发射光检测共表达供体mNeonGreen和受体mKOk以及表达融合蛋白mNeonGreen-mKOk的本氏烟叶片,也可检测到mKOk荧光的发射光信号(图5c,d,mKOk通道)。用波长为488nm激发光和575~625nn3.发射光检测FRET信号时,无法在共同表达供体和受体的叶片(mNeonGreen+mKOk)中获得FRET通道的图像(图5c,FRET通道),但能在表达融合蛋白mNeonGreen-mKOk的叶片上检测到较强的FRET信号(图5d,FRET通道)。
根据获得的FRET图像,用卡尔蔡司自带的LSM FRET软件计算FRET效率N-FRET值。结果显示,阴性对照组的FRET效率值几乎为零,而阳性对照组的FRET效率值远远高于阴性对照组,且两者存在显著差异(图5e)。说明mNeonGreen和mKOk荧光蛋白在共浸润的情况下,由于空间距离上足够远,不会发生FRET现象,可以作为FRET检测的阴性对照组。而融合荧光蛋白mNeonGreen-mKOk由于在空间距离上几乎为零,因此发生了FRET现象,说明mNeonGreen/mKOk荧光蛋白对适用于FRET技术检测。
2.5mKOk/mNeonGreen荧光蛋白对的优势
将C58Cl-tGDMYC-CFP、C58C1-pGDFLAG-YFP等比例混合后浸润野生型本氏烟,作为阴性对照组,将融合表达载体C58C1-pGD-FLAG-CFP-YFP浸润野生型本氏烟,作为阳性对照组,在本氏烟叶片上瞬时表达48h后进行FRET效率检测。
首先,采集单独表达供体CFP和受体YFP的FRET图像(图6a,b),并进行串扰系数的计算。再用波长405 nm激发光、455~515nm发射光检测共表达供体CFP和受体YFP以及表达融合蛋白CFP-YFP的本氏烟叶片,均可以获得青色荧光图像(图6c,d,CFP通道);用波长514nm激发光和520~620nm发射光检测共表达供体和受体以及表达融合蛋白的本氏烟叶片,均能检测到黄色荧光的发射光信号(图6c,d,YFP通道)。用波长为405nm激发光和520~620nm发射光检测FRET信号时,不仅能在表达融合蛋白CFP-YFP的叶片上检测到FRET的信号(图6d,FRET通道),在共同表达CFP和YFP的叶片中,也可以获得较弱的FRET通道信号(图6c,FRET通道)。
对获得的阴性和阳性对照组进行FRET效率分析,结果表明,在共同表达CFP和YFP的情况下,FRET通道检测到了较弱的信号,但是通过统计分析,表达融合蛋白CFP-YFP的叶片FRET效率相比于共同表达CFP和YFP的叶片FRET效率之问还是存在显著性差异的(图6e)。与mNeonGreen/mKOk荧光对的阴性对照组相比,CFP/YFP荧光对阴性对照组FRET效率值明显偏高,说明CFP/YFP荧光对存在一定的背景干扰,而mNeonGreen/mKOk的阴性对照组的FRET效率值更接近于零,背景干扰较低。所以,在烟草叶片中,mNeonGreen/mKOk相比于传统的CFP/YFP更适合作为FRET荧光蛋白对用于蛋白相互作用的检测。
2.6 mKOk-mNeonGreen荧光蛋白对验证植物蛋白间相互作用
Remorin蛋白是定位在植物细胞膜上的一种陆地植物特有的蛋白,它可以通过影响胼胝体的积累来调节胞间连丝孔径的大小,在植物抵抗病原微生物过程中起着至关重要的作用。NbREMl.1是Remorin蛋白的一种,Fu等利用传统的酵母双杂交、双分子荧光互补等方法鉴定到NbREMl.1存在自身互作的现象。因此,本研究选取REMl.1蛋白,采用mNeonGreen/mKOk FRET荧光蛋白对验证其蛋白质间相互作用。
采集单独表达REMl.1-mNeonGreen和REM1.1-mKOk的FRET图像(图7a,b),计算出串扰系数。再用488nm波长的激发光、490~550nm波长的发射光检测共表达供体mNeonGreen和受体mKOk以及共表达REMl.1-mNeonGreen和REMl.1-mKOk的烟草细胞,均可以获得mNeon-Green荧光图像(图7c,d,mNeonGreen通道)。同时,用561nm波长的激发光、575~625nm波长的发射光检测共表达供体mNeonGreen和受体mKOk以及共表达REMl.1-mNeonGreen和REMl.1-mKOk的煙草细胞,均可以获得mKOk荧光的发射光信号(图7c,d,mKOk通道)。用波长为488 nm波长的激发光、575~625nm波长的发射光检测FRET信号时,无法在共同表达供体mNeonGreen和受体mKOk的叶片中获得FRET通道的图像(图7c,FRET通道),但能在共表达REMl.1-mNeon-Green和REMl.1-mKOk的烟草叶片上检测到较强的FRET信号(图7d,FRET通道)。
根据获得的FRET图像,利用软件计算FRET效率值。结果显示,共同表达REMl.1-mNeon-Green和REMl.1-mKOk的FRET效率值远高于共表达mNeonGreen和mKOk的FRET效率值,并且两者之间存在显著性差异(图7e),证实REMl.1可以发生自身互作,与之前文献报道的结果一致。
3讨论
在植物体内,蛋白质间的相互作用与多种生物过程相关,包括信号转导、体内平衡控制、应激反应、植物防御和器官形成等。在分子层面上,蛋白质问的相互作用在蛋白质翻译后修饰、转录辅助因子的招募、细胞骨架的组装、转运体的活化等方面都具有重要意义。
目前研究蛋白质互作的常规技术为酵母双杂交技术、双分子荧光互补技术(BiFC)、GST pull-down技术、免疫共沉淀技术等。这些研究技术的不断发展,为蛋白一蛋白间相互作用的研究提供了极为有利的条件,但同时这些研究手段也存在不少缺陷,如传统的酵母双杂交系统操作周期较长,并且需要将诱饵蛋白和捕获蛋白拉至细胞核内才能启动下游报告信号,因此不能鉴定出在细胞核之外具有特定亚细胞定位的互作。BiFC的缺点在于假阳性较多,需要进行多重筛选等试验进行排除。GST pull-down技术无法进行大规模筛选、且不能排除内源蛋白产生的假阳性的干扰。免疫共沉淀技术无法检测瞬时的相互作用、无法判断是直接还是问接的相互作用等。
近年来,FRET技术的发展为弥补上述问题提供了一个有力的工具。相比于传统的蛋白一蛋白互作研究手段,FRET技术能够在活细胞的正常生理条件下进行检测,并具有灵敏度高,假阳性较低,实验周期短的优势,因此目前FRET技术在研究哺乳动物蛋白之间相互作用上已经得到了广泛的应用。但由于植物叶片叶肉组织结构复杂等因素,FRET技术在植物蛋白互作研究中的应用较少。
进行FRET检测时最关键的就是选择两个合适的荧光蛋白(供体和受体),目前应用较广泛的是CFP和YFP,由于CFP和YFP都是在GFP的基础上改造得来的,两者在一定程度上可能存在着同源性,可形成微弱的相互作用,同时YFP的激发光也可以激发出CFP的荧光,这些因素导致CFP/YFP荧光对的背景干扰较大,对试验结果产生一定的影响。本研究选取了两种新型的荧光蛋白mNeon-Green/mKOk作为FRET传能对,荧光光谱分析表明mKOk和mNeonGreen的光谱存在重叠区域,且两者之间可以发生荧光共振能量转移,其中mNeon-Green作为供体荧光,mKOk作为受体荧光。与传统的传能对CFP/YFP相比,mNeonGreen/mKOk背景干扰较低,更适合作为FRET荧光蛋白对用于蛋白相互作用的检测。通过构建并表达荧光蛋白与目标蛋白的融合蛋白,利用FRET技术成功地在植物细胞中验证了蛋白与蛋白间的相互作用。
FRET技术在研究活细胞单分子之间相互作用的能力已引起人们的广泛兴趣,这项技术现在已经成为一种显微镜研究的常用技术。尽管如此,用FRET检测蛋白质互作的报道还非常有限,这表明目前FRET技术还远非一种常规技术。在对FRET效率进行检测的过程中,检测仪器的敏感度、分辨率、参数设置以及计算机影像采集和分析软件的能力等都是影响FRET效率的因素。目前,FRET技术在植物学研究中的应用非常少,植物细胞的结构与动物细胞有较大差别,荧光蛋白的选择,ROI的选取,融合蛋白在叶肉细胞中的表达水平等都会影响FRET的效率和试验的成败。本研究采用敏化发射法分析FRET效率,这种方法对于激光共聚焦显微镜的配置要求较低,操作简单,但是该法只能定性地判断2个蛋白间是否存在相互作用,无法定量比较蛋白一蛋白相互作用的强弱。就目前而言分析蛋白质间的相互作用需要结合多种不同的方法相互取长补短才能得出一个科学的结论。
本研究成功构建了mNeonGreen和mKOk两个荧光蛋白标记的载体,建立了一套基于FRET技术在植物细胞中进行蛋白一蛋白相互作用的体系,包括融合表达载体的构建和表达、激光共聚焦的图像采集、FRET效率的分析等,为后续FRET技术在植物细胞中的应用提供了更多的技术支持和借鉴。
