异化Mn(IV)还原耦合降解卡马西平及双氯芬酸
2021-04-30王泉峰尹雪娇
翟 俊,胡 炜,王泉峰,尹雪娇,陈 妮
异化Mn(IV)还原耦合降解卡马西平及双氯芬酸
翟 俊*,胡 炜,王泉峰,尹雪娇,陈 妮
(重庆大学三峡库区生态环境教育部重点实验室,重庆 400045)
本文以卡马西平(CBZ)和双氯芬酸(DCF)2种代表性有机药物作为目标污染物,嘉陵江沉积物中提取的微生物作为菌源,利用锰矿物为填料的厌氧生物滤柱探究了异化锰还原过程对CBZ和DCF的处理效果.同时研究了外加有机碳源(乙酸钠)和MnO2对异化锰还原去除CBZ和DCF过程的影响.结果表明,在无外加乙酸钠和MnO2时,厌氧生物滤柱对10µg/L的CBZ和DCF能分别实现25.23%和32.44%的去除.其中异化锰还原贡献的去除率分别为2.81%和14.87%,而外加0.5g/L乙酸钠和25g MnO2均能提高异化锰还原过程中对CBZ的处理效果(分别提高6.35%和4.63%),但对DCF的去除无显著影响.本试验可为难降解有机药物的降解提供新的思路.
卡马西平;双氯芬酸;异化锰还原
有机药物是一种新兴的水体污染物,由于其代谢稳定性高,具有较高的生物降解抗性,其潜在影响不容忽视[1-3].另外,随着人口的增长和人类对药物的依赖性,环境中药物的种类和浓度也在逐渐增加[4-5].卡马西平(CBZ)是一种用于控制癫痫发作和各种心理治疗的常用药物[5-6].双氯芬酸(DCF)是最常用的止痛药和非甾体类抗炎药之一[7-9].在所有药物化合物中,CBZ和DCF也是水环境中检出频率很高的两种化合物,在污水厂出水中检测浓度分别可高达6.3µg/L和2.1µg/L,因此CBZ和DCF常用于表征有机药物污染的指标性物质[10-12].
传统的污水厂工艺难以对有机药物进行有效的去除,而目前常用的如高级氧化,活性炭吸附和膜过滤等技术,则往往存在高能耗、高运营成本等缺点[13-17].相比之下,低能耗、低成本的生物降解技术则更具有吸引力及发展空间.在厌氧生物降解污染物中,相比其他电子受体如硝酸盐或硫酸盐,添加固体Mn(IV)或Fe(III)等金属电子受体不但可以避免增加废水的盐度,还可同时去除其他污染物如氨或重金属,并且还原产物Mn(II)和Fe(II)也可以通过低能耗生物过程进行再氧化[14].因此,应用Mn(IV)或Fe(III)等金属离子作为电子受体的厌氧生物处理具有明显的优势,但目前关于异化Mn(IV)还原过程应用于有机污染物降解及外加微生物易吸收C源对该过程影响的研究还鲜有报道.
因此,本试验选取CBZ和DCF这2种代表性有机药物为目标污染物,以天然锰矿石作为滤料,淡水沉积物作为菌源,生物滤柱作为反应器,通过对比不同进水条件下有菌组和无菌组对CBZ及DCF的去除效果,探究异化Mn(IV)还原菌对目标污染物的去除效果以及外加C源和MnO2对去除效果的影响,以期为后续异化金属还原的工程应用提供参考.
1 材料与方法
1.1 菌种来源及培养条件
菌种培养基成分为:NH4Cl 0.25g/L, NaH2PO4·H2O 0.6g/L,KCl0.1g/L,CH3COONa 6.8g/ L,维生素溶液10mL/L, 矿物质溶液10mL/L,pH值6.8~7.0.其中维生素溶液和矿物质溶液参考文献[18]方法配置.
在暗光、30℃及厌氧条件下对淡水沉积物进行淹水培养1~11d,后按水土质量比1:9制备微生物接种液,并提取上清液于4℃条件下保存.将微生物提取液和灭菌后的菌种培养基按1:9进行混合,取100mL混合液加入0.2g MnO2,后放于30℃水浴恒温振荡器中进行暗光厌氧培养,24h后测定体系中的Mn(Ⅱ)浓度以探究菌种的Mn还原能力,同时设置无菌对照组.
1.2 实验装置和方法
1.2.1 主要材料及仪器 主要药剂:CBZ(纯度>99.5%),DCF(纯度>99.5%),MnO2(AR),乙酸钠(AR),其中CBZ及DCF购自上海西格玛奥德里奇贸易有限公司,MnO2及乙酸钠购自上海阿拉丁生化科技股份有限公司.
选取来自河北省唐山市迁西县的天然锰矿石作为电子受体.
主要仪器:高效液相色谱仪(型号Agilent 1260),紫外分光光度计(型号9123A),原子吸收分光光度计(型号TAS-986F).
1.2.2 反应器设计 试验装置如图1所示,设置2组平行对照组,每组生物滤柱通过蠕动泵从底部进水,并设一进气孔,与氮气罐相连,以保证反应器内的厌氧环境.反应器在试验过程中采用连续上向流进出水运行方式.
本试验通过反应器中是否添加菌种来对比研究异化Mn(IV)还原对目标污染物的去除效果,并根据进水条件分为3个部分进行.试验一为无外加有机C源(乙酸钠)和MnO2情况下2组反应器对CBZ及DCF的去除效果对比,进水条件为NH4Cl=0.25g/ L,NaH2PO4·H2O=0.6g/L,KCl=0.1g/L,维生素溶液10mL/L,矿物质溶液10mL/L,CBZ与DCF浓度均为10µg/L左右,pH=6.8~7.0,反应器水力停留时间24h.试验二为仅外加有机C源(电子供体)情况下2组反应器对CBZ及DCF的去除效果对比,进水条件在试验一的基础上添加0.5g/L的CH3COONa,其它条件同试验一.试验三为外加有机C源和MnO2(电子受体)情况下2组反应器对CBZ及DCF的去除效果对比,其试验要求为在2组反应器中均加入25g MnO2,其它条件同试验二.
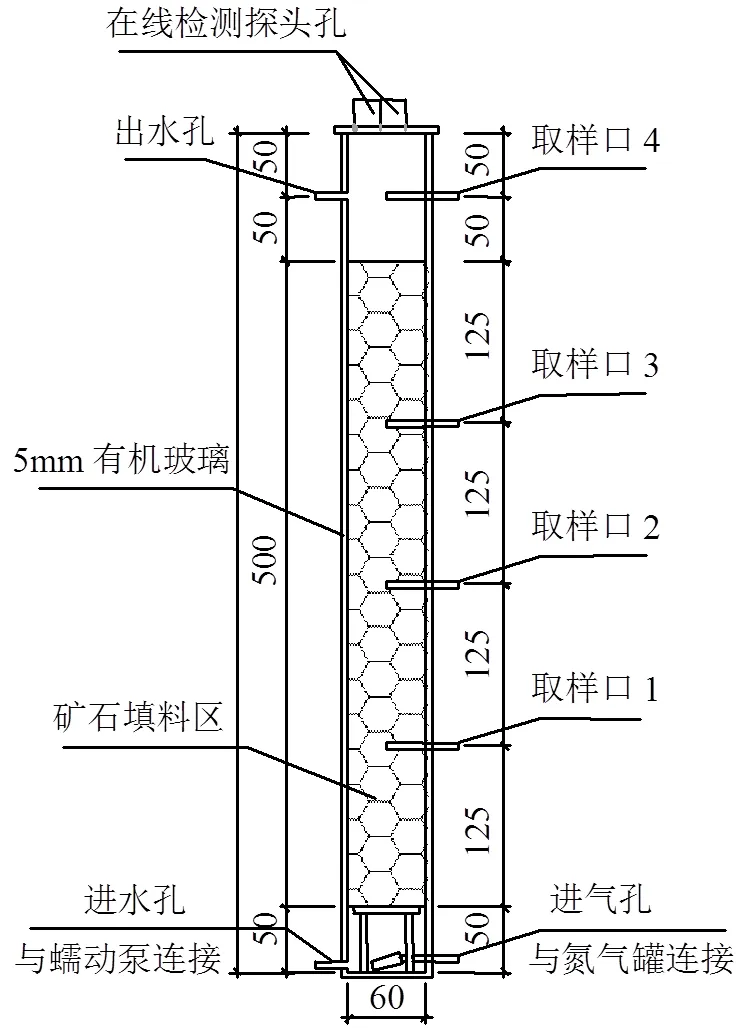
图1 反应装置
尺寸单位:mm
1.2.3 反应器运行及水样测试方法 反应器按照试验进水要求配置进水溶液,通过向水箱充入氮气以保证进水箱的厌氧环境,然后连续进出水,反应器正常运行2d后开始测试数据.每次试验运行1个月左右,期间每隔2~3d测一组数据.
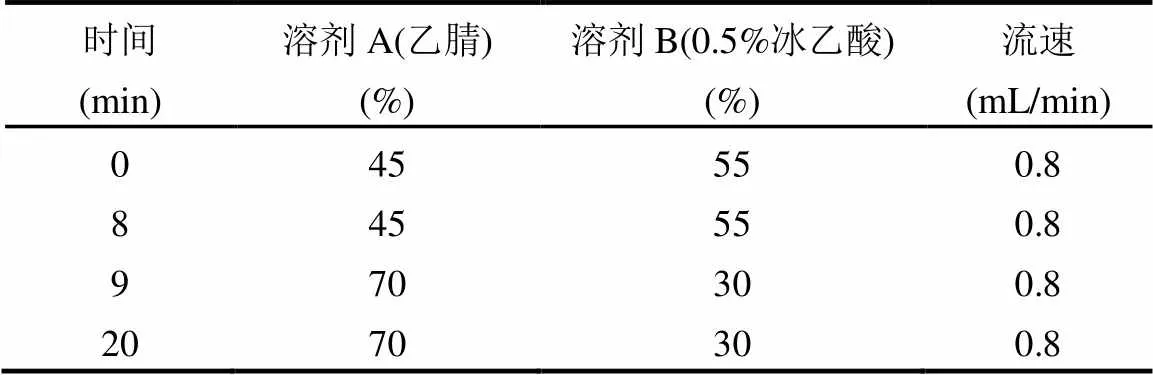
表1 HPLC梯度洗脱程序
水样经0.45µm膜过滤后,测定其中溶解态Mn(Ⅱ),CBZ和DCF的浓度.Mn(II)浓度测定方法采用高碘酸钾氧化分光光度法[19].CBZ和DCF浓度的测定方法采用高效液相色谱法[20],具体色谱条件为:Eclipse XDB-C18色谱柱(250mm´4.6mm,5mm),柱温25℃,流动相乙腈和0.5%冰乙酸(梯度洗脱,如表1所示),流速0.8mL/min,进样量20mL,检测波长284nm.
1.3 数据处理与统计分析
所有数据均采用Microsoft Excel 2016进行统计分析,利用Origin 2017软件作图.
2 结果与讨论
2.1 淡水沉积物中菌种Mn还原能力的研究
本试验模拟淡水沉积物的淹水过程,通过测定Mn(Ⅱ)生成量,比较不同淹水培养时间下淡水沉积物中锰还原微生物群落利用乙酸钠的活性变化特征,以期得出锰还原微生物活性恢复最快的时期,从而为后续试验提供活性良好的菌种.
不同淹水培养时间下的淡水沉积物对MnO2的还原能力(Mn(Ⅱ)浓度变化情况)如表2所示.随着淹水培养时间的增加,有菌组中Mn(Ⅱ)的浓度逐渐增加,培养11d后Mn(Ⅱ)的浓度增加量为1.346mg/L.而无菌组中Mn(Ⅱ)浓度由于自然溶出的作用增加速率十分缓慢,11d仅增加了0.093mg/L.由此可见,试验所用的淡水沉积物中的微生物具有MnO2还原能力,可用于后续的试验研究.
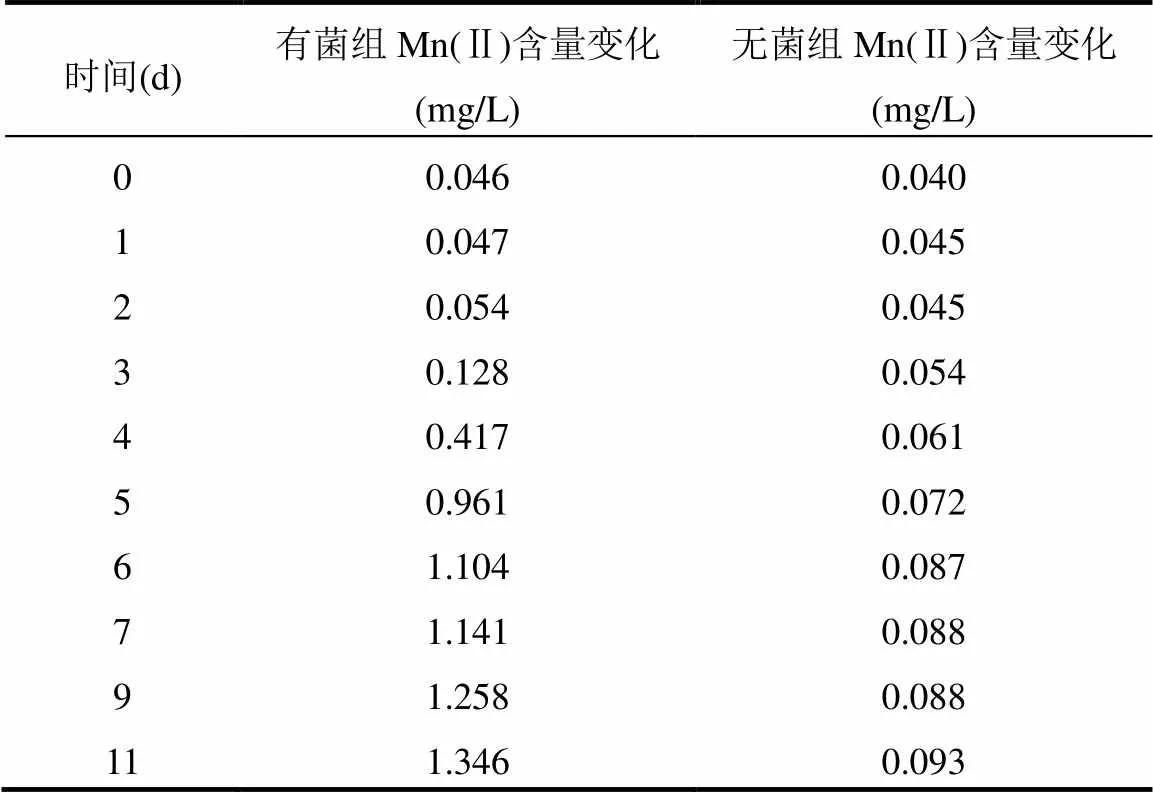
表2 不同淹水培养时间下有菌组与无菌组Mn(Ⅱ)浓度变化情况
Logistic模型[21]是一种常用的微生物生长曲线的拟合模型,其表达式为:
C=/(1+e)
式中:C为培养时间时,体系中Mn(Ⅱ)的含量,mg/L;为培养时间,d;为体系中Mn(IV)还原的最大潜势,即Mn(Ⅱ)的最大累积量;为模型参数;为反应的速率常数,即Mn(Ⅱ)的累积速率常数.
有菌组中,Mn(Ⅱ)主要是由于异化金属还原菌的生命活动所产生,因此可以用Mn(Ⅱ)的含量变化来间接描述异化金属还原菌的生长情况.对有菌组中的Mn(Ⅱ)浓度进行Logistic模型拟合分析得到拟合方程为C=1.254/(1+732.195e-1.504t)(图2),其拟合系数2为0.987.
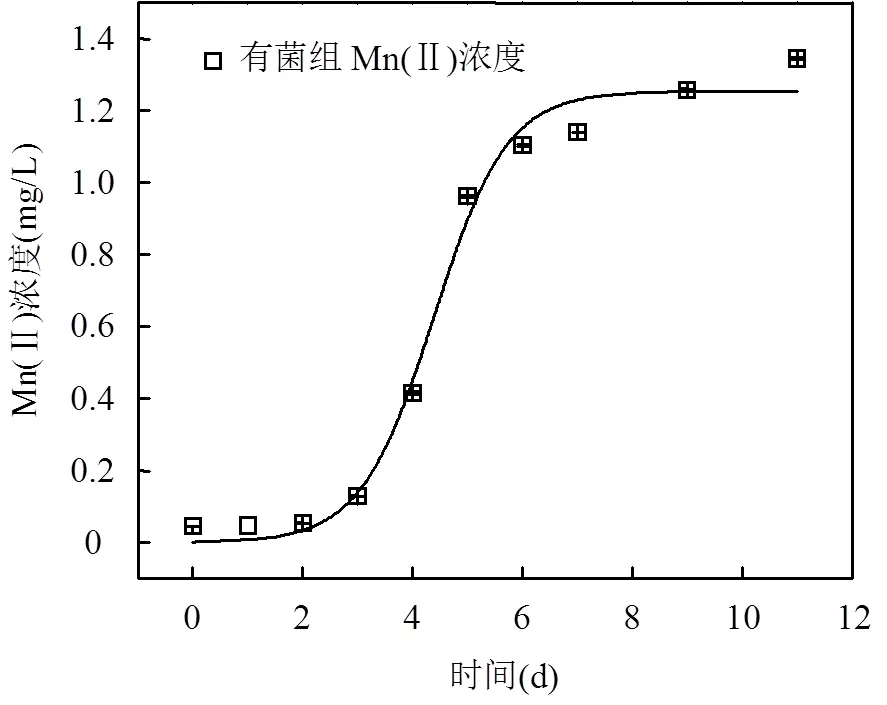
图2 Logistic拟合方程曲线
最大反应速率(max)数值上等于0.25,最大还原速率对应的时间(Tmax)可用ln/计算[22].根据拟合结果可知,在淹水培养时间为4.38d时异化Mn(IV)还原速率达到最大值,此时最大反应速率max为0.47mg/(g×d).后续试验中,微生物接种液采用淹水培养5d后的淡水沉积物浸提液.
2.2 异化Mn(IV)还原对CBZ、DCF的去除特性
图3为接种和未接种异化金属还原菌混合菌源(后面简称为有菌组与无菌组)的2组反应器对CBZ和DCF的去除效果.厌氧条件下,有菌组与无菌组对CBZ的平均去除率分别为25.23%和22.42%,对DCF的平均处理率分别为32.44%和17.57%.有菌组与无菌组反应器对CBZ的去除效果没有显著性差异(>0.05),表明本次试验过程中异化Mn(IV)还原耦合降解CBZ的效果不显著.而有菌组对DCF去除率显著高于无菌组(<0.05),说明了异化Mn(IV)还原耦合降解DCF的效果较为显著.
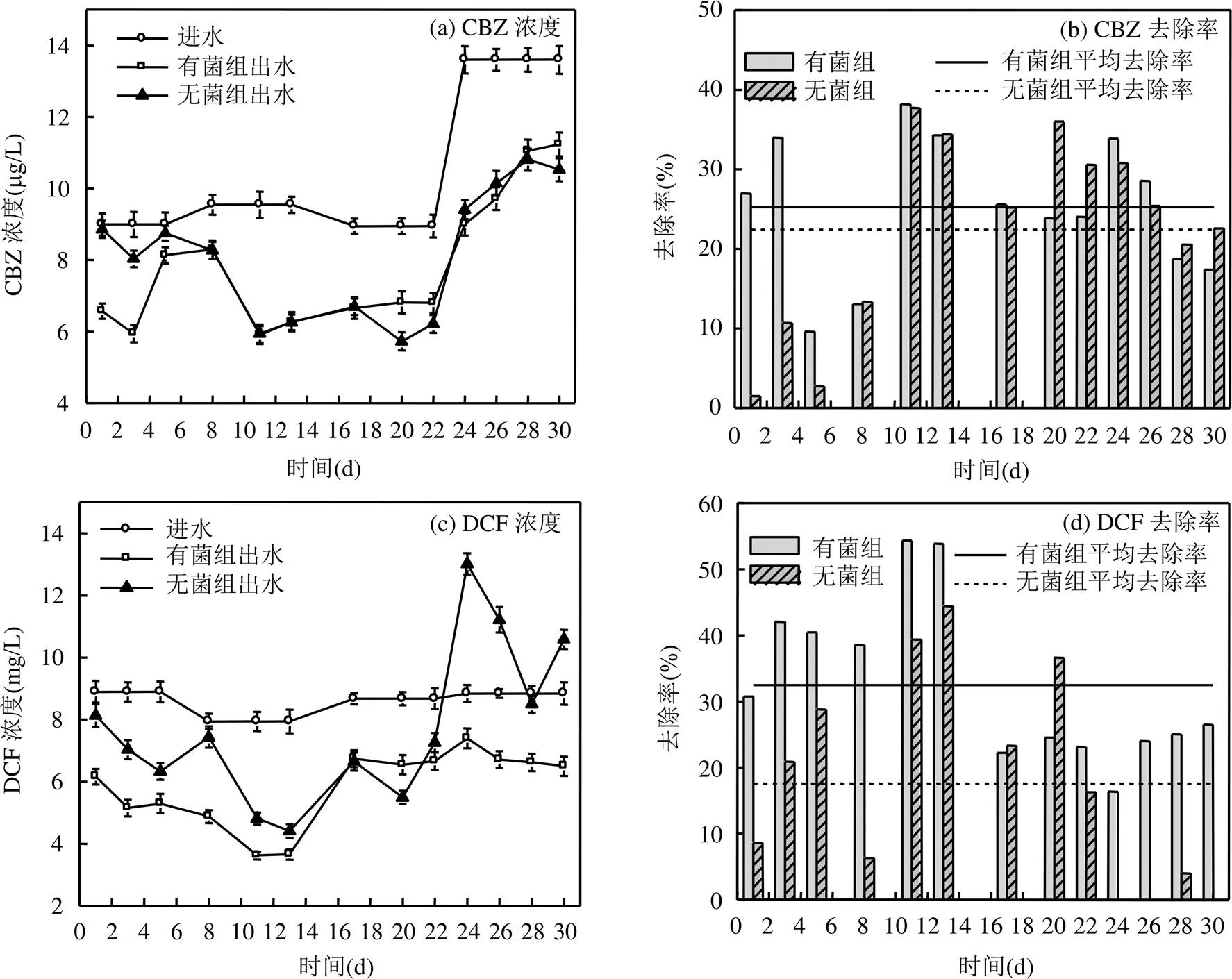
图3 试验一2组反应器对CBZ和DCF的处理效果
2.3 外加有机C源和MnO2对异化Mn(IV)还原耦合降解CBZ及DCF的影响
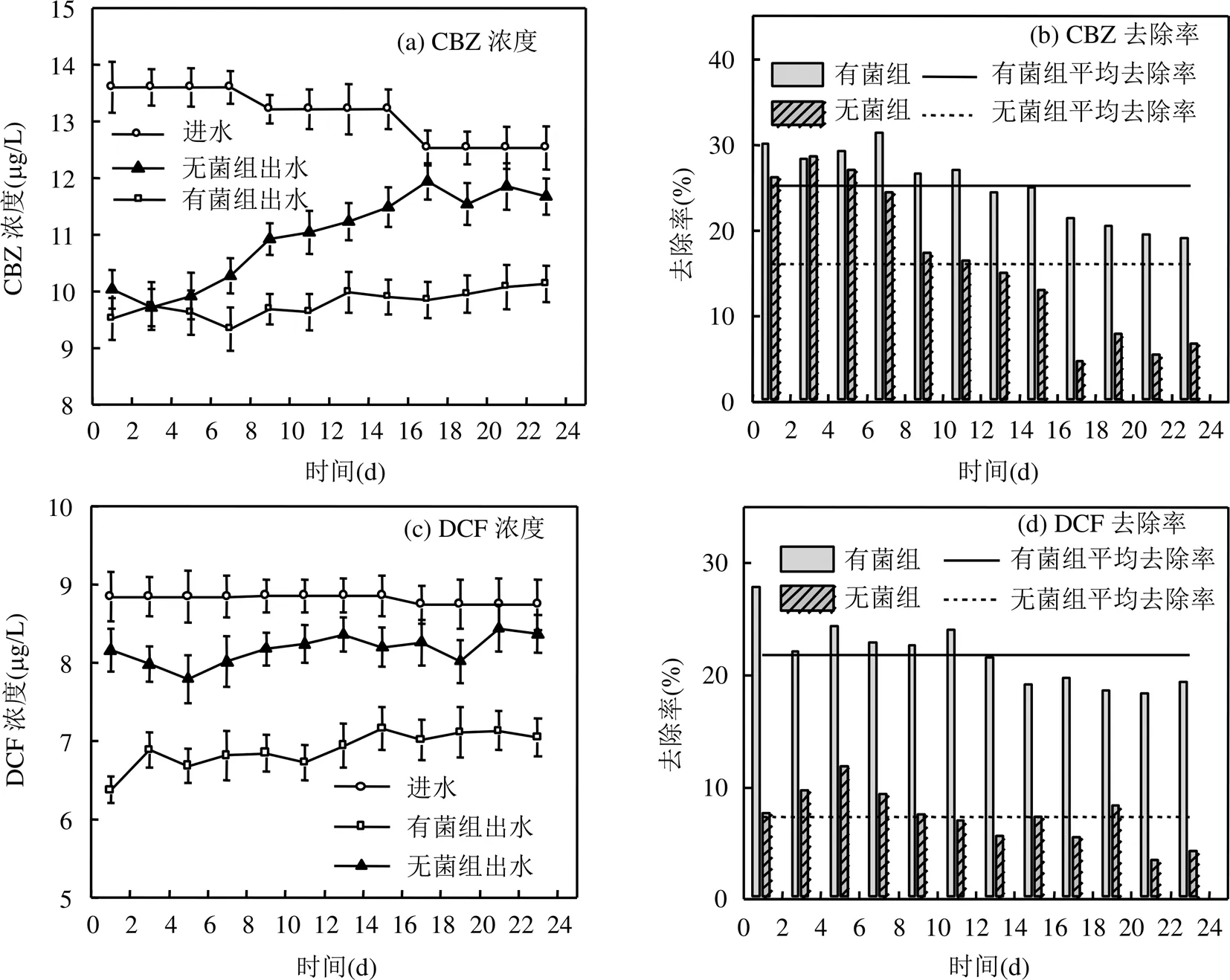
图4 试验二2组反应器对CBZ和DCF的处理效果
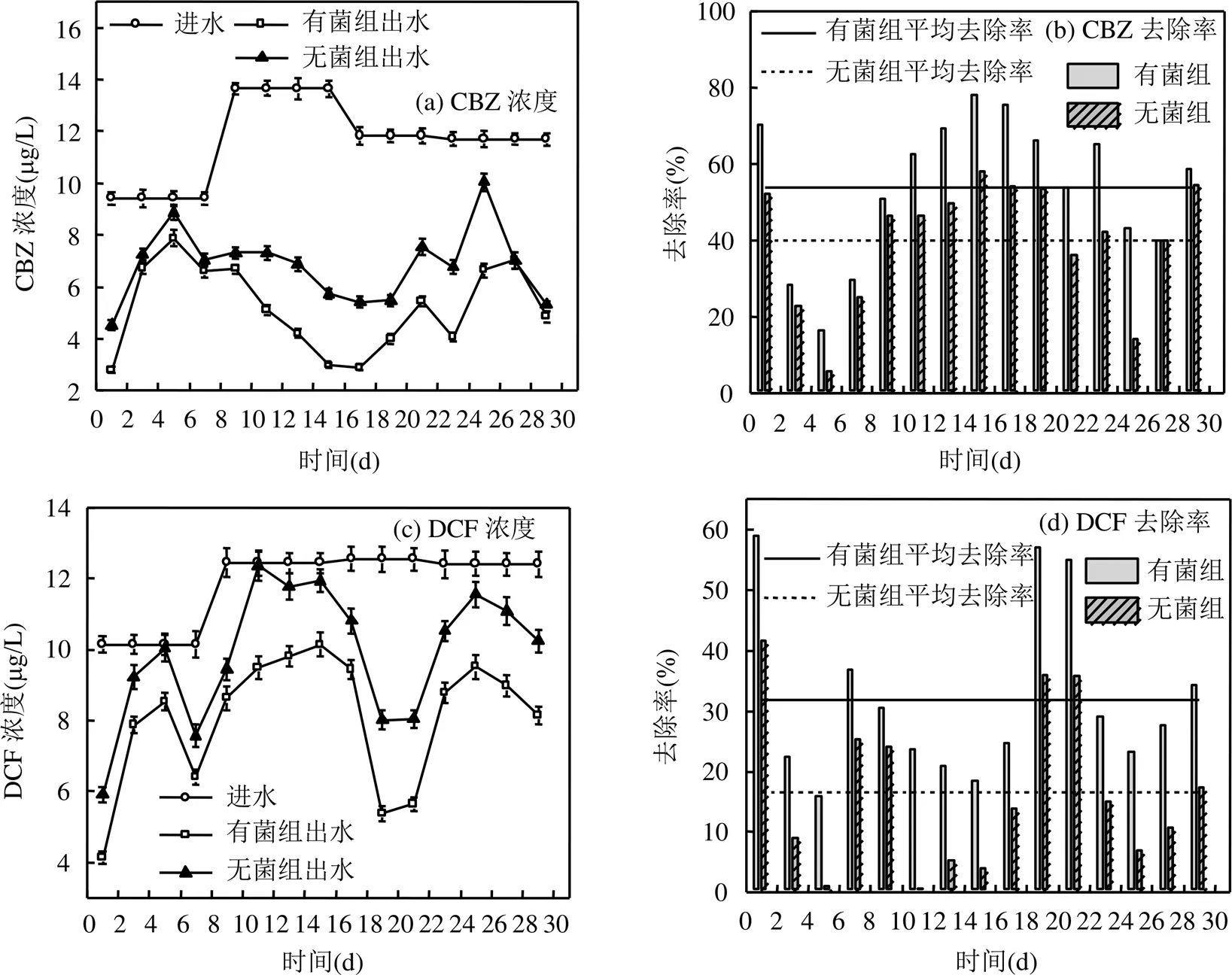
图5 试验三2组反应器对CBZ和DCF的处理效果
如图4所示,进水外加有机C源条件下,有菌组和无菌组对CBZ的平均处理率分别为25.25%和16.09%,对DCF的平均处理率分别为21.77%和7.35%.有菌组对CBZ和DCF的去除率均显著大于无菌组(<0.05),说明了异化Mn(IV)还原耦合降解CBZ和DCF的效果均为显著.
本试验结果与试验一相比,无菌组对CBZ和DCF的平均去除率分别下降了6.33%和10.22%;有菌组对CBZ的平均去除率基本保持不变,对DCF的平均去除率下降了10.67%,其中由异化Mn(IV)还原贡献的CBZ去除率上升了6.35%(由2.81%提高到9.16%),DCF去除率则基本持平(由14.87%变为14.42%).2次试验对比,说明了外加有机物会和CBZ及DCF竞争锰氧化物的活性点位[23-25],从而抑制锰氧化物对CBZ及DCF的物理化学作用,但同时外加C源也促进了异化Mn(IV)还原耦合降解CBZ的效果.金圣圣等[23]人研究也表明锰氧化物主要通过其表面的活性点位与有机物相结合形成前体复合物,然后前体复合物又分解为Mn(II)和自由基, 继而自由基被氧化或发生偶合生成二聚体或多聚体.肖君[26]的研究发现外加有机C源可以增强异化金属还原菌的活性,从而可以促进异化Mn(IV)还原过程对有机物的降解,而这一作用对不同有机药物产生不同的影响效果则可能与有机药物自身特有的分子结构相关[25].
如图5,进水外加有机C源及反应器内添加MnO2条件下,有菌组和无菌组对CBZ的平均去除率分别为53.89%和40.10%,对DCF的平均去除率分别为31.95%和16.48%.有菌组对CBZ和DCF的去除率均显著大于无菌组(<0.05),说明了异化Mn(IV)还原耦合降解CBZ和DCF的效果均为显著.
本试验结果与试验二结果相比,无菌组对CBZ的平均去除率分别上升了24.01%和9.13%;有菌组对CBZ和DCF的平均去除率分别上升了28.66%和10.18%,其中由异化Mn(IV)还原贡献的CBZ去除率上升了4.63%(由9.16%提高到13.79%),DCF去除率则基本持平(由14.42%变为15.47%).2次试验对比,说明了在反应器的天然锰矿填料中添加MnO2会使反应器对CBZ及DCF的吸附氧化作用显著增加,同时添加MnO2也增强了异化Mn(IV)还原耦合降解CBZ的效果.Liu等[27-28]也通过实验研究证明了缺氧条件下,MnO2可以有效去除DCF,并根据实验结果,确定了最佳操作条件为中性(pH值7.0左右),中温 (10~30℃),MnO2:DFC物质的量比约2200:1等.此外相关研究[29-31]也表明MnO2已被广泛研究作为土壤、沉积物、海洋环境等多种环境中的氧化剂,对包括抗菌剂,内分泌干扰物等在内的多种有机污染物都具有良好的氧化作用.而添加MnO2对异化Mn(IV)还原耦合降解有机物的影响则可能与目标有机物的分子结构有关[25,32].
3 结论
3.1 以乙酸钠为C源,从嘉陵江淡水沉积物中富集得到异化Mn(IV)还原菌群,由Logistic模型模拟得到其最大Mn(IV)还原速率max为0.47mg/(g×d),对应时间为4.38d.
3.2 进水中无外加C源下,异化Mn(IV)还原过程去除DCF的效果优于CBZ,分别为14.87%和2.81%.
3.3 进水中外加乙酸钠为C源时, 异化Mn(IV)过程还原对CBZ的去除率可提高到9.16%,但对DCF的去除无明显影响.
3.4 进水外加乙酸钠为C源且反应器中加MnO2时,异化Mn(IV)还原过程对CBZ的去除率提高到13.79%,但对DCF的去除无明显影响.
[1] Li Z, Zlabek V, Velisek J, et al. Acute toxicity of carbamazepine to juvenile rainbow trout (Oncorhynchus mykiss): Effects on antioxidant responses, hematological parameters and hepatic Erod [J]. Ecotoxicology and Environmental Safety, 2011,74(3):319-327.
[2] Kawabata K, Sugihara K, Sanoh S, et al. Photodegradation of pharmaceuticals in the aquatic environment by sunlight and UV-A, -B and -C irradiation [J]. Journal of Toxicological Sciences, 2013,38(2): 215-223.
[3] Guiloski I C, Stein Piancini L D, Dagostim A C, et al. Effects of environmentally relevant concentrations of the anti-inflammatory drug diclofenac in freshwater fish Rhamdia quelen [J]. Ecotoxicology and Environmental Safety, 2017,139:291-300.
[4] 蒋科伟,刘敏敏,曾 超.环境中的药物来源、归趋及环境影响分析 [J]. 环境工程技术学报, 2015,5(6):539-544. Jiang K W, Liu M M, Zeng C. Analyses on Source, Fate and Environmental Impact of Pharmaceuticals in Environment [J]. Journal of Environmental Engineering Technology, 2015,5(6):539-544.
[5] Ferrari B, Paxeus N, Lo Giudice R, et al. Ecotoxicological impact of pharmaceuticals found in treated wastewaters: study of carbamazepine, clofibric acid, and diclofenac [J]. Ecotoxicology and Environmental Safety, 2003,56(3):450.
[6] 孙继成,吴志超,王志伟,等.电化学耦合膜工艺去除饮用水中卡马西平 [J]. 中国环境科学, 2018,(1):193-201. Sun J C, Wu Z C, Wang Z W, et al. The electrochemical coupled membrane process for the removal of CBZ in drinking water [J]. China Environmental Science, 2018,(1):193-201.
[7] Vieno N, Sillanpää M. Fate of diclofenac in municipal wastewater treatment plant-a review [J]. Environment International, 2014,69(30): 28-39.
[8] 夏文君,徐 劼,刘 锋,等.秸秆生物炭对双氯芬酸钠的吸附性能研究 [J]. 中国环境科学, 2019,39(3):160-166. Xia W J, Xu J, Liu F, et al. Adsorption of diclofenac on straw-biochar [J]. China Environmental Science, 2019,39(3):160-166.
[9] Lonappan L, Brar S K, Das R K, et al. Diclofenac and its transformation products: Environmental occurrence and toxicity - A review [J]. Environment International, 2016,96:127-138.
[10] Zhang Y, Geissen S, Gal C. Carbamazepine and diclofenac: Removal in wastewater treatment plants and occurrence in water bodies [J]. Chemosphere, 2008,73(8):1151-1161.
[11] Ternes, T.A., Occurrence of drugs in German sewage treatment plants and rivers [J]. Water Research, 1998,32(11):3245-3260.
[12] Benoǐt F, Mons R , Vollat B , et al. Environmental risk assessment of six human pharmaceuticals: Are the current environmental risk assessment procedures sufficient for the protection of the aquatic environment [J]. Environmental Toxicology and Chemistry, 2004, 23(5):1344.
[13] Wang J, Wang S. Removal of pharmaceuticals and personal care products (PPCPs) from wastewater: A review [J]. Journal of Environmental Management, 2016,182:620-640.
[14] Liu W, Sutton N B, Rijnaarts H H M, et al. Anaerobic biodegradation of pharmaceutical compounds coupled to dissimilatory manganese (IV) or iron (III) reduction [J]. Journal of Hazardous Materials, 2018. DOI:10.1016/j.jhazmat.2018.04.078.
[15] Alette L , Nadia I , Teun V , et al. Microbial Removal of the Pharmaceutical Compounds Ibuprofen and Diclofenac from Wastewater [J]. Biomed Research International, 2013,2013:1-9.
[16] Zhai J, Wang Q, Li Q, et al. Degradation mechanisms of carbamazepine by δ-MnO2: Role of protonation of degradation intermediates [J]. Science of The Total Environment, 2018,640-641: 981-988.
[17] Ye Y, Feng Y, Bruning H, et al. Photocatalytic degradation of metoprolol by TiO2nanotube arrays and UV-LED: Effects of catalyst properties, operational parameters, commonly present water constituents, and photo-induced reactive species [J]. Applied Catalysis B-environmental, 2018,220:171-181.
[18] Lovley D. Dissimilatory Fe(III)-and Mn(IV)-Reducing Prokaryotes [M]. Prokaryotes, 2006:635-658.
[19] 《水和废水监测分析方法》[M]. 北京:中国环境科学出版社, 2002:370-372. Water and Wastewater Monitoring and Analysis Methods [M]. Beijing: China Environmental Science Press, 2002:370-372.
[20] Dolores C M O, Julia M, Juan Luis S, et al. An affordable method for the simultaneous determination of the most studied pharmaceutical compounds as wastewater and surface water pollutants [J]. Journal of Separation Science, 2015,32(18):3064-3073.
[21] 周 康.食品微生物生长预测模型研究新进展 [J]. 微生物学通报, 2008,35(4):589-594. Zhou K. New Advances in Predictive Food Microbial Growth Model [J]. Microbiology China, 2008,35(4):589-594.
[22] 易维洁,曲 东,黄婉玉,等.淹水培养时间对水稻土中Fe(Ⅲ)异化还原能力的影响 [J]. 农业环境科学学报, 2010,29(9):1723-1729. Yi W J, Qu D, Huang W Y, et al. Effect of Flooding Time on Dissimilatory Iron(Ⅲ) Reduction in Paddy Soil [J]. Journal of Agro-Environment Science, 2010,29(9):1723-1729.
[23] 金圣圣,张丽梅,贺纪正.锰氧化物与环境中有机物的作用及其在环境修复中的应用 [J]. 环境科学学报, 2008,(12):2394-2403. Jin S S, Zhang L M, He J Z. Review of reactions of manganese oxides with organic compounds and applications of MnOxin environmental remediation [J].Acta Scientiae Circumstantiae, 2008,(12):2394-2403.
[24] 廖汝娥,于志强,高 娜,等.二氧化锰体系中环丙沙星的氧化转化研究 [J]. 生态环境学报, 2011,20(Z1):1143-1146. Liao R E, Yu Z Q, Gao N, et al. Oxidative transformation of ciprofloxacin in the presence of manganese oxide [J].Ecology and Environmental Sciences, 2011,20(Z1):1143-1146.
[25] 杨梦丽.厌氧锰矿反应柱对水环境中典型PPCPs的去除效果和机理研究 [D]. 重庆:重庆大学, 2016. Yang M L. Research on typical PPCPs removal effect and mechanism by manganese ore columnar reactor in anaerobic condition [D]. Chongqing: Chongqing Universty, 2016.
[26] 肖 君.锰矿石人工湿地甲烷消减及碳的归趋途径研究 [D]. 重庆:重庆大学, 2017. X J. Study on the reduction of methane and carbon removal pathways in the constructed wetland of manganese ore [D]. Chongqing: Chongqing Universty, 2017.
[27] Liu W, Langenhoff A A M, Sutton N B, et al. Application of manganese oxides under anoxic conditions to remove diclofenac from water [J]. Journal of Environmental Chemical Engineering, 2018,6(4): 5061-5068.
[28] Liu W, Sutton N B, Rijnaarts H H M, et al. Anoxic conditions are beneficial for abiotic diclofenac removal from water with manganese oxide (MnO2) [J]. Environmental Science and Pollution Research, 2018,25(10):10141-10147.
[29] Remucal C K , Ginder-Vogel M . A critical review of the reactivity of manganese oxides with organic contaminants [J]. Environmental Science: Processes & Impacts, 2014,16(6):1247-1266.
[30] Balgooyen S, Alaimo P J, Remucal C K, et al. Structural Transformation of MnO2during the Oxidation of Bisphenol A [J]. Environmental Science & Technology, 2017,51(11):6053-6062.
[31] Forrez I, Carballa M, Verbeken K, et al. Diclofenac oxidation by biogenic manganese oxides [J]. Environmental Science & Technology, 2010,44(9):3449-3454.
[32] Jin X, Wang F, Gu C, et al. The interactive biotic and abiotic processes of DDT transformation under dissimilatory iron-reducing conditions [J]. Chemosphere, 2015,138:18-24.
Degradation of carbamazepine and diclofenac via dissimilatory Mn(IV) reduction.
ZHAI Jun*, HU Wei, WANG Quan-feng, YIN Xue-jiao, CHEN Ni
(Key Laboratory of the Three Gorges Reservoir Region’s Eco-Environment, Chongqing University, Chongqing 400045, China)., 2021,41(4):1704~1710
In this paper, the degradation of two target pharmaceuticals, carbamazepine (CBZ) and diclofenac (DCF), via dissimilatory Mn(IV) reduction was investigated in an anaerobic biological filter filling with manganese ores. The sediment from Jialing River was used as inoculum of the filter. Effects of extra organic carbon (sodium acetate) and adding extra MnO2on degradation were also studied. The results indicated that the anaerobic biofilter column could achieve 25.23% and 32.44% removal of CBZ and DCF from 10µg/L, respectively, with no extra sodium acetate or MnO2added. The contribution of dissimilatory Mn(IV) reduction to total CBZ removal was only 2.81% while that to DFC was 14.87%. Adding 0.5g/L of sodium acetate or 25g of MnO2could improve the removal efficiency of CBZ by 6.35% and 4.63%, respectively, through dissimilatory Mn(IV) reduction, while no significant effect on the DCF removal was observed. This study could provide a new idea for the degradation of resistant organic pharmaceuticals.
carbamazepine;diclofenac;dissimilatory manganese reduction
X703.1
A
1000-6923(2021)04-1704-07
翟 俊(1977-),男,江苏溧阳人,教授,博士,从事废水处理理论与技术研究.发表论文100余篇.
2020-08-15
国家自然科学基金资助项目(51478062&51878093)
* 责任作者, 教授, zhaijun@cqu.edu.cn
