五味子甲素对前列腺癌骨转移PC-3细胞增殖、迁移和侵袭的影响及作用机制研究
2021-04-30黄胜龚蕊刘赣赣漆启华黄帅
黄胜 龚蕊 刘赣赣 漆启华 黄帅
1南昌大学第一附属医院骨科(南昌330006);2江西卫生职业学院临床医学系(南昌330052);3广州医科大学第二附属医院骨科(广州510260)
前列腺癌(prostate cancer,PCa)是发达国家中男性泌尿生殖系统最常见的恶性肿瘤,是全球范围内男性发病率最高的肿瘤[1]。我国前列腺癌发病率也呈逐年上升趋势。骨组织是前列腺癌最易发生转移的部位,大约有84%晚期前列腺癌患者最终发生骨转移[2]。目前,针对前列腺癌骨转移的治疗多为姑息性治疗,主要包括以内分泌治疗和化疗为主的全身治疗,以及针对骨转移的局部治疗,如手术、放疗、双膦酸盐和骨靶向治疗等。尽管早期筛查,诊断技术提高和放化疗降低了前列腺癌患者的死亡率,但治疗癌症的药物所产生的副作用严重影响了患者的生存质量。因此,寻找疗效好、毒副作用小的理想药物,对晚期前列腺癌的治疗具有非常重要的意义,也是目前医药学研究的热点。
五味子甲素(deoxyschizandrin)是从五味子中提取的一种木脂素类化合物,是中药五味子的有效成分之一[3]。五味子甲素具有护肝、抗炎、抗凝血、防护肾损伤、抗抑郁及抑制胃肠平滑肌收缩等作用[4-6]。最新研究表明,五味子甲素在多种肿瘤治疗方面有潜在的应用价值,如甲状腺癌[7]、肠癌[8]及乳腺癌[9]等。然而,五味子甲素对前列腺癌细胞增殖、迁移和侵袭的影响及作用机制仍不清楚。
miRNAs 是一类内源性非编码微小RNA(长约18-22nt),通过与靶基因3′-UTR 的miRNA 识别元件结合,转录后抑制或降解mRNA,从而在很多肿瘤的发生发展过程中发挥关键作用[10-12]。研究报道,五味子甲素的抗癌作用与miRNAs 的调控密切相关,如miR-155[9]、miR-195[8]和miR-429[7]等。笔者前期研究发现,miR-505-3p 通过直接靶向SMAD2 和SMAD3,抑制TGF-β信号通路的活性,从而抑制前列腺癌细胞的侵袭和迁移能力[13]。因此,笔者推测五味子甲素是否通过调控miR-505-3p 来影响前列腺癌细胞的增殖、迁移及侵袭。因此,本研究旨在研究五味子甲素对PC-3 细胞体外增殖、迁移及侵袭的影响,并进一步探讨其是否通过影响miR-505-3p 表达来调控TGF-β信号转导通路,从而抑制前列腺癌体外转移,为五味子甲素在前列腺癌的临床应用提供理论依据。
1 材料与方法
1.1 材料及主要试剂人前列腺癌PC-3 细胞系购自美国模式菌种收集中心(ATCC);五味子甲素购自武汉慧诚益通生物公司;6 周龄雄性BALB/c裸鼠购自中山大学实验动物中心;RPMI 1640 培养基、胎牛血清和胰蛋白酶购自美国HyClone 公司;CCK-8 细胞活性检测试剂盒和BCA 蛋白浓度测定试剂盒购自上海碧云天生物技术有限公司;Tranwell 小室购自美国Millipore 公司;Matrigel 胶购自美国BD 公司;逆转录试剂盒和PCR 试剂盒购自广州复能基因有限公司;Lipofectamine 2000 和miR-505-3p inhibitor 购于广州锐博生物科技有限公司;SMAD2、SMAD3、pSMAD2/3、SMAD2/3 和GAPDH抗体购自美国Cell Signaling Technology 公司;p84抗体购自美国Invitrogen。
1.2 CCK-8 检测细胞增殖将PC-3 细胞以每孔100 μL(2 × 104个/孔)接种于96 孔培养板,细胞贴壁后加入浓度为0、5、10、20、40、80 μmol/L 的五味子甲素,每组设5 个复孔,孵育24 h 后每孔加入10 μL CCK-8 试剂,酶标仪检测波长在450 nm 处的吸光度值。用15 μmol/L 的五味子甲素处理PC-3细胞,分别培养0、1、2、3、5 d,每孔加入10 μL CCK-8 试剂,多功能酶标仪检测各孔的吸光度值(450 nm)。
1.3 qRT-PCRTRIzol 试剂提取样品的总RNA,使用逆转录试剂盒合成miRNA 和mRNA 的cDNA。随后,使用RT-PCR 试剂盒在Bio-Rad CFX96TM上进行PCR 扩增。以U6 或GAPDH 为参照,用2-ΔΔCq法分析miRNA 和mRNA 的相对表达水平。所用引物序列如下:U6 上游引物:5′-CTCGCTTCGGCAGCACA-3′,下游引物:5′-AACGCTTCACGAATTTGCGT-3′;miR-505-3p 上游引物:5′-CTACGTGGGTCACCCCCTC-3′,下游引物:5′-CCAAAGGAGACCTCGTAGT-3′;GAPDH 上游引物:5′-ACAACTTTGGTATCGTGGAAGG-3′,下游引物:5′-GCCATCACGCCACAGTTTC-3′;IL-11 上游引物:5′-TGAAGACTCGGCTGTGACC-3′,下游引物:5′-CCTCACGGAAGGACTGTCTC-3′;PTHRP 上游引物:5′- ACTCGCTCTGCCTGGTTAGA-3′,下游引物:5′-GGAGGTGTCAGACAGGTGGT-3′;CTGF 上游引物:5′-GCTACCACATTTCCTACCTAGAAATCA-3′,下游引物:5′-GACAGTCCGTCAAAACAGATTGTT-3′。
1.4 细胞转染将PC-3 细胞接种于6 孔板中(3×105/孔),置于37 ℃,5%CO2培养箱中培养,当细胞生长融合至50%~60%,准备转染;按照制造商的说明使用Lipofectamine 2000 进行miR-505-3p inhibitor 的转染。
1.5 Transwell 检测细胞迁移及侵袭不同浓度的五味子甲素处理PC-3 细胞24 h 后,胰蛋白酶消化后重悬,将200 μL 细胞悬液(1×106个/mL)接种于Transwell 小室的上室,并将含10%FBS 的培养基加入下室,然后置入37 ℃培养箱中培养24 h。取出Transwell 小室,用4%多聚甲醛固定并用结晶紫染色。湿棉签小心擦去上室基底膜上表面的细胞,洗净残余的染色液,晾干,显微镜下随机取五个视野中进行拍照及计数。不使用Matrigel 基质胶覆盖Transwell 细胞小室时检测细胞迁移,而在使用Matrigel 基质胶覆盖Transwell 细胞小室的情况下检测细胞侵袭。
1.6 Western blot 检测将PC-3 细胞均匀接种于6 孔培养板中,24 h 细胞贴壁后,加入不同药物浓度的五味子甲素处理48 h。RIPA 裂解液提取处理后细胞蛋白,并用BCA 法进行蛋白定量。通过10% SDS-PAGE 分离等量的蛋白,并将其转移到PVDF 膜上,然后用5%脱脂奶粉封闭1.5 h。加入稀释后的一抗,4 ℃孵育过夜,然后在TBST 洗涤后加入二抗,室温孵育1 h。最后,ECL 法显色曝光。
1.7 裸鼠成瘤模型及处理将0.2 mLPC-3 细胞(1 ×106个)接种于裸鼠背部皮下。待裸鼠肿瘤形成后,挑选瘤体积相近的裸鼠随机分组,分为对照组和五味子甲素治疗组,每组各6 只。其中对照组不给予任何药物,每天给予正常饮食;五味子甲素治疗组,予五味子甲素(500 mg/kg)灌胃给药,1 次/2 d,给药3 周后处死小鼠,剥离出瘤体组织,称重后进行后续实验。
1.8 免疫组化实验将肿瘤组织切片后进行脱蜡处理,酒精梯度水化、抗原修复、内源性过氧化物酶阻断和山羊血清室温封闭后,加入一抗。滴加标记有HRP 的二抗,室温孵育30 min,显色剂显色。苏木精行细胞核复染,乙醇水化及二甲苯透明,中性树胶封片,在光学显微镜下进行阅片和结果判定,并对免疫组化结果进行光密度分析。
1.9 统计学方法SPSS 19.0(SPSS Inc,Chicago,IL,USA)用于统计学分析,所有的实验均重复3 次以上,统计学数据以均数±标准差表示。两组间差异比较采用独立样本t检验。P<0.05 表示差异有统计学意义。
2 结果
2.1 五味子甲素对PC-3 细胞增殖的影响不同浓度的五味子甲素处理PC-3 细胞48 h 后,采用CCK-8 检测细胞增殖情况。随着五味子甲素浓度的升高,PC-3 细胞增殖受到抑制的程度越来越显著(P<0.01),且呈剂量依赖性(图1A)。细胞增殖抑制率的IC50为15.74 μmol/L。将浓度为15 μmol/L的五味子甲素处理PC-3 细胞,检测不同时间点(1、2、3、4、5 d)PC-3 细胞的增殖情况。结果表明,与DMSO 对照组比较,五味子甲素处理2、3、4、5 d对PC-3 细胞的增殖抑制作用差异均有统计学意义(P<0.01,图1B)。
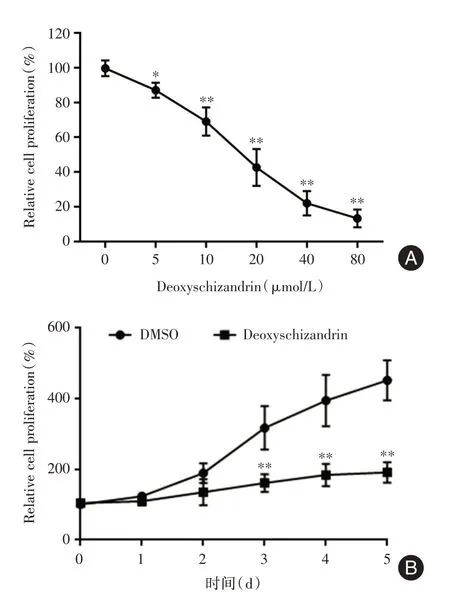
图1 五味子甲素对PC-3 细胞增殖的影响Fig.1 Effect of deoxyschizandrin on proliferation of PC-3 cells
2.2 五味子甲素对PC-3 细胞迁移及侵袭能力的影响Transwell 迁移及侵袭实验结果显示(图2),与对照组相比,用不同浓度五味子甲素处理的PC-3 细胞48 h 后,细胞迁移及侵袭能力明显受抑制,差异有统计学意义(P<0.01),并且这种抑制作用呈剂量依赖性。
2.3 五味子甲素对PC-3细胞miR-505-3p 和TGFβ信号通路的影响qRT-PCR 结果表明,与对照组相比,不同浓度的五味子甲素(5、10、15 μmol/L)处理PCa骨转移PC-3细胞48 h后,miR-505-3p的表达上调(P<0.01),而SMAD2、SMAD3以及TGF-β信号传导的下游靶基因(包括IL-11,PTHRP 和CTGF)的mRNA 表达均降低(P<0.01),并呈浓度依赖性(图3)。Western blot 结果显示,与对照组相比,五味子甲素(15 μmol/L)处理的PC-3 细胞细胞核中SMAD2/3 蛋白表达无显著差异,而细胞核中pSMAD2/3 蛋白表达显著降低(P<0.01,图4)。
2.4 下调miR-505-3p 逆转五味子甲素对PC-3 细胞增殖、迁移及侵袭的抑制作用为了进一步探讨miR-505-3p是否参与五味子甲素对PC-3细胞增殖、迁移及侵袭的抑制作用,五味子甲素(15 μmol/L)处理miR-505-3p inhibitor 转染的PC-3 细胞48 h,分别采用CCK-8 检测细胞增殖、Transwell 检测细胞迁移及侵袭情况。CCK-8 细胞增殖实验结果显示(图5A),与对照组相比,miR-505-3p inhibitor 转染后PC-3 细胞增殖能力增强,且miR-505-3p inhibitor能够逆转五味子甲素对PC-3 细胞增殖的抑制作用,差异有统计学意义(P<0.01)。Transwell 迁移及侵袭实验结果显示(图5B、C),与对照组相比,miR-505-3p inhibitor 转染后PC-3 细胞迁移及侵袭能力增强,且miR-505-3p inhibitor 能够逆转五味子甲素对PC-3 细胞迁移和侵袭的抑制作用,差异有统计学意义(P<0.01)。因此,抑制miR-505-3p 表达后,五味子甲素对PC-3 细胞增殖、迁移及侵袭的抑制作用明显减弱。
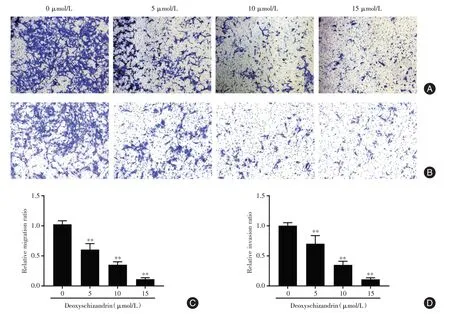
图2 五味子甲素对PC-3 细胞迁移及侵袭能力的影响Fig.2 Effect of deoxyschizandrin on migration and invasion of PC-3 cells
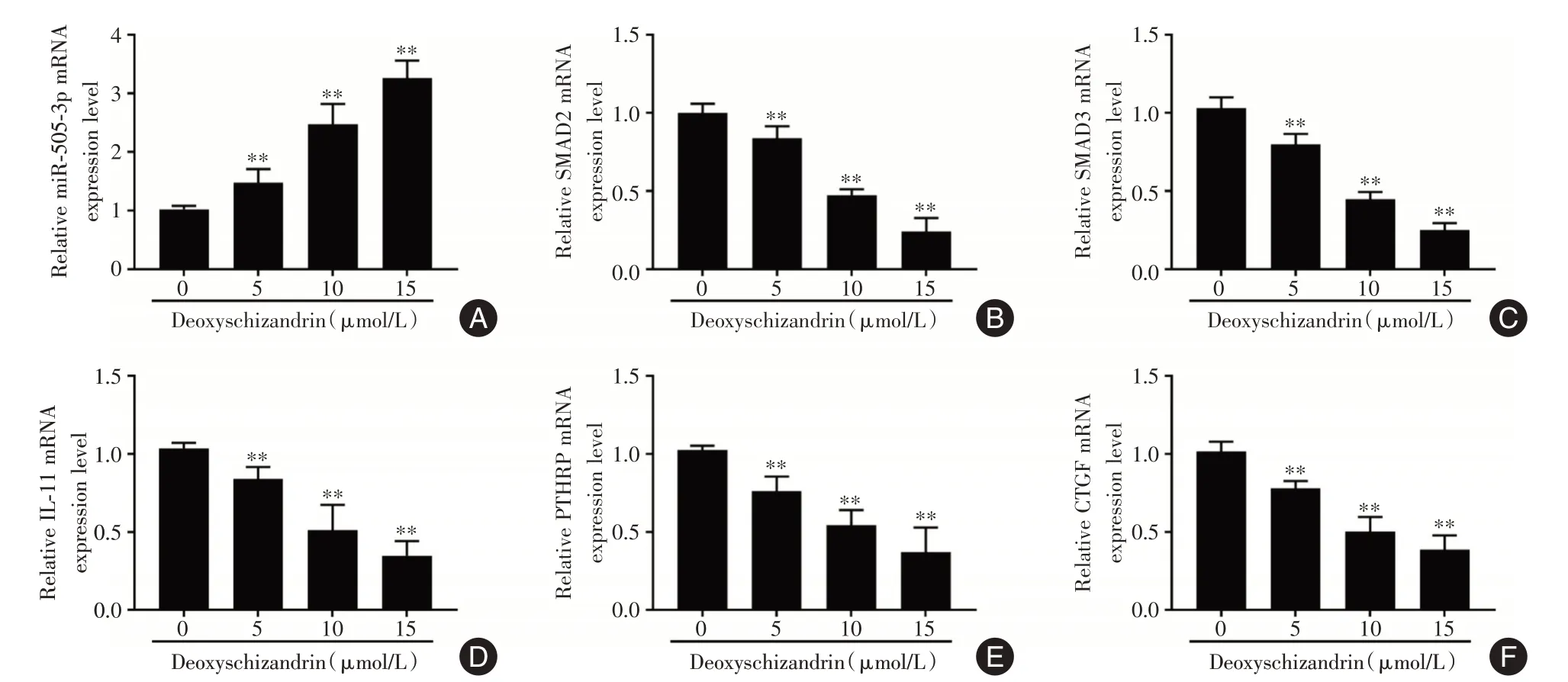
图3 五味子甲素对miR-505-3p 和TGF-β信号通路相关基因表达的影响Fig.3 Effect of deoxyschizandrin on the expression of miR-505-3p and TGF-β signaling pathway-related genes
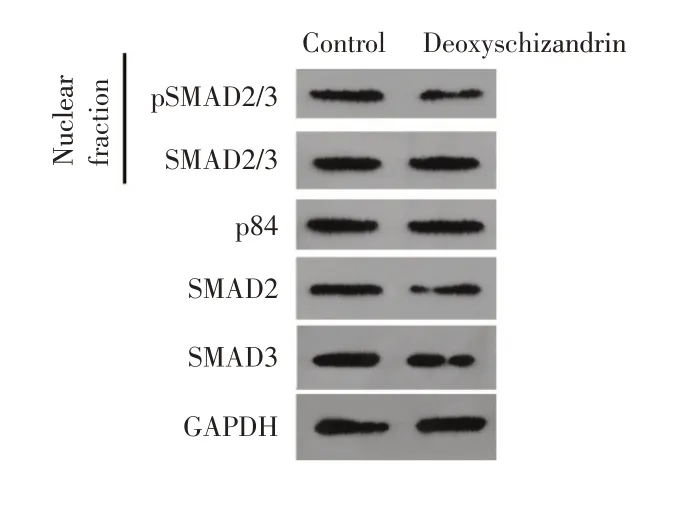
图4 五味子甲素对TGF-β信号通路相关蛋白表达的影响Fig.4 Effect of Deoxyschizandrin on the expression of TGF-β signaling pathway-related proteins
2.5 五味子甲素对荷瘤裸鼠的肿瘤抑制作用及miR-505-3p、SMAD2、SMAD3 表达的影响对荷瘤裸鼠的治疗实验结果显示,对照组的肿瘤重量为(137.7±16.17)mg,而五味子甲素(500 mg/kg)组体积为(23.67 ± 23.67)mg,两组肿瘤重量差异有统计学意义(P<0.01,图6B)。qRT-PCR 检测结果表明,miR-505-3p在五味子甲素组表达水平显著高于对照组组(P<0.01,图6C)。免疫组织化学结果显示(图6A、D、E),SMAD2 和SMAD3 蛋白在五味子甲素组表达水平显著低于对照组(P<0.01)。
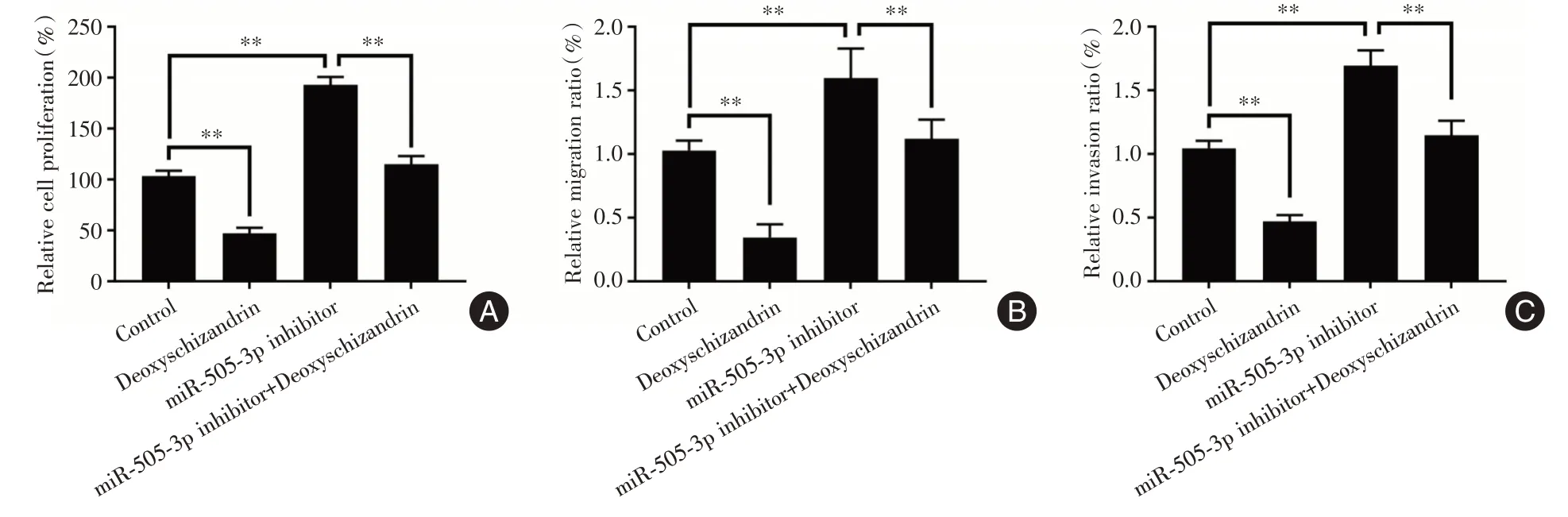
图5 下调miR-505-3p 对五味子甲素作用下PC-3 细胞增殖、迁移及侵袭的影响Fig.5 Effect of knockdown of miR-505-3p on proliferation,migration and invasion of PC-3 cells treated with deoxyschizandrin
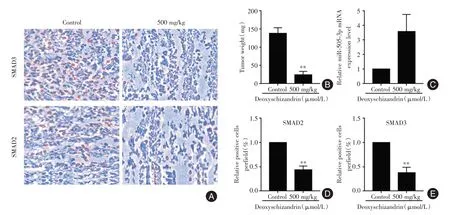
图6 五味子甲素对裸鼠移植瘤的生长抑制及miR-505-3p、SMAD2、SMAD3 表达的影响Fig.6 Effect of deoxyschizandrin on tumor growth and miR-505-3p、SMAD2、SMAD3 expression in nude mouse xenograft model
3 讨论
肿瘤转移是晚期前列腺癌患者的主要并发症,84%患者最终死于肿瘤转移,而骨转移又是前列腺癌最常见的转移部位[2]。目前,针对前列腺癌骨转移的治疗多为姑息性治疗,总体治疗效果并不尽如人意。因此,亟待寻找疗效好、毒副作用小的药物,来缓解晚期前列腺癌患者的痛苦。研究报道,多种中药成分具有抗肿瘤作用,且毒副作用小,已被证明是非常有前景的癌症治疗药物。目前,多种中药及其有效成分展示了良好的抗前列腺癌活性,如松杉灵芝提取物抑制转移性前列腺癌细胞系中的PI3K/Akt 和MAPK/ERK 信号通路,诱导细胞周期停滞并激活半胱天冬酶细胞凋亡途径[14];荔枝种子提取物以剂量依赖方式抑制前列腺癌细胞系的细胞活力和克隆生长,通过失活蛋白激酶B 信号通路,诱导细胞凋亡和细胞周期G1/S 期停滞,同时通过逆转上皮-间质转化的表型抑制细胞迁移和侵袭[15];黄芩提取物抑制前列腺癌细胞系增殖,显著抑制裸鼠移植瘤生长[16]。五味子甲素是从五味子中提取物的一种木脂素类化合物,具有护肝、抗炎、抗凝血、防护肾损伤、抗抑郁、抑制胃肠平滑肌收缩及抗肿瘤等作用[4]。近年来,研究发现五味子甲素在多种癌症中具有潜在抗癌作用[7-9]。本研究发现,五味子甲素作用前列腺癌骨转移PC-3 细胞的IC50为15.74 μmol/L,五味子甲素以剂量和时间依赖方式抑制PC-3 细胞增殖,同时以剂量依赖方式抑制细胞迁移及侵袭,这些提示五味子甲素具有良好的抗前列腺癌活性,具有开发成新型抗肿瘤药物的潜在价值。
miRNAs 被证实在人类很多肿瘤的发生发展过程中起重要作用,如直肠癌、肝癌、肺癌和乳腺癌等[10]。研究报道,五味子叶素的抗癌作用与miRNAs 的调控密切相关。五味子甲素通过下调miR-155 的表达,导致PI3K/AKT 和Wnt/β-catenin信号通路失活,从而抑制乳腺癌细胞系增殖和迁移[9]。五味子甲素通过上调miR-195 的表达,抑制PI3K/AKT 和NF-κB 信号通路,从而增强结肠癌细胞对5-氟尿嘧啶的化疗敏感性[8]。此外,五味子甲素通过下调miR-429 使Wnt/β-catenin 和MEK/ERK信号通路失活,从而抑制甲状腺癌细胞系的增殖、迁移及侵袭[7]。miR-505-3p已经被证实与多种疾病密切相关,包括原发性胆汁性肝硬化,帕金森氏病、炎症性肠病、胰腺癌、胶质瘤和乳腺癌等[17-19]。笔者前期研究发现,miR-505-3p 在伴骨转移的PCa组织中低表达,过表达miR-505-3p 能够抑制PCa细胞的侵袭和迁移能力[13]。但五味子甲素是否能通过上调miR-505-3p 的表达,从而抑制前列腺癌细胞增殖、侵袭和迁移,目前未见文献报道。本研究用不同浓度的五味子甲素处理前列腺癌PC-3 细胞48 h 后,发现五味子甲素以剂量依赖方式上调PC-3细胞中miR-505-3p的表达。此外,本研究用五味子甲素(15 μmol/L)处理miR-505-3p inhibitor 转染的PC-3 细胞,CCK-8 及Transwell 实验结果显示,与对照组相比,miR-505-3p inhibitor 转染后PC-3 细胞增殖、迁移及侵袭能力均增强,而miR-505-3p inhibitor 能够逆转五味子甲素对PC-3 细胞增殖、迁移和侵袭的抑制作用。因此,笔者认为五味子甲素通过上调miR-505-3p的表达,从而抑制前列腺癌骨转移PC-3细胞增殖、迁移及侵袭。
转化生长因子β(Transforming growth factor-β,TGF-β)信号通路参与调控细胞增殖、分化、迁移、粘附、细胞外基质重塑、衰老和凋亡,在胚胎发育、免疫反应、伤口愈合和肿瘤进展等生物学过程中发挥着重要作用[20-21]。TGF-β信号通路在肿瘤进展中具有双重调控作用。在肿瘤生长早期,TGF-β信号通路抑制细胞增殖,并促进细胞凋亡;在肿瘤生长晚期,TGF-β信号通路通过促进血管生成、上皮-间充质转化和免疫逃逸来诱导肿瘤的侵袭和转移[22-23]。研究表明,TGF-β通过诱导EMT 或促进癌细胞的侵袭性而成为PCa 骨转移的关键因素[24-25],靶向TGF-β的疗法可有效减少肿瘤细胞的骨转移[26]。因此,靶向TGF-β信号通路似乎是抑制PCa 骨转移的理想靶标。本研究采用不同浓度的五味子甲素PC-3 细胞48 h 后,qRT-PCR 结果发现,五味子甲素以剂量依赖方式抑制PC-3 细胞中SMAD2、SMAD3 以及TGF-β信号传导的下游靶基因(包括IL-11,PTHRP 和CTGF)的mRNA 表达。Western blot 结果进一步证实,五味子甲素处理的PC-3 细胞细胞核中SMAD2/3 蛋白表达无显著差异,而细胞核中pSMAD2/3 蛋白表达显著降低。笔者前期研究发现,miR-505-3p 通过靶向SMAD2 和SMAD3 抑制TGF-β信号通路的激活,从而抑制PCa细胞的侵袭和迁移[13]。本研究通过构建裸鼠移植瘤模型证实,五味子甲素显著抑制PC-3 细胞裸鼠移植瘤生长;五味子甲素上调肿瘤组织中miR-505-3p 的表达水平,同时抑制肿瘤组织SMAD2 和SMAD3 蛋白的表达。因此,五味子甲素可能通过上调移植瘤组织中miR-505-3p 的表达,抑制TGFβ信号通路,从而抑制移植瘤的生长。
综上所述,本研究发现五味子甲素可能是通过上调miR-505-3p 的表达,靶向下调SMAD2 和SMAD3 来抑制TGF-β通路激活,从而抑制前列腺癌骨转移PC-3 细胞的增殖、迁移和侵袭。
