一种甘露糖醛酸C⁃5差向异构酶的Loop区域结构对酶活性的影响
2021-04-29赵小明阎圣刚
孙 明,李 唐,赵小明,阎圣刚,尹 恒
(1.大连海事大学交通运输工程学院,大连116026;2.中国科学院大连化学物理研究所辽宁省碳水化合物重点实验室天然产物与糖工程研究组,大连116023)
褐藻多糖作为一种天然多糖,具有药物制剂辅料所具备的安全性、溶解性、稳定性和黏性[1];其也可以作为主要添加剂[2],广泛用于糖果、冷冻甜食及其他食品芯、馅的制作中。褐藻多糖是由β⁃D⁃甘露糖醛酸(β⁃D⁃mannuronate,M)和其C5差向异构体α⁃L⁃古罗糖醛酸(α⁃L⁃guluronate,G)两种单体组成的线型聚合物。在褐藻多糖中,M和G的存在形式可能有3种:聚甘露糖醛酸片段(M⁃blocks)、聚古罗糖醛酸片段(G⁃blocks)和甘露糖醛酸⁃古罗糖醛酸混合片段(MG⁃blocks)。褐藻多糖和寡糖中不同的M/G 比值使其具有不同的空间结构[3]和功能[4],如富含M 的褐藻多糖和寡糖具有抗肿瘤、调节免疫等作用[5⁃6],而富含G 的褐藻多糖易与二价阳离子Ca2+形成凝胶[7⁃8],因凝胶具有一定的稳定形状,从而成为良好的药物载体(图1)。

图1 甘露糖醛酸C⁃5差向异构酶的功能以及海藻酸与Ca2+的结合方式Figure 1 The function of mannuronan C⁃5 epimerase and the way of combining alginate with Ca2+
许多棕色固氮菌属(Azotobacter Vinelandii)和假单胞菌属(Pseudomonas)可产生胞外褐藻多糖,在其生物体内首先合成聚甘露糖醛酸片段(M⁃blocks),然后在甘露糖醛酸C⁃5 差向异构酶作用下,部分甘露糖醛酸转变为古罗糖醛酸[9](图1)。目前研究发现,棕色固氮菌属编码7 个胞内(algE1⁃algE7)[11]和1 个周质(al⁃gG)甘露糖醛酸C⁃5 差向异构酶的基因[12]。与之不同的是,假单胞菌属中仅编码一个甘露糖醛酸C⁃5 差向异构酶基因(algG)[10],却同样可以完成同棕色固氮菌属相同的功能,但对其功能的了解相对不明晰。选取来自Pseudomonas syringae 的单模块周质酶Al⁃gG_PSEAM 作为研究对象,通过对其晶体结构进行分析,探究loop439⁃455对其酶活性的影响。
1 材料与方法
1.1 材料
1.1.1 仪器与设备
HITACHI 高速离心机;Bio Tek 全波长酶标仪(美国伯腾仪器有限公司);高分辨核磁共振波谱仪(德国布鲁克公司)。
1.1.2 培养基
LB 培养基:蛋白胨10 g/L;酵母粉5 g/L;NaCl 5 g/L,121 ℃条件下灭菌20 min。降至室温加入氨苄青霉素,至终浓度为100 μg/mL。
DNS(3,5⁃二硝基水杨酸)配制:将酒石酸钾钠溶于70 ℃热水中,加入DNS 和NaOH 溶液;再加入重蒸酚和亚硫酸钠,搅拌溶解,得到DNS 试剂。NaOH 溶液的浓度为2 mol/L;DNS 试剂中,酒石酸钾钠的占比(W/V)为18.2%;DNS 的占比(W/V)为0.63%;NaOH 溶液的体积分数为26.2%;重蒸酚的占比(W/V)为0.5%;亚硫酸钠的占比(W/V)为0.5%。
1.2 蛋白表达与纯化
在北京中美泰和生物技术有限公司进行目的基因AlgG_PSEAM 及其loop439⁃455截短体的合成并成功转入质粒PET21a 中。按照E.coil BL21(DE3)感受态细胞转化操作说明书,将该质粒转化到E.coil BL21(DE3)感受态细胞中,涂布在加有100 μg/mL 氨苄青霉素的LB 平板上,37 ℃培养16 h 后,挑取单克隆接种于10 mL LB(含100 μg/mL 氨苄青霉素)液体培养基中,37 ℃、180 r/min 培养16 h 后接入1 L LB(含100 μg/mL 氨苄青霉素)液体培养基中,37 ℃、180 r/min培养至OD600值0.6 左右,加入异丙基⁃β⁃D⁃硫代半乳糖苷(IPTG)至终浓度0.1 mmol/L,16 ℃、180 r/min 培养24 h。
8 000 r/min 离心10 min,收集细胞,用结合缓冲液(50 mmol/L MES pH 6.4;500 mmol/L NaCl;5%甘油;2 mmol/L MgSO4;1 mmol/L PMSF)重悬细胞,超声破碎(200 W、30 min)后12 000 r/min离心20 min,收集上清液,0.2 μm 滤膜过滤后,将上清液加到结合缓冲液(50 mmol/L MES pH 6.4;500 mmol/L NaCl;5%甘油;2 mmol/L MgSO4)平衡过的镍柱中(填充物为镍⁃琼脂糖凝胶)结合15 min 后,放掉上清液,再用含有0、10 和40 mmol/L 咪唑的缓冲液(50 mmol/L MES pH 6.4;500 mmol/L NaCl;5%甘油;2 mmol/L MgSO4)漂洗柱子3 次,之后用洗脱缓冲液(50 mmol/L MES pH 6.4;500 mmol/L NaCl;5%甘油;2 mmol/L MgSO4;200 mmol/L 咪唑)洗脱,收集洗脱液,采用BCA 法测定蛋白含量,每一步采集样品用于十二烷基硫酸钠⁃聚丙烯酰胺凝胶电泳(Sodium dodecyl sulfate⁃polyacrylamide gel electrophoresis,SDS⁃PAGE)检测。
1.3 1H NMR 检 测AlgG_PSEAM 及 其loop439⁃455 截 短 体的C⁃5差向异构酶活性
取5 μg 酶和5 mg 的褐藻多糖于1 mL pH 8.0 缓冲液中混合,40 ℃反应20 min,沸水煮10 min终止反应。然后冷冻干燥后加入0.5 mL 氘代重水,进行1H NMR检测。检测条件:脉冲程序为zg30,测试温度为70 ℃,扫描宽度为5 000 Hz,扫描延迟为2 s,扫描次数为64次。
1.4 DNS 法检测AlgG_PSEAM 及其loop439⁃455截短体的裂解酶活性
取5 μg 酶和5 mg 的褐藻多糖于1 mL pH 8.0 缓冲液中混合,40 ℃反应40 min,沸水煮10 min 终止反应。然后12 000 r/min 离心1 min,取96 μL 反应液,加入128 μL DNS,沸水煮10 min,冷却至室温加入1.376 mL 水。混匀后取200 μL 加 入96 孔板 中,用酶标仪测波长540 nm 测出吸光度值,以Al⁃gG_PSEAM 对应的吸光度值为对照,测出其loop439⁃455截短体的相对活性。
2 结果与讨论
2.1 AlgG_PSEAM的氨基酸序列分析
采用软件Mega 7.0 对该类异构酶进行序列比对,结果(图2)显示,所有的甘露糖醛酸C⁃5 差向异构酶均含有loop 序列,且催化氨基酸DPHD(E)高度保守[10]。
进一步利用软件PyMOL对蛋白结构进行分析,结果如图3 所示。AlgG_PSEAM 采用右手平行β⁃螺旋折叠,与最初发现的Erwinia chrysanthemi 中的果胶裂解酶结构一致。AlgG_PSEAM 的平行β⁃螺旋结构包括11个完整线圈和1 个不完整的线圈。由图3 可知,每个线圈由3 个β 型折叠片PB1、PB2 和PB3 组成,并且通过匝T1(在PB1 和PB2 之间)、T2(在PB2 和PB3 之间)和T3(在PB3 和PB1 之间)连接在一起[10]。通过图3(b)可看出,AlgG_PSEAM 形成一个凹槽,可容纳底物并对其进行催化。在这个凹槽中,loop439⁃455的存在似乎限制了槽口的大小,对底物的进入起到阻碍作用,进而限制了催化活性。因此通过基因手段除去loop439⁃455,试图将凹槽入口变大,加强酶对底物的催化作用。
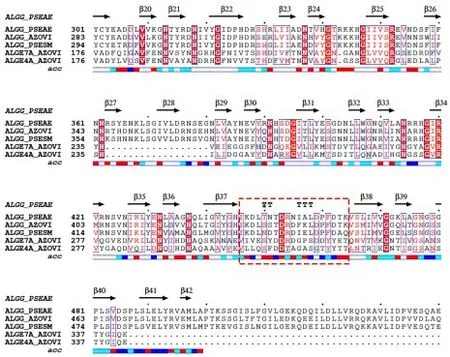
图2 甘露糖醛酸C⁃5差向异构酶氨基酸序列比对图Figure 2 The amino acid sequence comparison of mannuronan C⁃5 epimerase
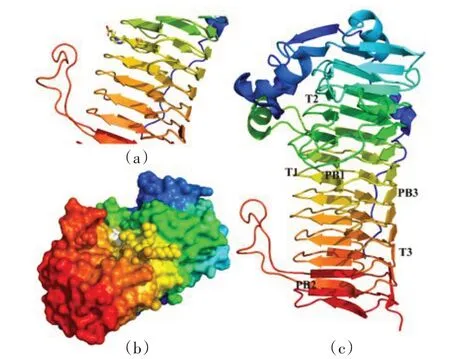
图3 AlgG_PSEAM 的整体结构Figure 3 Overall structure of AlgG_PSEAM
2.2 AlgG_PSEAM及其loop439⁃455截短体的表达纯化
通过基因合成,得到了完整的AlgG_PSEAM 基因序列以及缺失氨基酸序列439-455 IKDLNDT⁃DRDIELDPFD 所对应的基因序列的截短体。将携带质粒PET21a⁃AlgG_PSEAM 和PET21a⁃loop439⁃455截短体的重组大肠杆菌BL21(DE3)经0.1 mmol/L 的IPTG 诱导表达后,经镍柱纯化并将蛋白浓缩至0.5 mg/mL,其SDS⁃PAGE 电泳结果如图4 所示。可以看出该酶在大肠杆菌中能够大量可溶性表达,重组蛋白也能够结合镍柱,一步纯化后就可以得到纯度较高的酶,根据测序得到的氨基酸计算可知,其中AlgG_PSEAM 为54.89 ku,其loop439⁃455截短体为52.87 ku。
2.3 AlgG_PSEAM 及其loop439⁃455截短体C⁃5 差向异构酶活性测定

图4 甘露糖醛酸C⁃5差向异构酶纯化结果Figure 4 Results of purification of mannuronan C⁃5 epimerase
酶与底物反应适当时间后,通过1H NMR 测定G含量的变化并以此评估C⁃5异构酶的活性。按照Gras⁃dalen 等[14]计算单体G(FG),M(FM)以及FGG、FMM、FGM、FMG、FGGG、FMGM、FGGM和FMGG的摩尔分数方法计算得到G 含量的变化。如图5 所示,截去loop439⁃455后,与Al⁃gG_PSEAM 对比,截短体C⁃5 差向异构活性提高了14.7%。loop439⁃455被去除后,凹槽的入口可能因此变大,有利于甘露糖醛酸片段的进入以及与酶的结合。另外当古罗糖醛酸含量增加后,褐藻多糖的空间结构发生变化,底物的空间形状变大,更加不利于进入凹槽与酶发生作用,而loop439⁃455的去除可能解决了该问题。Maika 等[15]正是利用了该思路,通过高通量筛选,鉴定了来自Vibrio fluvialis 的胺转氨酶(ATA)突变体。该突变体使酶具有较宽的底物结合口袋,可以允许2,2⁃二甲基⁃1⁃苯丙⁃1⁃胺的不对称合成,这是任何野生型的ATA 都无法实现的。所以拓宽底物结合口袋对酶的功能以及活性具有较大的影响。
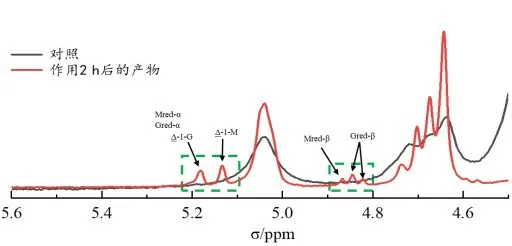
图5 AlgG_PSEAM及其截短体对海藻酸盐孵育前后的1H NMR谱图Figure 5 1H NMR spectra of alginates before and after incubation with AlgG_PSEAM and its truncation
2.4 AlgG_PSEAM 及其loop439⁃455截短体裂解酶功能发现及活性测定
随着反应时间的延长,出现了一些端基峰△⁃1⁃M,△⁃1⁃G,Mred 和Gred,具体如图5。已有研究表明,褐藻多糖裂解酶通过β⁃消除反应降解特定序列的海藻酸盐,可以产生不饱和非还原端4⁃脱氧⁃L⁃赤⁃己⁃4⁃烯吡喃糖基脲酸酯(△)和饱和还原端Mred 和Gred[16]。由此可知,AlgG_PSEAM 还具有海藻酸盐裂解酶的功能。
按照Miller 等[17]描述的方法,通过3,5⁃二硝基水杨酸(DNS)分析检测,再次对裂解酶功能进行测定。实验结果表明,褐藻多糖与AlgG_PSEAM 作用后,随着时间的延长,还原糖的含量不断增加,因此证明了裂解酶功能的存在。图6显示,截去loop439⁃455后,褐藻多糖裂解酶的活性提高了23.3%,说明loop439⁃455的存在也限制了AlgG_PSEAM的裂解酶活性。
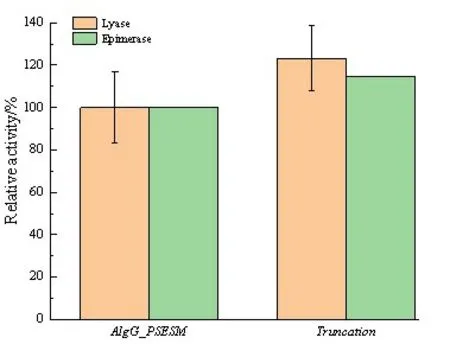
图6 AlgG_PSEAM及其截短体的裂解酶及其异构酶活性Figure 6 The lyase and epimerase activity of AlgG_PSEAM and its truncation
迄今为止,关于具有多功能特性的甘露糖醛酸C⁃5 差向异构酶的报道依旧较少。AlgG_PSEAM 具有褐藻多糖裂解酶活性的生物学意义,可能与其囊肿的形成有关[18],在不同的生长时期,菌株或者藻类对褐藻多糖的需求不同。另外部分菌株或者菌株的寄主可能以褐藻多糖为食物,该酶对其进行降解后有利于食者进行消化和吸收[19]。
3 结论
本实验以来自Pseudomonas syringae的一种甘露糖醛酸C⁃5 差向异构酶AlgG_PSEAM 及其loop439⁃455截短体为研究对象,对其氨基酸序列以及晶体结构进行分析,发现loop439⁃455的存在可能影响了酶与底物的结合,因此将AlgG_PSEAM 及其loop439⁃455截短体基因在大肠杆菌中异源表达。通过纯化得到了两个纯度较高的酶,测定其异构酶活性,发现loop439⁃455失去后,甘露糖醛酸C⁃5 差向异构酶活性得到了提高。意外的是,随着反应时间的延长,该酶显示出裂解酶活性,并且失去loop439⁃455后,裂解酶的活性也得到了提高。根据这两种现象猜测,可能是由于loop439⁃455被去除后,反应槽的入口因此变大,有利于甘露糖醛酸片段的进入,使得更多的底物与酶进行结合,从而增加了产物的量。另外当古罗糖醛酸含量增加后,褐藻多糖的空间结构发生变化,底物的空间形状变大,loop439⁃455的去除更加有利于底物的进入并且与酶发生作用。因此,截去loop439⁃455可同时提高AlgG_PSEAM 的甘露糖醛酸C⁃5差向异构酶和褐藻多糖裂解酶活性。
