Pax3和Pax7在胚胎发育早期及神经嵴形成中的作用
2021-04-29李云晓杨慈清林俊堂
李云晓,杨慈清,3,林俊堂
(1.新乡医学院生命科学技术学院,新乡453003;2.河南省干细胞与治疗工程研究中心,新乡453003;3.河南省医用组织再生重点实验室,新乡453003)
Pax 基因(Paired box gene)是一类进化上保守的转录因子家族,它们参与机体内的细胞信号传导和靶基因的转录调控。脊椎动物生长发育过程与Pax 基因功能调控紧密相关,正常表达Pax基因动态调控发育相关基因转录、促进细胞增殖与自我更新、抑制细胞凋亡、诱导前体细胞定向迁移与分化。在中枢神经系统中,Pax基因在细胞和区域指定、增殖、祖细胞维持、抗凋亡和神经分化等方面发挥重要作用。脊椎动物中Pax 基因在进化上是保守的,基因序列与昆虫、两栖动物和鸟类中具有高度同源性。研究发现,脊椎动物中Pax基因家族共9 个成员(Pax1-Pax9),不同Pax 成员协同调控同一器官或组织的正常生长发育和形态建成[1]。
Pax 家族蛋白都包括一个结合DNA 序列的成对结构域(Paried DNA-binding domain,PD)和一个转录激活结构域(Transactivation domain,TD)。部分成员还包括一个结合DNA 序列的同源结构域(Home-do⁃main,HD)和一个连接PD 和HD 的八肽(Octapeptide,OP)结构。基于DNA 结构、序列相似性和功能组,Pax家族蛋白被分为4 个亚家族。亚家族I(Pax1 和Pax9)由成对结构域和八肽组成,亚家族II(Pax2、Pax5 和Pax8)由成对结构域、部分同源结构域和八肽组成。亚家族III(Pax3 和Pax7)由成对结构域、完全同源结构域和八肽组成,亚家族IV(Pax4 和Pax6)由成对和完全同源结构域组成。
Pax3和Pax7是Pax蛋白家族中仅有的两个包含所有结构的成员(图1),基于高度的序列同源性和相似的基因组和功能组[2],二者同属于第三亚家族,功能上与神经和肌肉发育密切相关。过去有关Pax3 和Pax7的研究工作主要集中在肌肉发生发育,对其在神经发育早期的功能探讨并不深入。本文主要针对Pax3 和Pax7 在胚胎发育早期的功能,特别是二者对神经嵴发生发育的调控机制的最新研究进展作简要的概述。
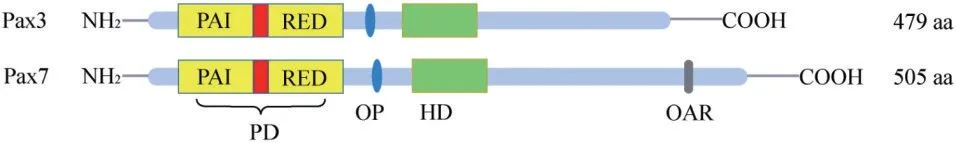
图1 Pax3和Pax7的蛋白结构示意图Figure 1 Schematic diagram of protein structure of Pax3 and Pax7
1 Pax3和Pax7概述
1.1 Pax3的结构与生物学功能
人类Pax3 基因位于2 号染色体长臂的q36.1 区域,由8 个外显子组成,编码由479 个氨基酸残基组成的蛋白质,分子量为53 ku。人Pax3 蛋白与小鼠Pax3蛋白的同源性为98%。Pax3蛋白的主要结构包括一个N端DNA结合域和一个C端转录激活结构域。DNA结合域由成对结构域(PD)、八肽(OP)和同源结构域(HD)组成,转录激活结构域(TD)含有一个78 个氨基酸的富含脯氨酸、丝氨酸和苏氨酸(PST)的区域。PD由128 个氨基酸组成,包括PAI 和RED 两个亚区,在进化上非常保守。每个亚域都由一个三螺旋折叠组成,其中包括一个螺旋-转角-螺旋(HTH)基序,每个HTH的C 端螺旋在DNA 的主沟中进行碱基特异性结合[3]。HD 的长度为60 个氨基酸,包含3 个α-螺旋。Pax3 和另外3 个Pax 成员(Pax4、Pax6 和Pax7)具有这个DNA结合域。HD和PD结构域之间联系密切且存在协同作用,这是这两个结构域在DNA 结合中功能相互依赖的原因。
小鼠和人类Pax3 基因的突变分别导致斑点(Splotch)突变表型和WaardenburgⅠ型综合征,纯合的Splotch 胚胎具有严重的神经嵴细胞(NCC)缺陷,从而产生包括脊柱裂、脑外畸形和心脏流出道异常在内的复杂表征[4];WaardenburgⅠ型综合征的特征为先天性感音神经性耳聋、眼角异位和虹膜色素异常等[5]。Pax3还被发现与肿瘤的发生相关,在胶质母细胞瘤、神经母细胞瘤、黑色素瘤、横纹肌肉瘤和胃癌中表达上调[6]。Liang 等[7]通过免疫共沉淀(Co-immunoprecipi⁃tation,CO-IP)实验证实,Pax3 过表达促进人神经胶质瘤细胞增殖和细胞周期进程,同时通过改变与Wnt信号通路相关的重要分子β-catenin、Myc、VEGF、cy⁃clinD1、MMP7 和Wnt1 的表达而抑制细胞凋亡。这些研究表明,Pax3 作为转录因子与组织分化和肿瘤发生发展密切相关。
1.2 Pax7的结构与生物学功能
Pax7 基因定位于人染色体1p36.13 和小鼠的第4条染色体。其编码区域由8 个外显子组成,和Pax3 基因相应的外显子位置和长度相似。Pax7 蛋白由505 个氨基酸残基编码,结构和Pax3 蛋白类似,含有PD、TD、HD 和OP 区域。其羧基端比高度相关的Pax3 蛋白多47 个氨基酸。功能分析表明,成对结构域由外显子2、3、4 编码,而同源结构域由外显子5 和6 编码,外显子6、7、8 编码转录激活结构域。Pax7 和Pax3 显示高度同源的N-末端区域,包含配对结构域、八肽结构域和同源结构域。这个N-末端结构域介导DNA结合特性,由此推测Pax3 和Pax7 可能结合相似的基因。同时Pax7在该家族中是独一无二的,因为C-末端存在一个14 个氨基酸序列,即OAR(Otp/Aristaless/Rax)序列,它存在于多个配对型HD 蛋白中,但仍然没有明确的活性[8]。
在人类中,Pax7 在背侧神经管和年轻胚胎早期迁移的神经嵴细胞中表达。Proskorovski-Ohayon 等[9]通过连锁分析和外显子全序列测定,证明了Pax7 纯合子突变导致常染色体隐性人类综合征,导致患者出现发育不全、轴性低张力和严重的全身神经发育迟缓,并伴有小头畸形、锥体体征、肌张力障碍、癫痫、易怒和自残等症状。在小鼠中,Pax7杂合子突变具有正常表型和生育能力,但纯合子发育到足月后,在出生3周内死亡。对Pax7突变小鼠的分析表明,在所有的突变个体中,主要是面部骨骼结构受到影响,这可能与颅神经嵴细胞缺陷有关[10]。因为颅神经细胞向背侧迁移到头部区域,产生神经元、胶质细胞和颅面间充质细胞,还有各种结缔组织肌肉、骨骼和软骨等。综上所述,Pax7是神经管和神经嵴发育的关键转录因子,不同形式的突变会对生命体造成严重的遗传损伤甚至是生命危险。
2 Pax3和Pax7在胚胎发育早期的表达
2.1 Pax3与神经管发育
在神经系统形成阶段,Pax3 在神经皱褶、神经管背部、神经嵴细胞和体节中表达,调节这些组织中影响增殖、维持、分化和运动的靶基因的表达。Pax3 最初在小鼠胚胎期8.5 d 的神经沟的背侧区域表达。随着神经沟的加深和闭合,继续在神经管的背侧区域表达,这种表达沿着神经管从前脑延伸到后脑神经孔。随着神经管的增厚,Pax3 主要表达于心室内区的增殖细胞,并随着这些细胞的迁移而表达下调。在E12-13 d,随着神经管的发育,Pax3的表达在神经管尾部结束。
在小鼠中,Pax3在脊髓背侧的神经发育早期被诱导,并在随后的模式化过程中保持不变,导致组织分为背侧和腹侧两个亚区,而神经管在胚胎发育第8 天开始关闭,主要由放射状定向的未分化柱状上皮细胞组成。研究表明,Pax3 的功能是维持神经上皮处于增殖、未分化状态,使神经形成得以正常进行。胚胎发育早期,Pax3 功能缺失可能会导致胚胎神经管背侧上皮细胞增殖减少,这直接诱发未来中脑神经元的过早分化。Pax3 在神经管闭合过程中也发挥了关键作用,Pax3突变和缺失的小鼠胚胎既表现出脊柱裂又表现出脑外畸形[11]。Wang等[12]证实在神经管闭合阶段Pax3表达降低导致p53 依赖性细胞凋亡的抑制,可能与人类神经管缺陷(Neural tube defects,NTDs)的发生有关。这一发现为Waardenburg 综合征和NTDs 相关疾病的治疗提供了新的靶点。
2.2 Pax7与上丘脑/视顶盖的发育
在鸡胚发育过程中,Pax7 最早被发现在HH5 时期外胚层的神经板边缘表达。Pax7 表达了许多交替转录物,这些转录物被认为负责引导胚胎细胞沿着神经源性或肌源性组织分化,参与中枢神经系统和骨骼肌的发育。Pax7在中枢神经系统发育早期起作用,以建立神经管的背极性。表达不断细化最终导致Pax7在中脑背侧,特别是在上丘脑(与禽类的视顶盖同源)中发挥作用。随着上丘/视顶盖的发育,Pax7在迁移的神经细胞中表达,这些神经细胞集中在视神经投射到的背侧视网膜接受层浅层[13]。
Pax7作为主控基因,促进了上丘/视顶盖组织的形成。最初Pax7作用于中脑的翼板,接着是中脑背侧的视顶盖。雏鸡和鹌鹑之间的移植实验表明,视顶盖形成的关键取决于诱导和维持Pax7 的表达以及抑制Pax6 的表达。将鸡中脑底板移植到视顶盖导致Pax7的抑制和视顶盖区域向腹侧扩张。此外,Pax7在鸡间脑中的异常表达导致视顶盖相关基因Fgf8、En-2、Pax3 和Pax7 的内源性表达,随后形成异位视顶盖。Pax7 在间脑中诱导的视顶盖相关基因通常不是内源性表达的,再加上Pax7在中脑翼板中的早期表达,提示Pax7 可能在遗传级联的最前端起作用,而遗传级联对上丘/视顶盖的发育至关重要。Pax7还调控迁移到颅面部区域的小鼠脑神经嵴细胞的亚群,并最终产生各种各样的嗅觉上皮细胞类型,导致Pax7 突变小鼠颅面畸形[14]。由此可见,脊椎动物胚胎发育阶段,Pax7在脑视觉中心和视觉神经系统的分化形成发挥至关重要的作用。
3 Pax3和Pax7在神经嵴发育中的共同作用
脊椎动物的神经嵴发育机制在很大程度上是保守的(图2)。在神经和非神经外胚层的交界处,由分泌信号和转录调控因子组成的复杂且动态的组合控制着Pax3 和Pax7 基因的诱导[13]。神经嵴基因调控网络(Neural crest-gene regulatory networks,NC-GRN)认为,包括Wnts、骨形态发生蛋白(BMP)和成纤维细胞生长因子(FGF)在内的信号分子通过诱导一组称为边界特异性基因(Msx1、Pax3/7、Cdx、Tfap2、Gbx2)的表达来建立神经板边界。信号分子和边界特异性因子指导神经嵴特异性基因(Snail1/2、Sox8/9/10、Foxd3、Twist)的表达,进一步诱导与迁移和分化相关基因的表达。对不同的脊椎动物发育模型的研究共同阐明了神经嵴基因调控网络中涉及Pax3 和Pax7 基因的分子机制。
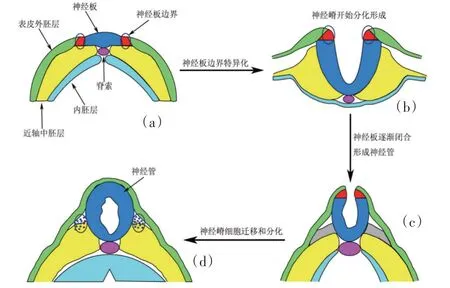
图2 脊椎动物胚胎发育过程中神经嵴与神经管的形成过程Figure 2 Formation of neural crest and neural tube during embryonic development
3.1 Pax3和Pax7在神经板边界形成中的作用
神经诱导起始于原肠胚早期,神经嵴前体最初定位于在神经板和外胚层之间的细胞层,这一区域称为神经板边界(Neural plate boundary,NPB)[15]。Pax3 和Pax7 最早出现在神经板的外侧边缘,用来区分神经板和外胚层。随着神经诱导的进行,神经板的外侧边缘增加Pax3 和Pax7 的表达,这标记了神经分化结束时闭合脊髓的背侧。在鸡、非洲爪蟾和斑马鱼胚胎发育过程中,Wnt、FGF和BMP信号协同调控神经板边界的形成。Wnt 和FGF 配体由神经板和下层中胚层分泌,而表皮外胚层产生BMP 配体,神经板分泌BMP 拮抗剂,导致BMP 信号沿背腹轴梯度分布。NPB 被指定在接受中等剂量的BMP 信号的外胚层区域。BMP、Wnt和FGF 这些信号的结合诱导NPB 特异性基因的表达,包括Pax3/7 和Zic 家族的成员。非洲爪蟾中的研究表明,Pax3 在神经板边缘的表达受规范的Wnt 信号通过直接和间接两种方式调节。Pax3可以被规范的Wnt信号直接诱导,也可以通过转录因子AP2a来触发Pax3和Msx1。Pax3是AP2a的即时早期目标。在Pax3上游基因序列中发现2 个可能的AP2a 结合位点,该序列驱动Pax3 在神经边界的强劲表达,同时AP2a 被证明调节神经嵴标记物Sox10 的活性[16]。对斑马鱼中两个Pax3 神经嵴特异性增强子的详细分析显示,每个增强子都是由Wnt、FGF 和BMP 信号的精确整合激活的。在鸡胚的神经板和相邻的非神经外胚层之间边界的建立和维持中,Msx-1 是BMP 信号传递的靶标,在神经板边界表达的时间很早。有趣的是,Msx1 由FGF 和Hensen's Node 信号诱导产生,却作为BMP 信号的早期靶点发挥作用[17]。同时,Pax7 由转录调控因子cMyb介导FGF信号激活,cMyb的缺失降低了神经板边界中Pax7和Twist的表达。cMyb能够与Pax7中的增强子相互作用,调控报告基因Pax7的早期表达[14]。在神经形成过程中,这些对Pax3/7 激活的精细控制对于胚胎外胚层不同区域的形成,尤其是神经板边界非常关键[图3(a)]。
3.2 Pax3和Pax7在神经嵴形成中的调控
神经嵴是一种短时的、高度多能性的胚胎细胞群,在脊椎动物中形成各种细胞和组织。神经嵴细胞(NCC)起源于原肠胚形成过程中的神经性和非神经性外胚层之间的边缘,随着神经褶的形成在封闭的神经管的背部融合。NPB 特异性因子(Msx1/2、Pax3/7)对于NC诱导是必不可少的,但在诱导后通常不保持在NC 细胞中。它们通过不同的作用将FGF、Wnt 和BMP信号整合到NC特异性因子的一致诱导中,这个网络在脊椎动物进化过程中保守。在神经外胚层中,Mxs1足以诱导多个早期神经嵴基因,Msx1 自主诱导Pax3 和ZicR1,反过来Pax3 结合ZicR1 激活依赖Wnt 信号的Slug[18]。另一方面,Wnt 直接通过Pax3 激活Slug,而FGF 通过Pax3 和Msx1 两种途径诱导神经嵴发育。类似地,神经嵴细胞的一个早期标记同源盒基因Gbx2,同样被Wnt 信号激活而介导Pax3 表达[19]。因此,在神经嵴诱导过程中,Wnt 和FGF 信号在神经边界处并行作用并整合调节Pax3表达。Pax7是神经嵴的一个早期标记,也是神经嵴发育的必要组成部分,阻断Pax7的翻译会抑制神经嵴特异性基因Slug、Sox9、Sox10 和HNK-1的表达。在鸡胚中,Pax7 缺失导致早期神经嵴特异性因子(如Snail2 或Foxd3)激活失败,随后神经嵴迁移和进一步发育不足。发育异常胚胎的表型与哺乳动物的Pax3突变体非常相似,有神经管开放、颅面和色素缺陷等特征[20]。综上所述,Pax3 和Pax7 通过整合来自FGF、Wnt 和BMP 的信号,同时激活多个神经嵴特异性因子:Slug、Sox9/10、Snail1/2、Foxd3、Ets1、Twist 和HNK-1来实现完整的神经嵴发育级联反应[图3(b)]。
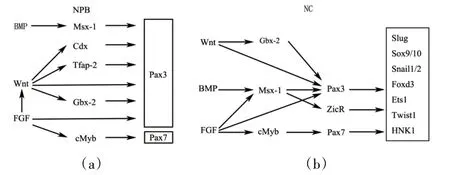
图3 Pax3和Pax7在神经板边界和神经嵴发育过程中的调控网络Figure 3 Regulatory networks of Pax3 and Pax7 in neural plate boundary(NPB)and neural crest(NC)development
3.3 Pax3和Pax7与神经嵴细胞的迁移和分化
神经嵴细胞(NCC)是脊椎动物特有的多能迁移细胞,出现在神经板(NP)和非神经外胚层的交界处,结合到神经褶/背侧神经管中,并以固定模式在整个胚胎中迁移。神经嵴细胞广泛迁移并产生多种衍生物,包括颅骨和软骨、脂肪组织、周围神经系统的神经元和胶质细胞以及色素细胞。NCC 的缺陷会导致神经病变,包括黑色素瘤、神经母细胞瘤、唇腭裂和先天性巨结肠。
Pax3 调节祖细胞增殖和维持未分化表型的能力,在神经嵴细胞(Neural crest cell,NCC)的迁移中发挥重要作用。Pax3 缺陷小鼠中神经嵴细胞正常迁移,但祖细胞增殖能力降低,从而导致发育缺陷。NCC 标记物Pax3 是典型Wnt 信号下游Cdx 蛋白的直接靶点。Cdx蛋白通过与Pax3中进化保守的Nce2增强子Cdx结合位点的直接结合,将规范的Wnt 信号传递到Pax3 近端的启动子[21]。cMyb 在调节神经嵴指定基因Ets1 的表达中起着关键作用,二者是迁移前和迁出的颅神经嵴细胞中Sox10 初始表达的直接激活因子[22]。因此,通过作用于Pax3 的上游,规范的Wnt-Cdx 途径可能控制正常神经嵴和神经管发育所需的祖细胞群体的细胞分化和维持。值得注意的是,Pax7 除了作为禽类胚胎神经嵴形成所需的早期标记外,还参与了神经嵴细胞的迁移[23]。在腹侧迁移开始之前,一些NC 细胞沿着背侧神经管发生纵向迁移。Pax7即表达于迁移中的主干NC细胞,位于内部和侧向迁移路线。此外,由于NC经常以相邻细胞流的形式出现,转录因子Pax7 的核表达为NCC分类提供了可靠的方法。
4 小结与展望
神经系统的发育是整个生命体发育过程中极其重要的组成部分,显然,从胚胎神经系统发育的早期到大脑的成熟,Pax3 和Pax7 在神经发生中起着关键作用。最初的扩展表达决定神经源性谱系,随后的表达限制作用于神经管的背侧和特定的大脑区域。Pax3的表达起始于神经管的发生,结束于神经管的尾部;Pax7最终特异性地表达在上丘/视顶盖的SGF层,说明Pax7在脊椎动物视觉系统的形成中起着重要作用;Pax3和Pax7出现在早期原肠胚从非神经外胚层分化衍生的神经板中,二者对神经嵴的发生、迁移和分化具有重要作用。
我们的前期实验证实,在脊髓发育过程中Pax3 和Pax7 之间相互调控,过表达Pax3 和Pax7 动态调控Cadherin-7(Cdh7)可导致神经元分化迁移异常[24],同时神经元轴突生长受抑制且不能投射到达相应部位[25],说明Pax3和Pax7在脊髓发育过程中也扮演重要角色。转录组测序和生物信息学分析显示异常表达Pax3、Pax7 和Wnt/β-catenin 信号通路密切相关,这一结果与Pax3/Pax7 与β-catenin 相互作用调控神经管闭合和延伸以及Pax3 和Pax7 参与非经典Wnt 信号通路体外调节细胞行为相一致。综上所述,Pax3 和Pax7 作为经典的转录因子在胚胎发育早期的神经管和神经嵴发生发育方面研究较为系统,但是有关Pax3/Pax7在中枢神经系统发育中如调控神经前体细胞分化、迁移、轴突生长和路径选择等的研究尚属空白,调控机制仍不清楚。Pax3 和Pax7 对神经系统发育的具体调控机制仍有待于进一步研究。系统而深入地研究将有助于对神经发育调控机制认识的突破,推动发育生物学和神经生物学等多学科共同进步。
