基于MgCl2-LaCl3熔盐中Mg作脱氧剂的钛脱氧方法
2021-04-28孔令鑫徐俊杰游彦军徐宝强
庞 俭,孔令鑫,4,徐俊杰,游彦军,徐宝强,4,杨 斌,4
(1.昆明理工大学 真空冶金国家工程实验室,云南 昆明 650093;2.昆明理工大学 冶金与能源工程学院,云南 昆明 650093;3.云南省有色金属真空冶金重点实验室,云南 昆明 650093;4.复杂有色金属资源清洁利用国家重点实验室,云南 昆明 650093)
0 引 言
钛及钛合金具有比强度高、密度小、耐腐蚀等优点,广泛应用于航空航天、生物医疗、信息技术等领域,被称为“全能金属”[1-2].钛作为推动尖端科技发展的一种新型金属,其资源丰富,但金属钛的冶炼工艺复杂、生产成本高,导致其应用范围受到了很大的限制[3-4].目前海绵钛的生产工艺主要是Kroll法,但是在海绵钛的生产过程中产生10%~20%的钛废料.另外,氧是钛中主要的有害杂质,对钛及钛产品的性能有很大的影响[5].加之氧与钛之间具有很强的亲和力[6],在钛材深加工过程中会进一步产生60%~90%的块状废料和切削废料[7].因此,开发一种绿色高效回收钛废料新方法是我国钛行业的当务之急.
目前,国内外在钛废料脱氧方面开展了大量的研究,提出了多种直接脱氧的方法[8-11],其中最具代表性的是Okabe等[12]提出CaCl2熔盐体系电化学脱氧法,采用电解产生的金属钙可将氧含量降至1×10-4以下,但这些方法都没有在工业上实现应用.因此,迫切需要一种高效、短流程的钛脱氧新工艺,实现钛废料的高效、经济回收利用.
针对上述问题,基于热力学分析,并结合我国稀土资源丰富的特点,本研究提出在MgCl2-LaCl3体系中Mg作脱氧剂,在该体系中LaOCl的生成有效降低了脱氧副产物MgO的活度,促进了Mg深度脱除钛废料中的氧,一步获得低氧钛.本研究将为钛废料的回收利用和低氧钛粉的生产提供了一种新的方法,同时也为稀土金属的应用开辟一条新的途径.
1 热力学分析
本研究所需各化合物的标准生成吉布斯自由能(ΔG°f,i)与其活度(ai)之间的关系如下:
1/2 O2(g)+Mg(l)+LaCl3(l)=MgCl2(l)+LaOCl(s)
(1)
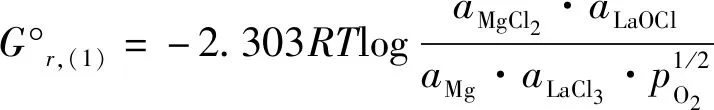
(2)
ΔG°r,(1)=ΔG°f,LaOCl+ΔG°f,MgCl2-ΔG°f,LaCl3
(3)
根据表1列出的M-O-Cl(M 为 La,Y, Mg)体系中化合物的标准生成吉布斯自由能(ΔG°f,i)[5,13-14]和O在β-Ti中溶解的标准反应吉布斯自由能[15],可计算出1 300 K下各化合物的ΔG°f,i(i为LaOCl、MgCl2和LaCl3),并带入公式(3)可得到化学反应(1)的标准反应吉布斯自由能(ΔG°r,(1)),最后根据式(2)和ΔG°r,(1)(此时,aMgCl2=1,aMg=1,aLaCl3=1,aLaOCl=0.01),可得1 300 K下Mg/MgCl2/LaOCl/LaCl3平衡对应的氧分压为3.4×10-36Pa.

表1 相关化合物以及氧在β-Ti中溶解的标准生成吉布斯自由能Tab.1 The standard generating Gibbs free energy of related compounds and oxygen dissolved in β-Ti

续表1
钛中固溶氧浓度根据反应式(4)和(5)方程确定:
1/2O2(g) =O(in β-Ti, 1 wt %)
(4)

(5)
=583 000+88.5T (J)
[1 173-1 373 K(900-1 100 ℃)]
(6)
由式(1)和式(4),得到式(7)和式(8):
O(in β-Ti)+Mg(l)+LaCl3(l)=MgCl2(l)+LaOCl(s)
(7)
(8)
ΔG°deox,Mg/MgCl2/LaOCl/LaCl3=ΔG°f,LaOCl+ΔG°f,MgCl2-ΔG°f,LaCl3-ΔG°1,Ti
(9)
通过式(8)和式(9)计算不同温度下Mg/MgCl2/LClOCl/LaCl3平衡的脱氧极限(相关数据见表1,aMgCl2= 1,aMg=1,aLaCl3= 1,aLaOCl=0.01).利用公式(8)和(9)计算不同温度下的数据,绘制O含量随温度变化的关系图,如图1所示.从图中可以看出Mg/MgCl2/LaOCl/LaCl3(aLaOCl=0.01)平衡的O含量远低于Mg/MgO平衡,说明LaOCl的生成能有效地降低MgO的活度,有利于脱氧反应的正向进行,降低脱氧极限.另外,由图1可知,随着温度的升高,Mg/MgCl2/LaOCl/LaCl3(aLaOCl=0.01)平衡下β-Ti中的氧含量升高,说明低温能降低该平衡脱氧的脱氧极限,但从动力学角度来看,低温条件下原子或分子扩散速率较低,脱氧效率降低,因此为保证脱氧效率处于较高的水平,本研究将实验温度设定为1 300 K.

图1 不同平衡条件下β-Ti中氧含量随温度变化图Fig. 1 Oxygen content in β-Ti varies with temperature under different equilibrium conditions
假设aMg=1,由公式(8)可进一步推导出式(10),根据式(10)计算并绘制aLaCl3/aMgCl2与β-Ti中的氧含量的关系图(见图2).由图2可知,随着LaCl3活度的增加,β-Ti中的O含量降低.由图2知,当log(aLaCl3/aMgCl2)=-1.8 343,即aLaCl3/aMgCl2=0.0 146(aMgO=1,aLaOCl=0.01)时,脱氧极限为2.5×10-2O,当aLaCl3足够大时能将β-Ti中的O降到1×10-5以下,说明LaCl3含量越高,Mg/MgCl2/LaOCl/LaCl3平衡脱氧极限越低,脱氧效果越好;从图2中可以看出,随着LaOCl活度的增加,Mg/MgCl2/LaOCl/LaCl3平衡线向右上方平移,脱氧极限升高.因此,用Mg作脱氧剂,通过保持较大的aLaCl3值,金属钛中的氧浓度可降至1×10-3以下,脱氧效果显著.
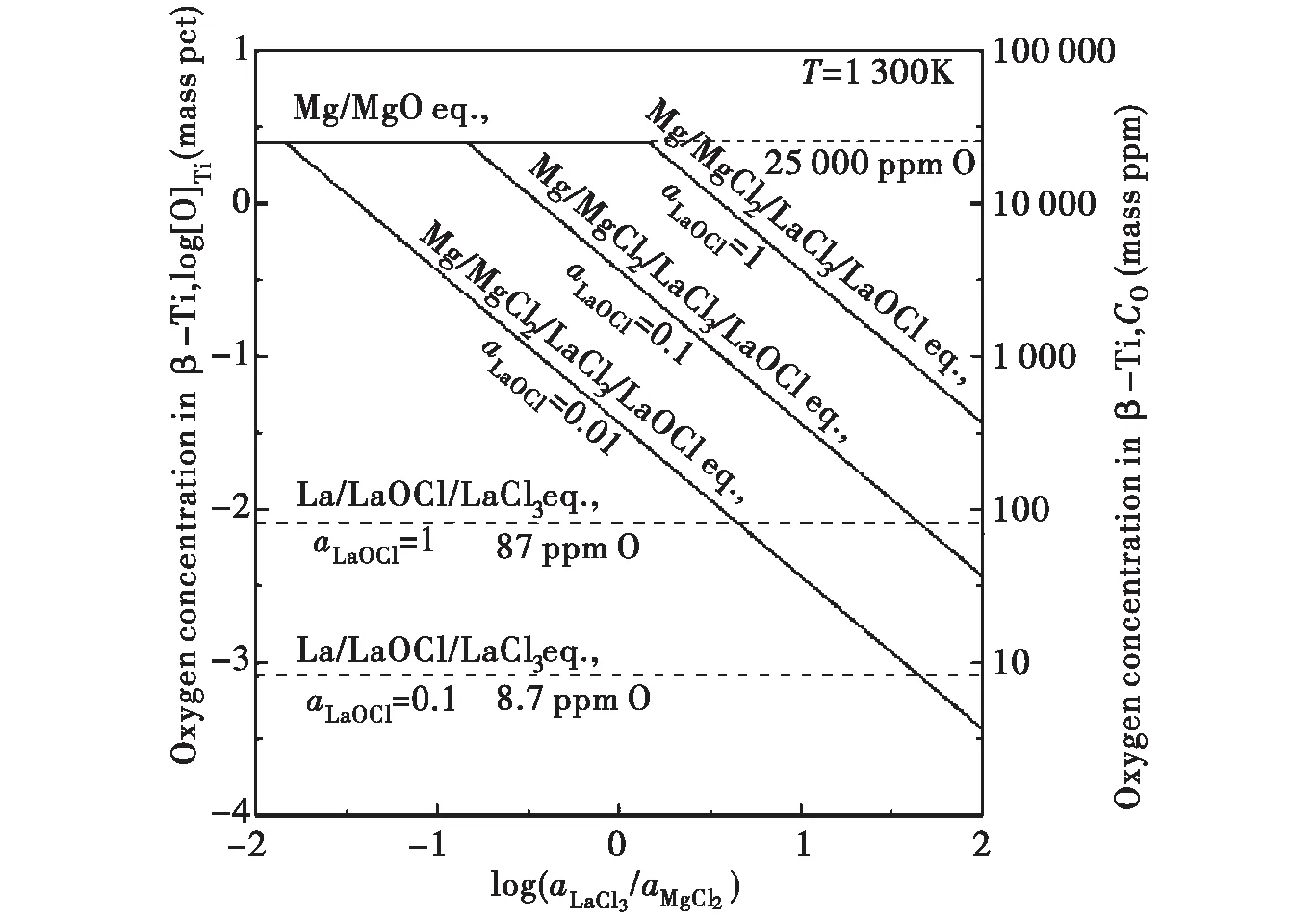
图2 aLaCl3 / aMgCl2与β-Ti中的氧含量的关系图Fig. 2 Relationship between aLaCl3 / aMgCl2 and the oxygen content in β-Ti
(10)
2 实 验
2.1 实验原料
本研究使用的钛试样:直径为2 mm和1.6 mm的两类钛线(O含量分别为1.1×10-3和7.5×10-4),及钛块(O含量为2.5×10-4).无水MgCl2(白色粉末,质量分数≥98%)、MgO(白色粉末,质量分数≥98%)、金属La(质量分数≥99.00%)和Ag锭(质量分数≥99.99%).
2.2 实验步骤
将直径为1.6 mm的钛线切成16 mm长度并弯曲成U型,记为Ti-1.6 U;将直径为2 mm的钛线切割成10 mm长度的钛线,记为Ti-2.0 L;钛块切割成边长为2~3 mm的立方体,记为Ti-2B.表2为钛坩埚中试样及原料的起始量.

表2 钛坩埚中试样及原料的起始量Tab.2 Initial amount of sample and raw materials in the titanium crucible
首先根据实验所需,将称取一定量的稀土金属La、Ag颗粒和MgCl2放置在钛坩埚中,通过化学反应式(11)生成LaCl3和脱氧剂Mg,从而制备MgCl2-LaCl3熔盐.加入银颗粒的目的是通过银颗粒与镁形成密度较大的Mg-Ag合金,使还原剂Mg下沉至钛坩埚底部,避免还原剂镁和钛试样直接接触.因为加入的Ag很少,所以对脱氧反应几乎无影响,然后将厚度为0.2 mm的钛箔放在Mg-Ag合金上方(避免金属与钛样品之间的接触),并将钛试样放在钛箔上,继续添加MgCl2,最后采用钛盖子将坩埚盖上.将装有试料的钛坩埚放入不锈钢坩埚,为保证充足的脱氧剂,在不锈钢坩埚中加入镁锭.另外,在不锈钢坩埚中加入约40 g的海绵钛(吸收水分及残留氧气),最后采用氩弧焊将不锈钢坩埚进行密封,如图3所示.

图3 实验装置示意图Fig.3 Schematic diagram of experimental apparatus
La(s)+3/2MgCl2(l)=LaCl3(l)+3/2Mg(l)
(11)
将装有钛坩埚的不锈钢坩埚置于马弗炉中,加热至1 300 K,保温48 h,根据O在Ti中的扩散系数,该保温时间足够其达到平衡,本研究的实验数据也论证了这一点.保温结束后,将不锈钢坩埚取出直接在水中淬火,然后用切割机切除不锈钢坩埚盖,取出钛坩埚,用切刀垂直将其一分为二,取出钛样品.对取出的钛样品,依次用醋酸溶液、稀盐酸溶液和蒸馏水清洗,去除表面附着的盐类.
2.3 分 析
1)对1#实验脱氧后的产物进行XRD(X射线衍射)检测,测定其物相组成.
2) 采用LECO (TC-400)测定Ti样品中的O含量.由于残留的盐类和脱氧产物(LaOCl)附着在Ti样品表面,所以采用HF-HNO3-H2O(1∶4∶10)对样品进行化学腐蚀,然后用蒸馏水、酒精和丙酮依次冲洗,最后干燥.测量时,为了顺利提取钛中的O,用约1 g高纯镍(镍坩埚,4±2 μg O)熔化Ti样品.在O分析中,使用Ti标样(Ti,9.3×10-4± 8×10-5O)进行校准.另一个标准Ti样品(Ti,5×10-4± 5×10-5O)用于交叉检查测量值的准确性.钛样品中氧浓度分析的误差是由于校准曲线的不确定度和镍坩埚中总氧含量的波动引起的.用钛标准样品进行校准的分析误差在9%以内.镍坩埚中的O含量波动约为2μg O,其他的误差可忽略不计.
3 结果与讨论
由原料的起始量结合反应式(11),可知表2中初始原料La能完全反应生成Mg.图4是脱氧后的钛坩埚剖面图,由图4可知,在脱氧过程中,Ti样品(Ti-1.6 U、Ti-2.0 L和Ti-2 B)完全浸入溶剂中.表3为1 300 K下,实验条件及脱氧前后Ti样品的O浓度.由表3知,Ti样品的初始O浓度不同,但每次实验中大多数Ti样品仍达到相同的O浓度,该实验结果表明,保温48 h足以使O在Ti中扩散,使得体系达到平衡状态.

图4 实验后钛坩埚剖面图Fig. 4 Sectional view of titanium crucible after experiment

表3 实验条件及实验前后钛试样氧含量Tab. 3 Experimental conditions and oxygen content of titanium sample before and after the experiment
从表3可知,大部分条件下,钛中氧含量均可降低至1×10-3以下,说明在MgCl2-LaCl3熔盐中,采用Mg脱氧是有效的.另外,随着熔盐中LaCl3含量的增加,钛中氧含量降低,最低可降至2.8×10-4(5#实验的平均值).从表3中还可看出,1#实验脱氧后的氧含量较高,造成该结果的原因为:1)熔盐中LaCl3含量少,其摩尔分数仅为0.2,间接论证了图1的热力学结果;2)实验前熔盐中加入了一定量的MgO,阻碍了脱氧反应的进行,所以1#实验脱氧后的氧含量较高.
图5为1#实验脱氧后熔盐的XRD图.本研究在1#实验中加入MgO原因为:实验前钛试样的氧含量不高,即使发生式(13)所示的反应,因生成的LaOCl的量较少,在XRD中也无法检测出LaOCl物相,无法证明体系中LaOCl的生成.由图5可知,LaOCl和LaCl3是稳定存在的,证实体系中发生了公式(13)所示的反应.上述实验结果证明:Mg和LaCl3首先是通过公式(11)反应生成,镁作脱氧剂脱除钛中的固溶氧(脱氧反应(12)),并且LaOCl的生成(式(13))有效降低了MgO的活度,促进脱氧反应正向进行,从而促使Mg有效脱除钛中的固溶氧.
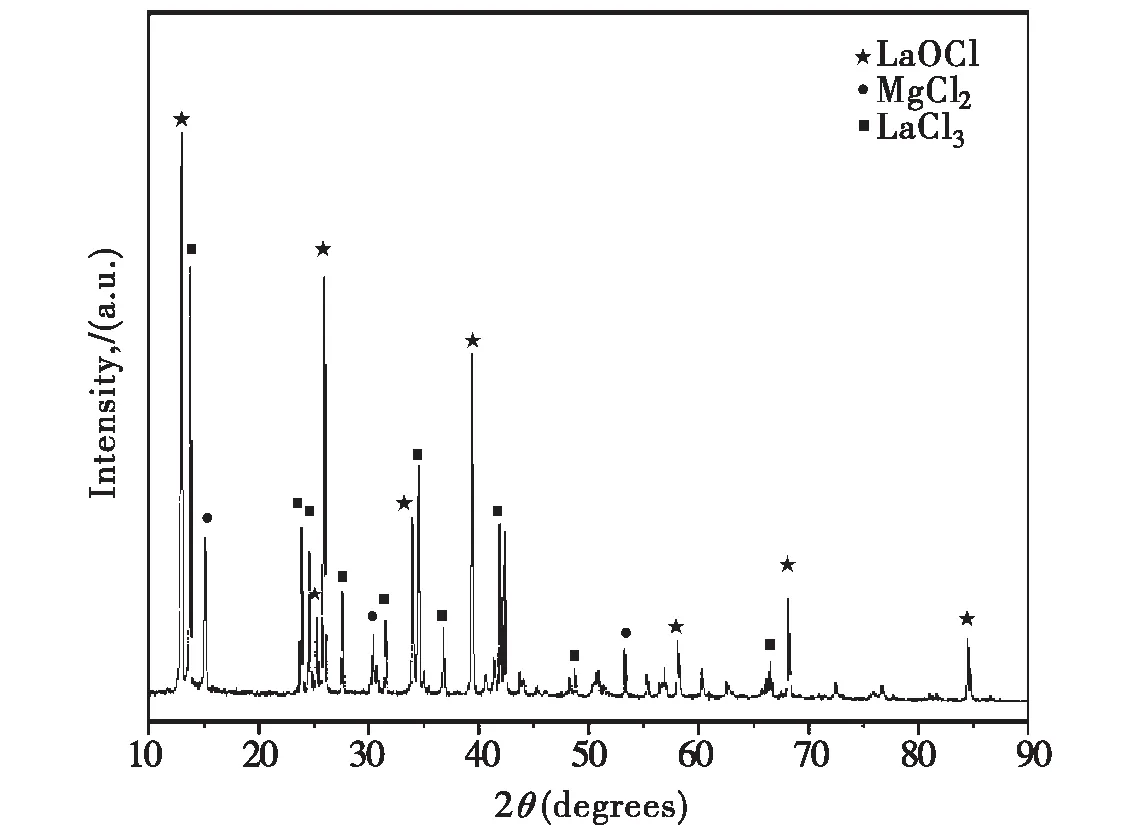
图5 1#实验后熔盐的XRD图谱Fig. 5 XRD pattern of molten salt after experiment 1#
O(in Ti)+Mg(in flux)→MgO(s)
(12)
MgO(s)+LaCl3(in flux) →MgCl2(in flux)+LaOCl(s)
(13)
由表2和表3中的实验结果可知,Mg/MgCl2/LaOCl/LaCl3平衡下的脱氧极限远低于Mg/MgO平衡下的O含量(1.21×10-2O[16]),表明LaOCl的生成有效降低了体系中MgO的活度,降低了Mg/MgCl2/LaOCl/LaCl3下的脱氧极限.另外,即使增加MgO的含量,即体系中O2-含量升高,脱氧后Ti中的O含量为1.25×10-3(1#实验的平均值)左右,远低于Mg/MgO平衡的脱氧极限,说明在Mg/MgCl2/LaOCl/LaCl3平衡下可以处理大量氧含量高的钛废料.
图6为Ti中氧含量实验结果随MgCl2-LaCl3熔盐中LaCl3活度变化情况图.LaCl3的活度计算见公式(14).由图6知,Ti中氧含量可降低至1.0×10-3左右,并且随着熔盐中LaCl3的活度逐渐增大,氧含量逐渐降低,当LaCl3的活度为1时,氧含量可降至2.2×10-4左右,说明LaCl3活度的增加能够有效降地低Mg/MgCl2/LaOCl/LaCl3平衡下脱氧极限.
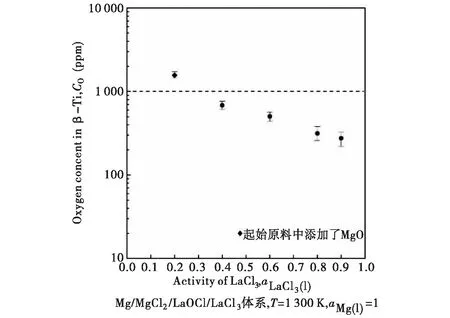
图6 氧含量随LaCl3活度的实验结果图Fig.6 Experimental result graph of oxygen content versus LaCl3 activity
(14)
4 脱氧新工艺
基于上述理论和实验研究,本研究提出了一种脱氧新技术,该技术不仅可以对钛废料进行脱氧处理,还可用于高氧钛粉的脱氧,如图7所示.采用这一新的脱氧工艺,以价格低廉的金属镁为脱氧剂,LaCl3熔盐为反应促进剂,借助LaOCl沉淀的生成,巧妙而快速地降低脱氧副产物MgO(或O2-)活度,有效促进镁深度脱氧获得氧含量<1.0×10-3的低氧钛.钛产品(脱氧后生成的低氧钛)表面残留的Mg和MgCl2采用真空蒸馏即可清洁脱除,其中真空蒸馏对比表面积大的Ti粉效果更好.另外,氯化镁是海绵钛生产的副产品,简单易得.此外,该过程产生的LaOCl,可由碳热氯化(LaOCl(s)+Cl2(g)+C(s)→LaCl3(s,l)+COx(g))即可生成LaCl3,重新用于脱氧,实现副产物的循环利用,脱氧过程无稀土消耗.该工艺有望在未来实现工业化应用.

图7 脱氧新工艺流程图Fig. 7 Flow chart of new deoxidation process
5 结 论
经过以上分析,得到如下结论:
1)热力学计算结果表明,1 300 K下Mg/MgCl2/LaOCl/LaCl3(aLaOCl=0.01)平衡下的脱氧极限为3.7×10-4,小于5.0×10-3,理论上可以用于钛废料的脱氧.
2)采用热力学计算结果绘制了不同平衡条件下β-Ti 中氧含量随温度变化图以及β-Ti中氧含量与aLaCl3的关系图,结果表明,在MgCl2-LaCl3体系中,LaOCl沉淀的生成,可有效地降低MgO的活度,从而促进Mg深度脱氧.
3)开展了Mg/MgCl2/LaOCl/LaCl3平衡脱氧实验研究,结果表明LaOCl的生成(MgO(s)+LaCl3(l)→MgCl2(l)+LaOCl(s))有效地降低了MgO的活度,促进了镁脱氧,Ti中氧含量可降低至1.5×10-3左右,并且随着熔盐中LaCl3的活度逐渐增大,钛氧含量逐渐降低,当LaCl3的活度为0.9时,氧含量可降至2.8×10-4左右.
4)基于上述理论及实验研究结果,本研究提出了一种脱氧新工艺,未来有望实现钛废料脱氧的工业应用.
