α硫辛酸抑制血管内皮细胞增殖的实验研究
2021-04-28王娟王竹瑶倪燕曹小飞丁正年
王娟 王竹瑶 倪燕 曹小飞 丁正年
内皮细胞增殖是血管新生的必需前提。血管新生对缺血性损伤组织修复至关重要;然而,某些病理因素引起的异常血管增生则是疾病发生发展的病理基础,例如糖尿病视网膜病变、动脉粥样硬化斑块、恶性肿瘤等[1-2]。因此,从调控血管内皮细胞增殖的角度控制血管新生,对许多疾病的治疗具有积极意义。
α硫辛酸(α-lipoic acid, LA)天然存在于人类食物中[1],一些欧洲国家已经批准LA用于临床治疗糖尿病并发症包括糖尿病视网膜病变、糖尿病肾病、疼痛等[2-4],但作用机制尚不明确。本研究采用体外培养的人脐静脉内皮细胞(human umbilical vein endothelial cells, HUVECs)模型,发现LA显著抑制HUVECs增殖,提示LA除可应用于糖尿病视网膜病变等并发症外,还可能对其他血管异常增生的疾病如恶性肿瘤具有潜在治疗作用。
1 资料和方法
1.1 试剂 胰酶、碱性成纤维生长因子(fibroblast growth factor-basic, bFGF)(Sigma-Aldrich公司),M199 培养基、胎牛血清(fetal bovine serum, FBS)(GIBCO公司),Hoechst33342试剂(Invitrogen公司),二甲基噻唑-二苯基溴化四唑(MTT)试剂(Bio Besic 公司),Cell-LightTMEdU Apollo 567 In Vitro Kit(RibBio技术公司),Trizol reagent(美国生命技术公司),乳酸脱氢酶(LDH)活性测定试剂盒(南京建成生物技术公司),SYBR Green Master(罗氏公司)。
1.2 HUVECs分离和培养 按照文献方法[5],HUVECs从人脐静脉中分离得到,本研究得到南京医科大学第一附属医院伦理委员会核准(#2012-SR-153)。分离过程简要概括如下:首先,以0.25%胰酶消化脐静脉,分离得到内皮细胞,然后将内皮细胞生长于含有10% FBS、100 U/mL青霉素-链霉素、0.5 ng/mL bFGF的M199培养基中, 在含有5% CO2的孵箱中37°C培养,每2~3 d换1次培养基。实验采用2~5代的细胞。
1.3 MTT实验 生长在24孔板中的HUVECs与相应浓度LA作用相应时间后,按此前报道的方法[6],进行MTT测定。简要方法为,培养体系中加入40μL5 mg/mL MTT孵育4 h,将形成的甲臜以300μL二甲基亚砜进行溶解,然后以分光光度计(Synergy HT, Bio-Tek, USA)在570 nm波长处读取吸光值(OD)。
1.4 RNA提取和定量PCR实验 与LA (500μmol/L) 孵育48 h后,收集HUVECs,按此前报道方法[7],以Trizol reagent提取细胞总RNA,溶剂处理组被设为对照组。2μg RNA 以oligo (dT) 为引物逆转录为cDNA,然后采用以SYBR Green为标记的定量PCR分析C-myc、Cyclin-D1 mRNA表达水平,β-actin被设为内参照。用于实验的C-myc引物为: GGCTCCTGGCAAAAGGTCA (正向)、CTGCGTAGTTGTGCTGATGT (反向),Cyclin-D1引物为GCTGCGAAGTGGAAACCATC (正向)、 CCTCCTTCTGCA-CACATTTGAA (反向),β-actin引物为TGTTACCAACTGGGACGACA (正向)、 TCTCAGCTGTGGTGGTGAAG (反向)。
1.5 EdU掺入实验 本实验按照试剂说明书进行。与LA (500μmol/L) 孵育48 h后,生长于24孔板中的HUVECs与EdU孵育2 h,然后以Hoechst 33342染色细胞核。数据以EdU阳性细胞核的比例表示。
1.6 LDH渗漏实验 与LA (500μmol/L) 孵育48 h后,收集HUVECs细胞培养上清,按照LDH活性测定试剂盒说明书测定培养上清中的LDH活性。LDH渗漏以其在上清中的活性占总LDH活性的比例表示,总LDH活性=(LDH在培养上清中的活性)+(0.2 % Tween 20裂解细胞液中的LDH 活性)。
1.7 核固缩分析 与LA (500μmol/L) 孵育48 h后,收集HUVECs,按此前报道方法[8],以Hoechst 33342对细胞核染色,观察核固缩情况。首先,将生长于24孔板中的HUVECs 进行固定(50%甲醇 + 50% 丙酮)10 min,然后与Hoechst 33342 (0.4 g/mL) 常温孵育 5 min,封片后以荧光显微镜观察、拍照 (Axiovert 200,Zeiss),在200倍放大的视野下,随机选取3个视野进行统计分析。
2 结果
2.1 LA降低HUVECs活力
2.1.1 LA对HUVECs活力影响的剂量-效应关系:用不同剂量的LA (300、500、1000μmol/L)刺激HUVECs 48 h,以0μmol/L LA为对照组,MTT结果如图1a 所示。与对照组相比,300μmol/L的LA未显著降低细胞活力,但500、1000μmol/L 的LA分别使HUVECs活力显著降低了12.7%和33.2% (P<0.05或P<0.01)。因此,500μmol/L被选择为下列实验的LA浓度。
2.1.2 LA对HUVECs活力影响的时间-效应关系:用500μmol/L LA刺激HUVECs不同时间 (12、24、48和72 h),以0 h为对照组,MTT结果如图1b 所示。与对照组相比,LA刺激 12、24 h后,细胞活力无显著变化;但当刺激时间延长至48、72 h后, HUVECs活力分别显著降低了17.2%和31.9% (P<0.05或P<<0.01),提示LA呈时间依赖性抑制HUVECs活力。据此,48 h被选择为LA对HUVECs的刺激时间。
2.2 LA抑制HUVECs增殖 如图2所示,与未经LA作用的对照组相比,LA (500μmol/L) 刺激48 h后,EdU-阳性细胞数显著减少了55.7% (P<0.01)。这些数据提示,LA显著抑制HUVECs增殖。

注:图1a:与0 μmol/L比较,* P<0.05,** P<0.01;图1b:与0 h 比较,*P<0.05,**P<0.01图1 LA降低细胞活力(n=3)
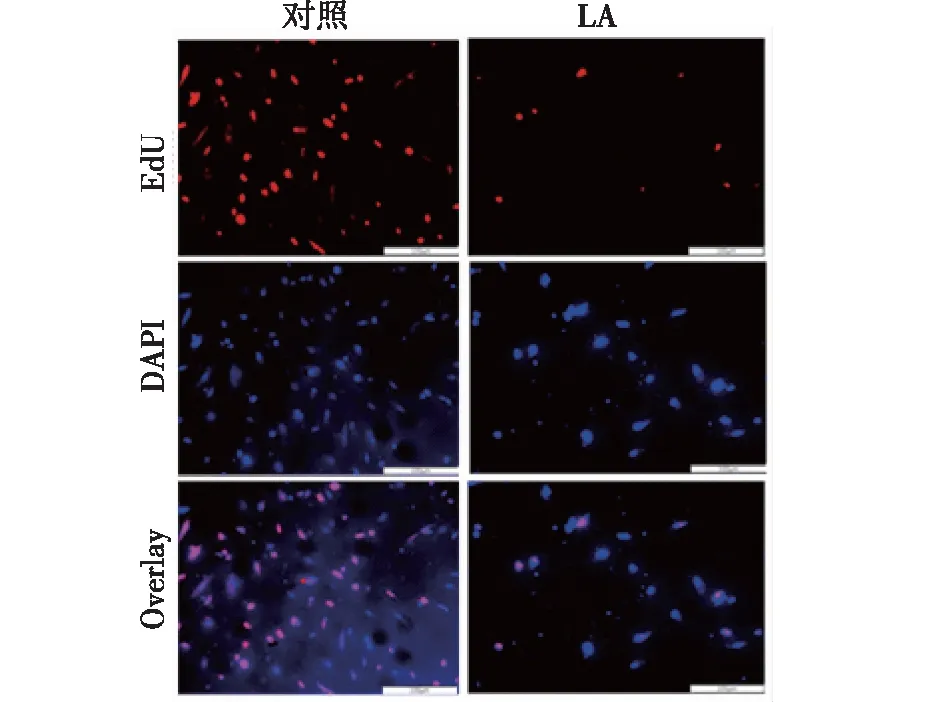
注:标尺=100 μm图2 LA抑制细胞增殖(n=3)
2.3 LA抑制增殖相关基因表达 如图3a、3b所示,与对照组比较,LA (500μmol/L) 刺激48 h后,C-mycmRNA 水平显著降低了20.0% (P< 0.05),而CyclinD1 mRNA 水平无显著改变。Western blot结果显示,LA降低C-Myc蛋白质表达,而对Cyclin-D1蛋白质表达无影响,见图3c、3d。

注:图3a:与对照组比较,*P<0.05;图3c:与对照组比较,*P<0.05图3 LA抑制细胞增殖相关基因表达(n=3)
2.4 LA不引起细胞死亡 由于HUVECs活力在LA刺激后显著降低,并发现LA显著抑制HUVECs增殖。为了进一步排除LA降低细胞活力与细胞死亡有关,本研究进行了如下2个实验。
2.4.1 LDH测定:LDH在细胞培养上清中的活性常用于细胞损伤,特别是细胞坏死和细胞凋亡评价,因此本研究进行了LDH渗漏实验。与对照组相比,LA (500μmol/L)刺激48 h的HUVECs培养上清LDH活性无显著变化。见图4a。

注:图4a:LDH渗漏情况比较;图4b:核固缩情况比较图4 LA不引起HUVECs细胞死亡(n=3)
2.4.2 细胞核固缩分析:如图4b所示,LA处理组与对照组之间的细胞核固缩情况无显著差异。
3 讨论
内皮细胞增殖是血管新生起始阶段的关键过程,也是某些因素如血管内检查或治疗引起血管内皮损伤以后的修复所必需。然而血管新生是一把双刃剑,可促进某些疾病的修复,也可促进某些疾病的病情进展。例如,血管新生可促进缺血性心肌损伤、缺血性脑损伤的修复;然而,血管新生也可促进肿瘤、糖尿病视网膜病变等疾病的进展。因此,抑制血管生成在临床治疗中可改善肿瘤病人的生存时间[9]。由此可见,根据病情需要进行血管新生的靶向调节至关重要,而内皮细胞增殖的调节则是相关调节的关键。
LA是人类食物中天然存在的一种化合物,可以作为代谢酶的辅助因子,具有抗氧化特性。研究显示,某些抗氧化物质如乙酰半胱氨酸(N-acetylcysteine)和epigallocatechin-3-gallate (绿茶的主要成分)具有显著抑制血管新生的生物学作用[10-11]。值得关注的是,除了作为食物补充,LA 已经成功地应用于外周神经病变、视网膜病变、疼痛、心脏自主神经病变以及其他糖尿病并发症的临床治疗,至今已有20多年历史[12-13]。不仅如此,孕妇使用LA未见明显不良反应,显示了LA的安全性[14]。然而,LA对上述疾病的治疗作用是否与内皮细胞相关机制有关尚不清楚。近期临床证据表明,LA作为食物补充剂在防治代谢相关性疾病如糖尿病高血糖、糖尿病血管病变、多发性硬化症、AD、痴呆、女性子宫内膜异位相关性骨盆疼痛中有积极作用。动物实验证据也提示,LA在创伤性面瘫、缺血-再灌注损伤、神经退变、衰老、射线损伤、溃疡性结肠炎、某些药物毒性中也具有保护作用,这些作用可能与LA的抗氧化作用有关,但确切机制尚有待进一步阐明[15-16]。本研究发现LA对内皮细胞增殖有显著抑制作用,提示LA可能作为人类疾病抗血管新生的潜在治疗药物。
为探寻LA是如何抑制内皮细胞增殖的,笔者分析了LA对C-Myc和Cyclin-D1表达水平的影响。C-Myc是一个多功能的核转录因子,调控多种生物学过程如发育、增殖和分化等[17]。Cyclin-D1 可促进细胞周期,在G1-S 转变中起关键作用,在细胞增殖、生长调控、线粒体活性调节、DNA修复等生物过程中具有重要作用[18]。本研究发现LA显著降低C-MycmRNA 水平,但对Cyclin-D1 mRNA 水平无显著影响,提示下调C-Myc表达可能参与了LA对内皮细胞增殖的抑制作用。
综上所述,本研究发现,LA对内皮细胞增殖具有抑制作用,提示除了在某些糖尿病并发症的临床治疗外,LA可能对需要抑制血管新生的疾病如肿瘤等也具有潜在治疗作用,与此相反,LA对需要血管新生进行修复的疾病如心肌梗死等则是有害的。本研究结果对进一步完善LA临床治疗的适应证、禁忌证提供了新的实验依据。
