光裸星虫Sn-hsc70基因克隆及表达分析
2021-04-27黄剑强魏雯璐钟如卓张家炜杨创业王庆恒
黄剑强,魏雯璐 ,钟如卓,张家炜,杨创业 ,2,王庆恒 ,2
(1广东海洋大学水产学院,广东湛江524088;2广东省海水养殖生物育种工程实验室,广东湛江524088)
0 引言
Ritossa[1]首次发现短暂的热休克能诱导果蝇唾液腺染色体在3个区域出现膨突,该区带转录加强,这一现象被称为“热休克反应(Heat shock response,Hsr)”。1974年,有研究工作者[2]在对果蝇唾液腺细胞进行热休克处理后,分离出一种特殊蛋白质,并证实该蛋白的合成能引起果蝇幼虫染色体蓬松的现象,这种在热刺激下产生的蛋白质,被称为热休克蛋白(Heat shock proteins,Hsp)。热休克蛋白70(Heat shock proteins 70,Hsp70)家族,普遍存在于原核及真核生物中,是一类高度保守性的蛋白质[3]。其结构主要分为多肽结合区、ATP酶区和功能不明区三部分[4],参与蛋白质正确折叠、环境抗逆、细胞凋亡和免疫反应等许多重要生理活动[5]。Hsp70家族可分为4个主要的成员:(1)诱导型 Hsp70(72 kDa);(2)组成型 Hsc70(73 kDa);(3)位于内质网的葡萄糖调节蛋白(GRP78或Bip,78 kDa);(4)位于线粒体的Mtp70(75 kDa)[6-7]。其中Hsc70在正常生理和环境下具有较为稳定的表达,参与了蛋白质的成熟[8]、蛋白质向细胞器的转运[9]、胞吞作用[10]以及调节细胞凋亡[11]等重要过程。在卵母细胞中,Hsc70 mRNA的沉默会导致灯刷染色体转录可逆性的抑制[12]。此外,Hsc70还参与类固醇受体的成熟和信号传导[13]。这些研究均表明Hsc70对性腺乃至卵母细胞的发育具有重要的作用。
光裸星虫(Sipunculus nudus)俗称沙虫,味道鲜美,营养丰富[14],广泛分布于沿海暖水性潮间带,为中国华南地区重要的珍贵海产品之一,具有较高的经济价值[15]。近年来,由于近岸环境的污染以及破坏式采捕行为,光裸星虫的自然资源量明显下降,这促使广东湛江、广西北海、海南儋州等地沿海地区逐渐开展了光裸星虫的繁殖生物学研究[16-17]和人工养殖试验[18]。然而,目前光裸星虫苗种的质量和产量处于很不稳定的状态,苗种人工繁殖主要受到了光裸星虫精卵发生的不同步性制约[19],且光裸星虫繁殖生物学的研究主要集中在形态学上[16,20],对于分子机制上研究较少。
本研究通过RACE技术获得光裸星虫Sn-hsc70的cDNA全长,并对其进行生物信息学及表达分析,探讨Sn-hsc70在光裸星虫卵母细胞发育过程中的作用。研究结果为深入认识光裸星虫卵母细胞发育的分子机制积累基础资料。
1 材料与方法
1.1 实验材料
实验所用材料来自湛江市下六镇,均为有活力、无损伤、规格基本一致(12.92±1.68 g)的光裸星虫。
用无菌海水冲洗光裸星虫体表的泥沙,雌雄分开,随机选取30尾雌虫,使用2.5 mL无菌注射器抽取体腔液,分离不同时期的卵母细胞,具体方法参考王庆恒等[16]和张家炜[21],使用100目、150目、300目、500目的细胞筛将卵母细胞按照直径大小分为O1-O4四个时期(O1:<48 μm,卵黄形成初期;O2:48~108 μm,卵黄旺盛合成前期;O3:108~150 μm,卵黄旺盛合成后期;O4:>150 μm,成熟期),收集到肾管中的卵母细胞为O5时期样品,从肾管中自然排放体外的卵母细胞为O6时期样品。试验在广东海洋大学水产学院实验室,于2018年6月份进行。
1.2 Sn-hsc70基因全长cDNA克隆
按照Trizol法提取上述实验样品的总RNA,NanoDrop 1000微量紫外/可见分光光度计检测所提取RNA的浓度和质量,琼脂糖凝胶电泳检测RNA是否有降解、污染等。选择经过上述步骤确认合格的RNA样品依据Reverse Transcriptase M-MLV(NaseH)说明书进行反转录合成cDNA。反转录产物置于-20℃保存,备用。利用引物设计软件Primer Premier 6.0,按照引物设计原则设计Sn-hsc70的引物,见表1。

表1 Sn-hsc70基因克隆及荧光定量的引物序列
1.3 Sn-hsc70序列分析
将测序结果导入DNAMAN 8软件并对其进行拼接,得到Sn-hsc70序列全长;通过在线分析工具ORF Finder预测Sn-hsc70的开放阅读框(Open Reading Frame,ORF)和并翻译出氨基酸序列;ProtParam进行蛋白质的理化性质和二级结构预测;ProtScale预测蛋白亲水性;NCBI Blast进行氨基酸序列的同源性分析;Phyer2预测蛋白质的三级结构;Pfam进行保守结构域预测;使用Mega X软件构建生物系统进化树。在线工具的网址为:ORF Finder(https://www.ncbi.nlm.nih.gov/orffinder);ProtParam(https://web.expasy.org/protparam/);NCBI Blast(https://blast.ncbi.nlm.nih.gov/Blast.cgi);Phyer2(http://www.sbg.bio.ic.ac.uk/~phyre2/html/page.cgi?id=index); Smart (http://smart.embl-heidelberg.de/);MEME (http://memesuite.org/index.html);ProtScale (https://web.expasy.org/protscale/)。
1.4 Sn-hsc70差异表达分析
以60S-L7作为内参基因[19],通过实时荧光定量PCR(real-time PCR)技术在Roche LightCycler®96在系统上检测Sn-hsc70基因在光裸星虫卵子发生各个阶段的差异表达。实验设置3组重复,具体PCR流程参照张家炜等[19]。分析荧光定量PCR结果,SPSS软件进行单因素方差分析(one-way ANOVA),显著性水平P<0.05。
2 结果与分析
2.1 Sn-hsc70基因序列特征分析
Sn-hsc70基因cDNA全长2516 bp,其中5'UTR为 114 bp;3'UTR 为 429 bp,ORF为 1971 bp,编码656个氨基酸。推导的Sn-Hsc70蛋白除了具有3个Hsp70蛋白家族的3个特征序列(IDLGTTYS、IFDLGGGTFDVSIL、IVLVGGSTRIPKIQK)外,还具Hsc70蛋白特有的连续重复的四肽序列(GGXP);此外Sn-Hsc70蛋白具有2个核定位序列(DAKRL、KRKYKKDISDNKRAVRR)以及羧基端(C端)的胞质定位序列(EEVD)(图1)。
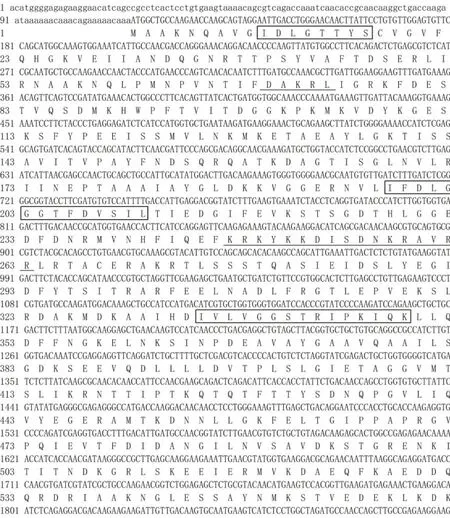

图1 Sn-hsc70 cDNA序列全长及推导的氨基酸序列
2.2 Sn-Hsc70蛋白序列分析
蛋白理化性质预测表明Sn-Hsc70蛋白分子量为71.65 kDa;亲水性氨基酸比例远高于疏水性氨基酸(图2),总平均亲水性(grand averageofhydropathy,GRAVY)为-0.46,属于亲水性蛋白。信号肽及跨膜结构域预测显示Sn-Hsc70蛋白无信号肽和跨膜结构。蛋白功能位点预测发现,Sn-Hsc70蛋白具有5个N-糖基化位点、1个cAMP和cGMP依赖的蛋白激酶磷酸化位点、5个蛋白激酶C磷酸化位点、16个酪蛋白激酶II磷酸化位点、1个酪氨酸激酶磷酸化位点、20个N-肉豆蔻酰化位点、1个酰胺化和1个ATP/GTP结合位点。Sn-Hsc70蛋白二级结构预测发现α螺旋、β转角、延伸链和无规卷曲分别占整体的40.70%、7.77%、18.14%和33.38%。
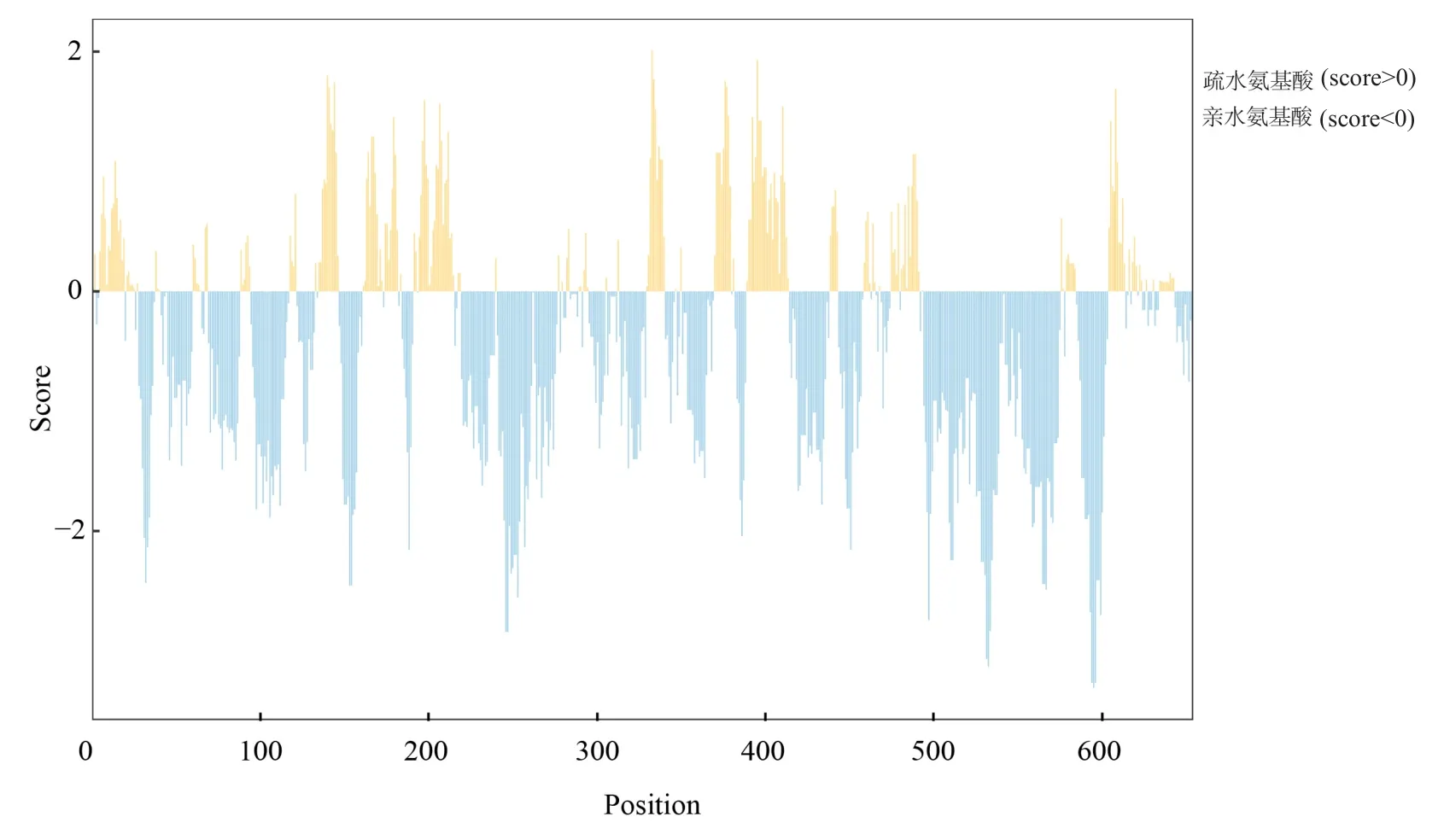
图2 Sn-Hsc70蛋白残基亲水性分布图
2.3 Hsc70同源蛋白多序列比对
对Sn-Hsc70以及武昌鱼(Megalobrama amblycephala,ACC93993.2)、鲢鱼(Hypophthalmichthys molitrix,EU816594.1)、草鱼(Ctenopharyngodon idella,EU816595.1)、智人 (Homo sapiens,CAA68445.1)、莱桑池蛙(Pelophylax lessonae,ACY69995.1)、非洲爪蟾(Xenopuslaevis,AAH41201.1)、紫海胆(Strongylocentrotus purpuratus,XP_802129.1)、长牡蛎(Crassostrea gigas,AJ305315.1)的同源Hsc70蛋白进行多序列比对,发现同源Hsc70蛋白之间共有的3个Hsp70家族特征序列高度保守。羧基端(C端)具有连续多次重复的四肽序列(GGXP)以及胞质定位序列(EEVD)(图3)。

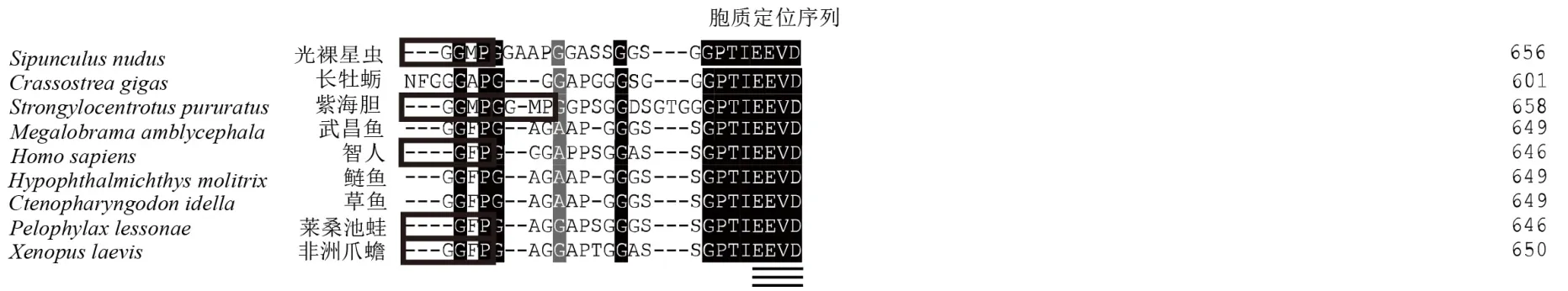
图3 Hsc70同源蛋白多序列比对
2.4 Sn-Hsc70蛋白三级结构分析
分别对光裸星虫、双齿围沙蚕(Perinereis aibuhitensis,ADR66514.1)和栉孔扇贝(Azumapecten farreri,AAO38780.1)的Hsc70进行蛋白三级结构的预测分析。结果显示3个Hsc70同源蛋白三级结构高度保守(图4)。
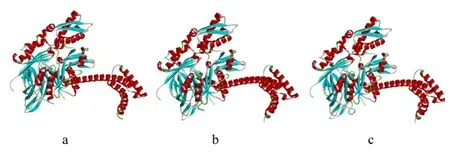
图4 光裸星虫(a)、双齿围沙蚕(b)和栉孔扇贝(c)的Hsc70蛋白三级结构
2.5 Sn-Hsc70系统发育和结构域分析
对13条Hsc70同源蛋白序列进行系统发育树构建和结构域预测。结果表明Hsc70蛋白系统发育树分为无脊椎动物和脊椎动物两大支,在无脊椎动物中又细分为两支,一支属于棘皮动物,另一支包括了软体动物、星虫动物以及环节动物。光裸星虫先与双齿围沙蚕聚为一支,再与可口革囊星虫聚为一支(图5)。13条Hsc70同源蛋白均具有一个Hsp70蛋白家族结构域,除了长牡蛎结构域较短外,其余12条Hsc70同源蛋白的位置及长度较为一致。

图5 同源Hsc70的系统发育树及结构域
2.6 Sn-hsc70表达模式分析
利用qRT-PCR检测了Sn-hsc70在卵母细胞6个发育时期的表达情况。结果显示,Sn-hsc70在光裸星虫卵母细胞发育的各个时期均有表达,整体表达模式呈单峰型。在体腔液发育时期(O1-O4)表达量呈上升趋势,其中O3和O4时期Sn-hsc70表达量显著高于其他时期(P<0.05)。进入肾管后(O5)Sn-hsc70表达量迅速下降,直到卵母细胞的外排后(O6)Sn-hsc70的表达维持在较低的水平,O5和O6无显著性差异(P>0.05)。
3 讨论
Hsp70家族蛋白包含4个主要成员,其中诱导型的Hsp70与组成型的Hsc70两者在序列和功能上具有较高的相似性[22]。研究表明,Hsc70与Hsp70均具有Hsp70蛋白家族的3个特征序列(IDLGTTYS、IFDLGGGTFDVSIL、IVLVGGSTRIPKIQK),不同的是Hsc70蛋白C端具有多个连续重复的四肽序列(GGXP),而Hsp70在大多数情况下仅有一个GGXP序列[23-24]。本研究发现Sn-Hsc70蛋白具有Hsp70家族的3个特征序列,C端具有4个连续重复的GGXP序列,这些证据表明本研究所克隆获得的cDNA序列为hsc70基因。
生物信息学分析发现Sn-Hsc70属于亲水性蛋白,在功能位点的搜索中发现了多个蛋白质磷酸化位点及糖基化位点。研究表明蛋白质磷酸化在信号转导和调控中起着至关重要的作用,糖基化在蛋白质折叠,寡聚化,质量控制,分类和运输中具有重要的功能[25]。这与Hsc70蛋白参与了类固醇受体的成熟与信号传导以及蛋白质的折叠、组装和运输等过程相吻合[26-27]。
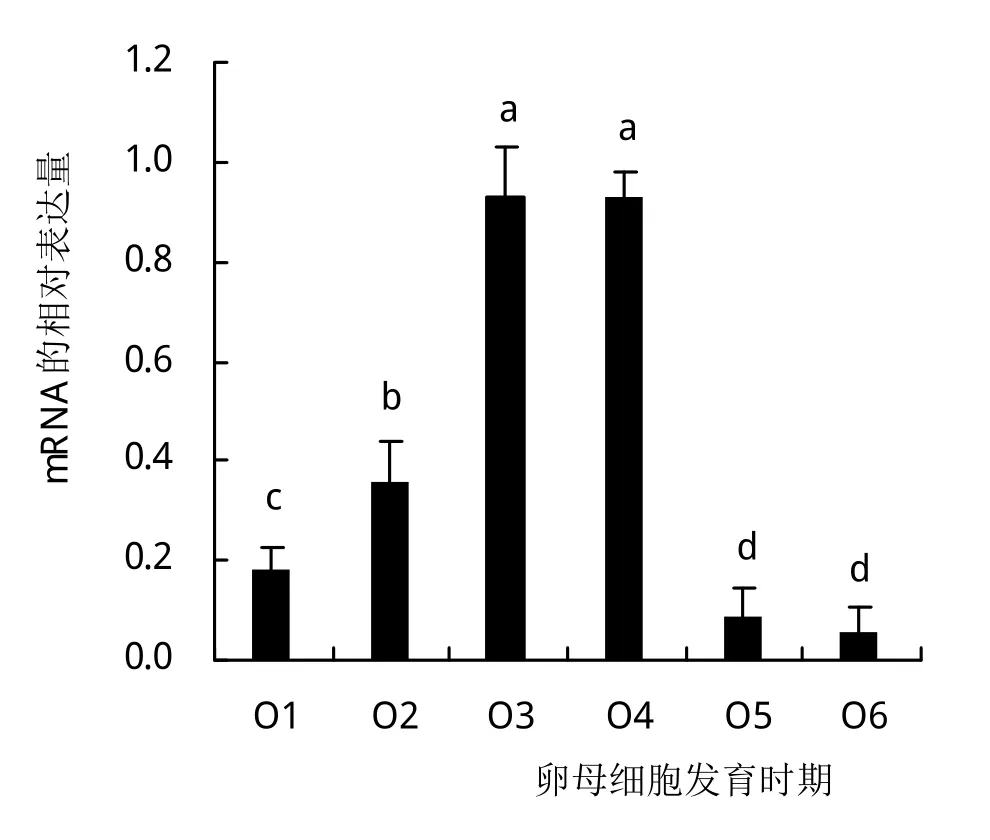
图6 Sn-hsc70在卵母细胞各发育时期的相对表达量
在正常条件下,Hsc70存在于细胞核及细胞质中,它有助于胞质蛋白(如细胞周期蛋白D1)的入核转运,因此Hsc70蛋白被认为能在细胞质和细胞核之间移动[28-30]。本研究对包括Sn-Hsc70在内的9条Hsc70同源蛋白进行多序列比对发现所有Hsc70同源蛋白均具有胞质定位序列(EEVD)和两个核定位序列;这与Hsc70介导胞质蛋白入核转运功能相吻合。Sn-Hsc70同时具有胞质及细胞核定位序列,推测Sn-Hsc70可能介导了卵母细胞质中一些胞质蛋白的入核转运。此外,EEVD通过静电相互作用介导热休克蛋白组织蛋白(Hsp-organizing protein,Hop)与Hsc70和Hsp90的结合,有助于转录因子、激酶以及类固醇激素等底物的组装和成熟[31]。Sn-Hsc70末端的EEVD序列可能通过与分子伴侣的结合参与某些蛋白的组装与成熟过程。
研究表明hsc70在人卵巢和胚胎中具有丰富表达,其表达水平远超肌动蛋白和微管蛋白[32],这暗示了hsc70对性腺和胚胎发育具有重要的作用。光裸星虫生殖方式较为特别,无肉眼可见的性腺,卵母细胞游离于体腔液中发育,当营养物质积累完成后,卵母细胞被肾管收集,进行短暂的储存后由肾口排放于海水中[29]。本研究检测了Sn-hsc70在卵母细胞6个不同发育时期的表达量,结果表明在体腔液发育过程中(O1-O4)Sn-hsc70的表达逐渐上升,其中从卵黄合成初期进入卵黄旺盛合成期时(O2-O3)表达量显著上调。研究表明光裸星虫卵母细胞在体腔液发育过程中可能经历了G1-P I期(减数分裂间期的G1、S、G2和第一次减数分裂前期P I)[21],而该减数分裂过程是在一些性激素的调控下启动的[33]。有研究表明hsc70会响应雌激素和孕激素的刺激而表达量上升[34]。这暗示了体腔液中性激素的刺激可能是导致Sn-hsc70在O1-O4时期表达量上升的原因之一。
一般来说卵母细胞发育过程一般会经历1~2次停滞过程;第一次停滞发生在PI期,此时形成灯刷染色体(lampbrush chromosome),并进行旺盛的转录翻译过程,为后期胚胎发育积累充足的营养物质、卵源mRNA以及酶等的物质[35]。有研究表明hsc70参与了卵母细胞灯刷染色体的转录活动[12]以及新生蛋白的折叠、组装、转移等过程[12]。在光裸星虫卵母细胞体腔液发育过程中,卵黄等营养物质的大量积累[16],这可能与Sn-hsc70在O3和O4时期的大量表达有关,说明Snhsc70可能对卵黄形成具有重要作用,而与灯刷染色体之间的关系还有待深入研究。
光裸星虫脱离体腔液后,卵母细胞失去了体腔液营养物质的供应,蛋白的合成减弱;此时卵母细胞停滞在第一次减数分裂的中期,灯刷染色体凝缩,转录也减弱。本研究发现,光裸星虫卵母细胞脱离体腔液后(O5-O6)Sn-hsc70的表达大幅下降,且表达量显著低于其他时期(P<0.05)。这可能与卵母细胞脱离体腔液环境、转录与蛋白质合成减弱等过程有关。
4 结论
Sn-hsc70基因全长2516 bp,具有3个Hsp70家族特征序列,2个核定位序列,1个胞质定位序列,以及4次连续重复的GGXP序列。胞质定位序列与核定位序列与Hsc70在细胞质和细胞核之间穿梭的功能相吻合;连续重复的GGXP以及3个Hsp70特征序列是鉴定Hsc70蛋白的重要依据。Sn-hsc70在体腔液发育时期的快速上升可能对卵黄积累具有重要作用;脱离体腔液后,Sn-hsc70表达量显著下调可能与卵母细胞转录与蛋白质合成减弱等有关。
