血液灌流联合连续性血液滤过治疗重症脓毒症并MODS 对免疫功能及血浆细胞因子的影响
2021-04-27陈智勇林国良蔡俊林饶丽霞
陈智勇 林国良 蔡俊林 饶丽霞
(1、莆田市急救中心,福建 莆田 351100;2、莆田市第一医院,福建 莆田 351100)
重症脓毒症具有高发生率,是由感染而引起的全身性炎症,主要是由大手术、休克、严重烧创伤引起,严重时会发展为多脏器功能障碍综合征(multiple organ disfunction syndrome,MODS)、脓毒性休克,致死率较高。连续性血液滤过(continuous ven0-venous hemofiltration,CVVH)治疗可减轻炎症反应程度,调节免疫系统平衡,有助于治疗脓毒症、MODS[1]。血液灌流(hemoperfusion,HP)通过体外循环将血液引入有吸附剂的容器中,可清除内源性、外源性毒物,达到净化血液的目的[2]。研究表明,早期采用CVVH 联合HP 可有效减轻全身性炎症,并遏制脓毒症,改善预后[3]。但目前尚无CVVH 联合HP治疗脓毒症并MODS 的相关研究,基于此,本文以重症脓毒症并MODS 患者为研究,分析CVVH 联合HP 治疗脓毒症并MODS 对免疫细胞T 淋巴细胞亚群、炎性因子、内毒素及器官功能恢复的影响,现作如下报道。
1 资料与方法
1.1 一般资料
选取2018 年1 月至2020 年9 月在我院诊治的重症脓毒症并MODS 患者94 例。本研究经医院医学伦理委员会批准。纳入标准:(1)均符合脓毒症[4]、MODS[5]的诊断标准,脓毒症发病1d 后,同时或者先后出现器官功能衰竭或者障碍2 个及以上,即可诊断为MODS;(2)患者签署知情同意书。排除标准:(1)恶性肿瘤、血液系统疾病、免疫性疾病;(2)1 个月内服用过免疫抑制药物、糖皮质激素药物;(3)治疗3d 内死亡或中途退出本研究者。
1.2 方 法
所有患者治疗前均给予营养支持、抗感染、液体复苏、机械通气、抗休克等。
1.2.1 对照组 给予CVVH 治疗,采用日本旭化成ACH-10 床旁血滤机,给予低分子肝素进行抗凝,血流量控制在180-220mL/h,置换液量控制为1L/h 进行8-12h 连续治疗。
1.2.2 研究组 在对照组的基础上给予HP 治疗,先进行2h 的HP 治疗,采用床旁血滤机和佛山市博新生物科技有限公司MG350 血液灌流器,给予低分子肝素进行抗凝,血流量控制在180-220mL/h,治疗时间为2h/次,每隔1d 治疗1 次,连续治疗3 次。再进行CVVH 治疗,CVVH 治疗方法同对照组。
1.3 观察指标
(1)于治疗前、治疗1d、治疗3d 抽静脉血5mL,采用3000r/min 的离心机进行15min 的离心处理,分离上清液待测。采用美国贝克曼CytoFLEX 流式细胞仪检测T 淋巴细胞亚群血CD3+、CD4+、CD4+/CD8+;采用酶联免疫吸附法(ELISA)检测血浆降钙素原(Procalcitonin,PCT)、肿瘤坏死因子α(Tumor necrosis factor α,TNF -α)、 白 细 胞 介 素 6(Interleukin 6,IL-6),试剂盒源自上海酶联生物科技有限公司;采用鲎试剂法检测内毒素,试剂盒源自湛江安度斯公司。(2)采用全身性感染相关器官功能衰 竭(Sepsis -related Organ Failure Assessment,SOFA)评分评估器官功能、急性生理学与慢性健康状况评分系统Ⅱ(acute physiology and chronic health evaluation scoring system Ⅱ,APACHE Ⅱ)评分评估病情严重程度,SOFA 评分越高,器官功能衰竭越严重;APACHE Ⅱ评分越高,疾病越严重。
1.4 统计学方法
对本次研究所得数据均采取SPSS22.0 统计软件展开分析。其中,计数资料以n(%)表示,行χ2检验;计量资料以±s表示,不同时点的比较采用重复测量数据的方差分析两组的组间差异性以及各时间点测量值的时间差异性,两组不同时间点指标对比采用独立样本t检验,两两对比采用LSD-t检验;两组组间比较采用独立样本t检验。以P<0.05 为差异有统计学意义。
2 结 果
2.1 两组一般资料比较
两组的性别、年龄、病史等各项资料比较,差异无统计学意义(P>0.05),见表1。
表1 两组一般资料比较 [n(%)/±s]

表1 两组一般资料比较 [n(%)/±s]
注:*为fisher 精确概率法P 值。
组别研究组对照组χ2/t 值P 值例数(n)47 47男28(59.57)31(65.96)女19(40.43)16(34.04)年龄(岁)64.89±18.68 63.66±20.54 0.304 0.762糖尿病16(34.04)19(40.43)0.41 0.522高血压22(46.81)19(40.43)0.389 0.533冠心病19(40.43)16(34.04)0.41 0.522合并消化系统疾病19(40.43)13(27.66)1.706 0.192合并泌尿系统疾病3(6.38)0(0.00)-0.242*合并呼吸系统疾病9(19.15)13(27.66)0.949 0.330性别0.410 0.522慢性疾病史
2.2 两组血清免疫功能指标比较
两组治疗前血清CD3+、CD4+、CD4+/CD8+比较,差异无统计学意义(P>0.05);研究组治疗后1d、3d血清CD3+、CD4+、CD4+/CD8+与治疗前比较均升高,差异有统计学意义(P<0.05),对照组治疗后3d 血清CD3+、CD4+与治疗前比较均升高,差异有统计学意义(P<0.05),对照组治疗后1d、3d 血清CD4+/CD8+与治疗前比较均升高,差异有统计学意义(P<0.05),研究组治疗后1d、3d 血清CD3+、CD4+、CD4+/CD8+与对照组比较均较低,差异有统计学意义(P<0.05)。见表2。
表2 两组不同时点血清免疫功能指标比较(±s)

表2 两组不同时点血清免疫功能指标比较(±s)
注:与治疗前比较,△P<0.05。
治疗前41.19±6.43 40.57±6.69 0.458 0.648治疗1d 54.53±9.28△42.14±5.34 7.932<0.001治疗3d 62.99±9.57△45.33±7.23△10.091<0.001治疗前24.89±7.97 25.49±8.66 0.349 0.728治疗1d 33.59±8.53△27.35±8.14 3.628<0.001治疗3d 41.72±9.69△28.24±6.84△7.792<0.001治疗前1.24±0.31 1.32±0.41 1.067 0.289治疗1d 1.81±0.51△1.48±0.41△3.474 0.001治疗3d 2.16±0.69△1.51±0.41△5.556<0.001 CD3+(%) CD4+(%) CD4+/CD8+组别研究组对照组t 值P 值例数(n)47 47
2.3 两组血浆细胞因子比较
两组治疗前血浆PCT、TNF-α、IL-6、内毒素比较,差异无统计学意义(P>0.05);治疗后1d、3d 两组血浆PCT、TNF-α、IL-6、内毒素与治疗前比较均降低,差异有统计学意义(P<0.05),且研究组与对照组比较均较低,差异有统计学意义(P<0.05)。见表3。
表3 两组不同时点血浆细胞因子比较(±s)
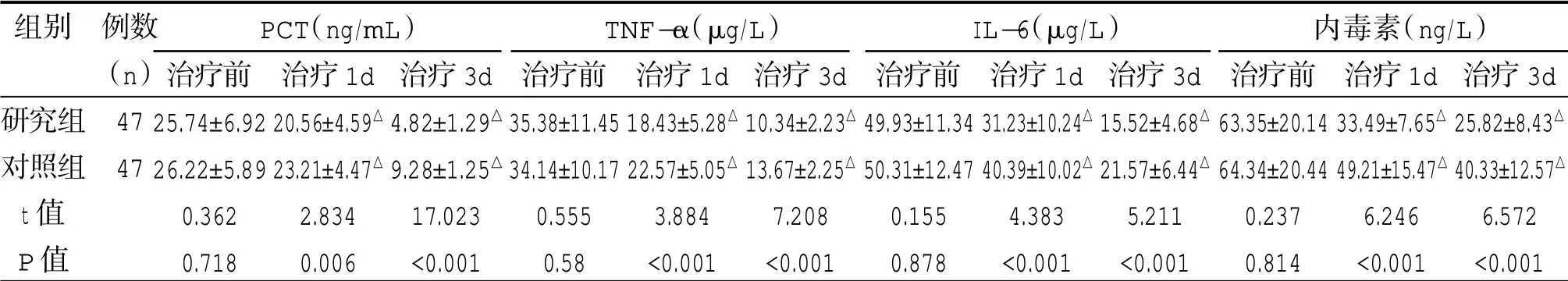
表3 两组不同时点血浆细胞因子比较(±s)
注:与治疗前比较,△P<0.05。
治疗前25.74±6.92 26.22±5.89 0.362 0.718治疗1d 20.56±4.59△23.21±4.47△2.834 0.006治疗3d 4.82±1.29△9.28±1.25△17.023<0.001治疗前35.38±11.45 34.14±10.17 0.555 0.58治疗1d 18.43±5.28△22.57±5.05△3.884<0.001治疗3d 10.34±2.23△13.67±2.25△7.208<0.001治疗前49.93±11.34 50.31±12.47 0.155 0.878治疗1d 31.23±10.24△40.39±10.02△4.383<0.001治疗3d 15.52±4.68△21.57±6.44△5.211<0.001治疗前63.35±20.14 64.34±20.44 0.237 0.814治疗1d 33.49±7.65△49.21±15.47△6.246<0.001治疗3d 25.82±8.43△40.33±12.57△6.572<0.001 PCT(ng/mL) TNF-α(μg/L) IL-6(μg/L) 内毒素(ng/L)组别研究组对照组t 值P 值例数(n)47 47
2.4 两组SOFA、APACHEⅡ评分比较
两组治疗前SOFA、APACHEⅡ评分比较,差异无统计学意义(P>0.05);研究组SOFA、APACHEⅡ评分治疗后1d、3d 与治疗前比较均降低,差异有统计学意义(P<0.05),对照组SOFA 评分治疗后3d 与治疗前比较降低,差异有统计学意义(P<0.05),对照组APACHEⅡ评分治疗后1d、3d 与治疗前比较均降低(P<0.05),研究组SOFA、APACHEⅡ评分治疗后1d、3d 与对照组比较均较低,差异有统计学意义(P<0.05)。见表4。
表4 两组不同时点SOFA、APACHEⅡ评分比较(±s,分)
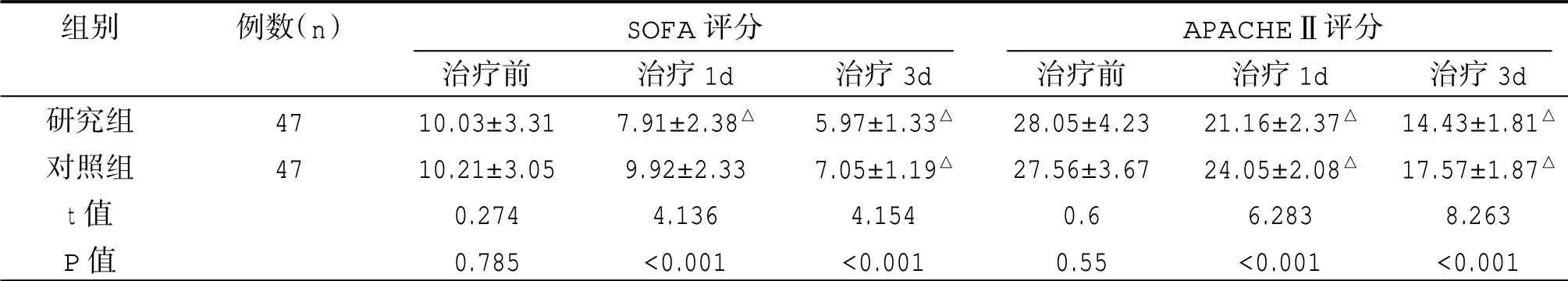
表4 两组不同时点SOFA、APACHEⅡ评分比较(±s,分)
注:与治疗前比较,△P<0.05。
组别研究组对照组t 值P 值例数(n)47 47治疗前10.03±3.31 10.21±3.05 0.274 0.785治疗1d 7.91±2.38△9.92±2.33 4.136<0.001治疗3d 5.97±1.33△7.05±1.19△4.154<0.001治疗前28.05±4.23 27.56±3.67 0.6 0.55治疗1d 21.16±2.37△24.05±2.08△6.283<0.001治疗3d 14.43±1.81△17.57±1.87△8.263<0.001 SOFA 评分 APACHEⅡ评分
3 讨 论
脓毒症的发生发展中,由于存在抗炎和促炎反应引起的非特异性免疫功能的亢进以及特异性免疫功能的抑制,因而抵御病原微生物侵入的能力减弱,最终导致MODS 甚至是死亡[6]。炎症-免疫反应是脓毒症生理病理的根本原因,炎性介质及内毒素在其中发挥重要作用,对各器官功能产生影响。在危重症领域中,CVVH 发挥重要作用,可清除炎性介质、稳定血流动力学,促进畸形肾衰竭的恢复、保持水电平衡、提供充足的营养物质[7]。但有研究表明,CVVH 由于本身亲水性、急性时相反应、分子构型、电荷、分子量等因素的影响以及CVVH 滤器的跨膜压、筛选系数、膜吸附力等因素的制约,因而其清除炎性介质具有局限性[8]。HP 借助体外循环,在装有吸附剂的容器中将血液引入,利用吸附剂清除毒物,从而净化血液[9]。HP 采用的吸附剂采用的是中性树脂,可改变吸附结构,增加吸附选择性,具有机械强度高、吸附容量大、吸附速率快等特点,且对人体无害[10]。
脓毒症的发病与多种炎症因子有关,PCT 是炎性反应标志物。研究表明,在脓毒血症中PCT 水平明显升高,且动态监测发现其水平与病情变化趋势相一致[11]。脓毒症患者体内内毒素呈异常高表达,会释放大量细胞因子和促炎介质,如TNF-α、IL-6,导致免疫功能紊乱[12]。本文研究中,治疗后1d、3d 研究组血清PCT、TNF-α、IL-6、内毒素明显低于对照组。分析原因在于,在脓毒症的发病机制中,炎症因子PCT、TNF-α、IL-6 发挥重要作用,这些炎症因子分子量相对较大,采用CVVH 不易通过滤器,而采用HP 联合CVVH 治疗,HP 的树脂吸附剂可吸附大分子量,因而HP 联合CVVH 可更有效清除炎症细胞。机体炎症细胞释放过多时,会导致许多免疫和生理被激活,加重炎性反应,导致免疫功能降低,对免疫功能的发挥造成影响。T 淋巴细胞亚群可反映免疫功能,其水平的变化可反映免疫功能的变化,在调控免疫功能中发挥重要作用[13]。在炎症反应状态下,T淋巴细胞亚群与正常机体比较有所降低,其中CD3+、CD4+下降,CD8+升高,免疫功能下降[14]。本文研究中,治疗后1d、3d 研究组血清CD3+、CD4+、CD4+/CD8+明显低于对照组,可见HP 联合CVVH 治疗后,机体免疫功能得到改善。SOFA 是用于评估器官功能衰竭的评分方法,包括肝脏、凝血、呼吸、神经、循环共5 个指标,常用于预测重症患者预后[15]。APACHE Ⅱ是目前使用最广泛,且权威性较高的评分方法,使用方便且简单,可客观评价急危重症的病情,并可预测预后[16]。本文研究中,治疗后1d、3d 研究组SOFA、APACHE Ⅱ评分明显低于对照组,可见HP 联合CVVH 治疗重症脓毒症并MODS 患者,可降低SOFA、APACHE Ⅱ评分,促进器官功能恢复,改善预后。
综上所述,HP 联合CVVH 治疗重症脓毒症并MODS 患者,可有效清除炎症细胞、内毒素,改善免疫功能,促进器官功能恢复。
