玉米芯发酵料水浸提液促平菇菌丝生长的机理研究
2021-04-27胡素娟宋凯博刘芹崔筱张玉亭孔维丽
胡素娟,宋凯博,刘芹,崔筱,张玉亭,孔维丽
(河南省农业科学院植物营养与资源环境研究所,河南 郑州 450002)
平菇(Pleurotusostreatus)肉质肥厚、味道鲜美,适应性强[1],在全球广泛栽培,是中国栽培量最大、栽培范围最广的食用菌之一[2]。发酵料是利用培养料中自然菌群发酵升温,从而杀灭杂菌,增强了基质对多种菌物的选择性[3]。发酵料栽培平菇技术采用开放式接种,简化了生产工艺,提高了接种效率,该技术在河南[4]、山东[5]、河北[6]等地被广泛应用。玉米是中国三大粮食作物之一,玉米芯资源丰富,价格便宜(400~600元·t-1),玉米芯含有32%~36%的纤维素,17%~20%的木质素,35%~40%的半纤维素[7],是栽培平菇的优质原料,作物秸秆栽培食用菌延长了农作物产业链条,促进了秸秆资源化利用。龚娜等[8]研究了玉米芯对平菇菌丝体生长和胞外纤维素酶活性的影响,王庆武等[9]研究了玉米芯添加量对平菇综合农艺性状的影响,刘仁华[10]研究了不同配比玉米芯对平菇生长的影响,但这些研究均是玉米芯熟料栽培平菇模式。孔维丽[11]研究出玉米芯发酵料添加10%麸皮,生物学效率大幅提升,胡素娟[12]比较了玉米芯、棉籽壳2种发酵料基质对平菇胞外酶活性的影响,KONG等[13]研究发现,玉米芯培养料发酵过程中,随培养料发酵温度的升高发酵微生物种类、数量增加,微生物将培养料中的复杂的有机质(纤维素、半纤维素、木质素等)进行降解,使其变成简单、易于利用的氨基酸和糖类等小分子物质,从而为平菇菌丝生长提供所需的营养。玉米芯发酵料是否促进平菇菌丝生长,促菌丝生长机理尚未见报道。本试验系统研究玉米芯培养料不同发酵时期及不同浓度水浸提液对平菇菌丝长势、生长速度、细胞形态,胞外酶活性、能量与呼吸代谢相关酶活性的影响,揭示发酵料促进平菇菌丝生长的机理,为改善玉米芯发酵工艺及发酵料栽培平菇提供理论基础。
1 材料与方法
1.1 材料
1.1.1 供试菌株 平菇黑平17-1由河南省农业科学院植物营养与资源环境研究保存。
1.1.2 培养基配方 PDA培养基:马铃薯200 g,葡萄糖20 g,琼脂20g,水1 000 mL;PDB培养基:马铃薯200 g,葡萄糖20 g,水1 000 mL;发酵培养料配方(质量分数):玉米芯84%,麸皮10%、尿素1%,石灰5%,m(料)∶m(水)=1∶2.4。
1.1.3 主要试剂和仪器 琼脂粉,琥珀酸脱氢酶(SDH)试剂盒、碱性磷酸酶(AKP)试剂盒、三磷酸腺苷酶(ATP)试剂盒、纤维素酶试剂盒、中性木聚糖酶、酪蛋白均购自北京索莱宝科技有限公司,ABTS购自麦克林公司。
SPX-150B-Z生化培养箱、SW-CJ-1D超净工作台、BXM-30R立式灭菌锅(上海博迅实业有限公司),奥林巴斯BX53光学显微镜(奥林巴斯株式会社),JXFSTPRP-24 研磨仪(上海净信科技有限公司)、紫外分光光度计(上海仪电分析仪器有限公司)、高速冷冻离心机CR22N(西格玛仪器有限公司)。
1.2 试验方法
1.2.1 发酵料浸提液的制备 按照 DB41/T2045—2020的发酵方法,制作250 kg发酵料,发酵10 d,每间隔2 d翻堆一次,取混合均匀的培养料,共取5次,分别编号D1(2 d)、D2(4 d)、D3(6 d)、D4(8 d)、D5(10 d),按照1∶2的质量比例加蒸馏水,室温静置浸泡4 h,用四层纱布过滤,得浸提液滤液原液,121 ℃灭菌30 min备用。
1.2.2 发酵料浸提液对平菇菌丝的影响测定方法 不同时期发酵料浸提液对菌丝生长速度的测定:分别取(D1-D5)5个时期发酵料浸提原液1 000 mL,加入20 g琼脂粉,制作固体培养基,分别接种直径5 mm的平菇菌种块,25 ℃培养6 d,每个处理接种3组,每组3个重复,以不加发酵料浸提液的PDA培养基为对照(CK),采用十字划线法测量6 d菌丝生长长度,计算菌丝生长速度,菌丝生长速度(cm·d-1)=菌丝平均生长量(cm)/培养天数(6 d)。不同体积分数发酵料浸提液对平菇菌丝生长速度的测定:取D5时期的浸提液原液,按照20%、40%、60%、80%、100%浸提液体积分数分别加入PDA培养基,制作固体培养基,分别接种平菇菌丝,25 ℃培养6 d,每个处理3组,每组3个重复,以不加发酵料浸提液的PDA为对照,采用十字划线法测量6 d菌丝生长长度,计算菌丝生长速度,菌丝生长速度计算方法同上。不同体积分数发酵料浸提液对平菇菌丝生物量的测定:取D5时期浸提液,按照20%、40%、60%、80%、100%体积分数分别加入PDB培养基内,制作成液体培养基,将10块直径为5 mm的平菇母种接种于装有100 mL液体培养基的250 mL三角瓶内,25 ℃,150 r·min-1震荡培养180 h后收集菌丝体,60 ℃烘干后称量菌丝体干质量(mg),每个处理3组,每组3个重复,以不加发酵料浸提液的PDB培养基为对照。
1.2.3 发酵料浸提液对平菇菌丝细胞生长的测定 以80%体积分数浸提液固体培养基接种平菇菌丝,25 ℃培养5 d,以不加发酵料浸提液的PDA培养基为对照(CK),取菌丝体制作样本,透射电镜观察菌丝体细胞形态。
1.2.4 发酵料浸提液对平菇菌丝代谢酶活性的测定 以80%和100%体积分数浸提液为培养基接种平菇菌丝,按照1.2.1不同浓度发酵料浸提液对平菇菌丝生物量的测定的接种方法接种,以不加发酵料浸提液的PDB培养基为对照,3组处理分别接种15瓶于 25 ℃,150 r·min-1震荡培养180 h,期间每间隔36 h,分别记为T1(36 h)、T2(72 h)、T3(108 h)、T4(144 h)、T5(180 h)收集菌丝体取样,每次每一时期取样3瓶为3个重复。取样结束后,称取1 g菌丝体低温研磨,用碱性磷酸酶(AKP)试剂盒、琥珀酸脱氢酶(SDH)试剂盒、Na+,K+-ATP酶(ATP)试剂盒检测AKP酶、SDH酶、ATP酶的活性。
AKP酶活性定义:37 ℃中,每g菌丝体内每天释放1 nmol酶为1个酶活性单位(U)。
AKP/(U·g-1)=[C×(A1-A2)]×V1÷W÷T×1 000=725×ΔA÷W
式中:C标准液浓度0.5 μmol·L-1;V1为催化体系总体积,1.45 mL;W为样本质量,g;T为催化反应时间,24 h=1 d;1 000为单位换算系数。
SDH酶活性定义:每g菌丝体在反应体系中每分钟消耗1 nmol 2,6-二氯酚靛酚定义为1个酶活性单位(U)。
SDH/(U·g-1)=[(ΔA1-ΔA2)÷(ε×d)×V1×109]÷(V2÷V3)÷T=1 571.111×(ΔA1-ΔA0)÷W
式中:ΔA1为ΔA测定;ΔA20为ΔA空白;V1为反应总体积0.98×10-3L;ε为2,6-二氯吲哚酚摩尔消光系数,21×103L·mol-1·cm-1;d为比色皿光经,1 cm;V1为加入样本体积0.03 mL;V2加入试剂1、试剂2体积和1.01 mL;T为反应时间1 min;W为样品鲜质量(g)。
ATP酶活性定义:每小时每克样品中Na+,K+-ATP酶分解ATP产生1 μmol无机磷的量为1个酶活性单位。
ATP/(U·g-1)=C×(A1-Ak)÷(Ak-A0)×V0÷(V1÷V2×W)÷T=7.5×ΔA1÷ΔA2÷W
式中:C为标准管浓度0.5 μmol·mL-1;V0为酶促反应总体积0.5 mL,V1为加入样本体积0.2 mL;V2加入的试剂1体积1 mL;T反应时间,1/6 h;W为样本鲜质量(g)
1.2.5 发酵料浸提液对平菇菌丝胞外酶活性的影响 按照1.2.3的培养方法,每间隔36 h取一次样,分别记为T1(36 h)、T2(72 h)、T3(108 h)、T4(144 h)、T5(180 h),培养液过滤后,12 000 r·min-1离心10 min得滤液。采用纤维素酶、中性木聚糖酶试剂盒测定培养液CMC酶、木聚糖酶活性,按照DB41/T 1615—2018的方法测定漆酶的活性。根据文献[12]的方法检测蛋白酶活性。
1.2.6 数据处理 数据处理采用Microsoft Excel2009,差异性分析采用SPSS19(SPSS Inc,Chicago,USA)。
2 结果与分析
2.1 不同时期发酵料浸提液对菌丝生长的影响
试验结果表明,发酵周期内不同发酵阶段(D1~D5)浸提液对平菇菌丝生长速度、长势影响差异显著,D2、D3、D4、D5 4个时期菌丝生长速度均显著性快于CK(P<0.05),但长势较CK弱。
随着发酵时间的延长,菌丝生长速度加快,D5时期菌丝生长速度最快,为1.59 cm·d-1,与D4(1.58 cm·d-1)时期差异不显著,较D1、D2、D3菌丝生长速度分别快0.32、0.17和0.05 cm·d-1,较CK快0.33 cm·d-1,D1时期菌丝长势较稀疏,与CK菌丝生长速度差异不显著,D2~D5时期菌丝洁白但稀疏(见表1、图1)。

表1 发酵料浸提液对平菇菌丝生长的影响Table 1 Effects of the extract from fermentation medium on the mycelial growth of Pleurotus ostreatus mycelia
2.2 不同体积分数发酵料浸提液对平菇菌丝生长的影响
试验结果表明,随着添加发酵料浸提液体积浓度的增加,培养基上平菇菌丝生长速度加快,长势增加,菌丝体生物量增加。发酵料浸提液为80%体积分数时,平菇菌丝生长速度最快(1.65 cm·d-1),分别比对照(CK)和发酵料浸提液体积分数为20%、40%、60%、100%时高0.53、0.18、0.08、0.05和0.08 cm·d-1,其中40%和100%体积分数时,菌丝生长速度无差异。发酵料浸提液为20%~80%体积分数时,平菇菌丝长势洁白旺盛,与CK无差异,但100%体积分数时,平菇菌丝长势稀疏。
CK培养基内添加不同体积分数发酵液,随体积分数的增加平菇菌丝干质量增加,80%体积分数菌丝干质量最多,为3.51 mg,较CK高1.79 mg,较20%、40%、60%分别高0.61、0.56和0.29 mg;100%体积分数干质量最少,为0.86 mg。

表2 发酵料浸提液对平菇菌丝生长速度、干质量的影响Table 2 Effects of the extract from compost medium on the growth rate and dry mass of Pleurotus ostreatus mycelia
2.3 发酵料浸提液对平菇菌丝细胞生长的影响
扫描电镜结果如图1所示,80%体积分数处理后(图1b),平菇菌丝细胞内线粒体数量、囊泡数量较CK(图1a)显著增加,囊泡的大小不一,细胞形态没有变化。线粒体的主要功能为参与三羧酸循环和呼吸代谢,为菌丝生长提供能量,生长旺盛的食用菌菌丝中含有大量的线粒体。食用菌菌丝的生长点局限于顶端,菌丝顶端的下方为顶端生长提供生长必需的能量、酶、原料和膜,且顶端生长的原料多是由膜包围的囊状物输送的。

注:M:线粒体,N:囊泡Note:M:mitochondria,N:niosome图1 发酵料浸提液对平菇菌丝细胞的影响Fig.1 Effects of the extract solutions from fermentation medium on the cell morphology of Pleurotus ostreatus mycelia
2.4 发酵料浸提液对平菇菌丝代谢酶活性的影响
2.4.1 发酵料浸提液对平菇菌丝AKP活性的影响 AKP是存在于细胞壁和细胞膜之间的一种酶,在碱性条件下水解多种磷酸酯,具有转磷酸基作用的一组酶,参与细胞内磷的代谢。结果表明:培养过程中平菇菌丝AKP活性呈增加趋势,T4时期达到最高,T5时期略有下降。发酵料浸提液为80%、100%体积分数时,AKP酶活性均显著性高于CK。T4时期,80%体积分数的AKP活性最高,为20 604 U·g-1,较100%体积分数(18 403 U·g-1)高2 201 U·g-1,较CK(15 779 U·g-1)高4 825 U·g-1;T5时期80%体积分数AKP酶活性为18 737 U·g-1,较T1、T2、T3时期分别高15 962、2 859、251 U·g-1,100%体积分数AKP酶活性为17 230 U·g-1,较T1、T2、T3时期分别高15 221、3 533、137 U·g-1(图2)。

图2 发酵料浸提液对平菇菌丝AKP活性的影响Fig.2 Effects of the extract solutions from fermentation mediumon AKP activity of Pleurotus ostreatus mycelia
2.4.2 发酵浸提液对平菇菌丝SDH酶活性的影响 SDH酶结合于线粒体内膜上,是连接氧化磷酸化与电子传递的枢纽之一,可以为真核细胞线粒体需氧和产能的呼吸链提供电子,是线粒体的一种标志性酶。试验结果表明:培养过程中CK和80%体积分数处理平菇菌丝SDH酶活性呈先升高后降低趋势,T4时期活性最高;100%体积分数处理后SDH酶活性呈上升趋势,T5时期达到最高,三者之间SDH酶活性差异显著。T4时期80%体积分数处理的SDH酶活性最高,为19.3 U·g-1,分别较CK(12.9 U·g-1)、100%体积分数高6.4、7.2 U·g-1;T5时期,80%体积浓度处理的SDH酶活性降至17.1 U·g-1,较CK(10.2 U·g-1)、100%体积浓度(11.1 U·g-1)分别高6.9、6.0 U·g-1,T5时期100%体积分数SDH酶活性升至最高(11.1 U·g-1),但较CK(T4时期)低1.8 U·g-1(图3)。

图3 发酵料浸提液对平菇菌丝SDH酶活性的影响Fig.3 Effects of the extract solutions from fermentation medium on SDH enzyme activity of Pleurotus ostreatus mycelia
2.4.3 发酵料浸提液对平菇菌丝ATP酶活性的影响 ATP酶的活性与菌丝的生长能量代谢关系密切,是生物体能量代谢的关键酶。试验结果表明:菌丝生长过程中,ATP酶活性随平菇菌丝生长呈先升高后降低趋势,T2时期,80%、100%体积分数平菇菌丝ATP酶活性最高,T3时期CK菌丝体ATP酶活性最高,T5时期均降至最低。80%体积分数ATP酶活性最高为33.1 U·g-1,分别较100%体积分数(30.7 U·g-1)和CK(28.1 U·g-1)高2.4、5 U·g-1,100%体积分数较CK(T3时期)高2.6 U·g-1(图4)。

图4 发酵料浸提液对平菇菌丝ATP酶活性的影响Fig.4 Effects of the extract solutions from fermentation medium on ATP aseactivity of Pleurotus ostreatus mycelia
2.5 发酵浸提液对平菇菌丝胞外酶活性的影响
2.5.1 发酵浸提液对平菇CMC酶活性的影响 纤维素酶活性的高低反映了培养液里面葡萄糖利用水平的变化。试验结果表明:不同体积浓度平菇菌丝体纤维素酶活性呈下降趋势且差异显著,T1时期菌丝纤维素酶活性最高,80%体积分数为18.9 U·min-1·mL-1,而100%体积分数和CK分别为5.81和49 U·min-1·mL-1;T5时期,80%体积分数降至6.30 U·min-1·mL-1,而100%体积分数和CK分别为1.10和35 U·min-1·mL-1(图5)。

图5 发酵料浸提液对平菇菌丝CMC酶活性的影响Fig.5 Effects of the extract solutions from fermentation medium on CMCase activity of Pleurotus ostreatus mycelia
2.5.2 发酵浸提液对平菇菌丝木聚糖酶活性的影响 木聚糖酶活性的高低反映了培养液内木聚糖利用水平的变化。试验结果表明液体培养平菇菌丝,木聚糖酶呈先上升后降低趋势,T3时期各处理木聚糖酶活性最高,T5时期木聚糖酶活性略高于T1时期。T3时期80%体积分数为10.5 U·min-1·mL-1,高于100%体积分数2.50 U·min-1·mL-1,较CK处理低7.60 U·min-1·mL-1;T5时期80%体积分数(8.8 U·min-1·mL-1)、100%体积分数(7.8 U·min-1·mL-1)和CK(15.3 U·min-1·mL-1)处理分别较T1时期高0.70、0.80、0.70 U·min-1·mL-1;100%体积浓度T2~T5时期木聚糖酶活性为7.8~8.0 U·min-1·mL-1,木聚糖酶活性变化差异不显著。
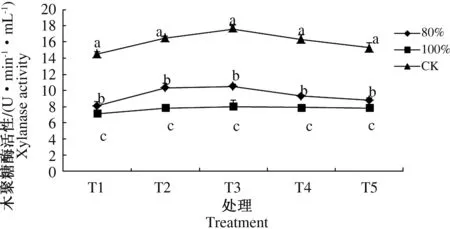
图6 发酵料浸提液对平菇菌丝木聚糖酶活性的影响Fig.6 Effects of the extract solutions from fermentation medium on xylanase activity of Pleurotus ostreatus mycelia
2.5.3 发酵料浸提液对平菇菌丝漆酶活性的影响 试验结果表明:液体培养平菇菌丝,随培养时间的延长漆酶活性呈增加趋势,T5时期菌丝体漆酶活性最高,不同处理间平菇菌丝漆酶活性差异显著。T5时期80%体积分数漆酶活性为13.1 U·min-1·mL-1,较100%体积分数(10.1 U·min-1·mL-1)高30%,两者分别是CK处理的960%、740%,分别较T1时期增加了11.0倍和5.9倍(图7)。

图7 发酵料浸提液对平菇菌丝漆酶活性的影响Fig.7 Effects of the extract solutions from fermentation medium on laccase activity of Pleurotus ostreatus mycelia
2.5.4 发酵浸提液对平菇菌丝蛋白酶活性的影响 试验结果表明:液体培养周期内,随培养时间的延长,平菇菌丝蛋白酶活性呈降低趋势,T1时期最高,T5时期最低。T1时期80%体积分数蛋白酶活性为91.7 U·min-1·mL-1,分别较100%体积分数 (77.5 U·min-1·mL-1)高14.2 U·min-1·mL-1,较CK(44.1 U·min-1·mL-1)高47.6 U·min-1·mL-1;T5时期80%体积分数蛋白酶活性降至44.1 U·min-1·mL-1,较T1时期降低了107.7%,较T5时期100%体积分数(40.1 U·min-1·mL-1)高10%,两者分别比CK处理(31.5 U·min-1·mL-1)高40.0%、27.3%(图7)。

图8 发酵浸提液对平菇菌丝蛋白酶活性的影响Fig.8 Effects of the extract solutions from fermentation medium on protease activity of Pleurotus ostreatus mycelia
3 结论与讨论
3.1 结论
玉米芯发酵培养料浸提液培养平菇菌丝,随培养时间的延长菌丝生长速度加快,发酵结束时D5时期平菇菌丝生长最快(1.59 cm·d-1)与D4时期无显著差异,较CK快0.33 cm·d-1,但发酵浸提液培养基平菇菌丝长势较CK稀疏;当CK培养基内添加20%~80%体积分数的浸提液时,随体积分数的增加平菇菌丝生长速度加快,菌丝体干质量增加。添加80%体积分数时,平菇菌丝生长速度最快(1.65 cm·d-1)、干质量最多(3.51 mg),分别较CK(1.12 cm·d-1、1.72 mg)高0.53 cm·d-1、1.79 mg,与100%体积分数的浸提液相比,菌丝干质量增加了2.65 g,菌丝生长速度呈显著性差异。
添加80%体积分数的发酵料浸提液培养平菇菌丝,与呼吸及能量代谢相关的AKP酶、SDH、ATP酶活性最高,T4时期AKP酶活性最高(20 604 U·g-1)较CK(15 779 U·g-1)高4 825 U·g-1,较100%体积分数(18 403 U·g-1)高2 201 U·g-1,SDH酶活性(19.3 U·g-1)较CK(12.9 U·g-1)高6.4 U·g-1,较100%体积分数(12.1 U·g-1)高7.2 U·g-1;T2时期ATP酶活性(33.1 U·g-1)最高,较T3时期CK(30.5 U·g-1)高2.6 U·g-1,较T2时期100%体积分数(30.7 U·g-1)高2.4 U·g-1;随菌丝生长,分泌到胞外的CMC酶、蛋白酶活性呈下降趋势,漆酶呈上升趋势,木聚糖酶活性呈缓慢先升后下降趋势,T1时期CMC酶活性最高(18.9 U·min-1·mL-1)较CK(49 U·min-1·mL-1)低30.1 U·min-1·mL-1,较100%体积分数(5.81 U·min-1·mL-1)高13.09 U·min-1·mL-1;漆酶活性最高(13.1 U·min-1·mL-1)较CK(1.37 U·min-1·mL-1)高11.73 U·min-1·mL-1,较100%体积分数(10.1 U·min-1·mL-1)高2.0 U·min-1·mL-1;蛋白酶活性最高(91.7 U·min-1·mL-1)较CK(44.1 U·min-1·mL-1)高47.6 U·min-1⋅mL-1,较100%体积分数(77.5 U·min-1·mL-1)高14.2 U·min-1·mL-1。
透射电镜显微观察的结果表明:PDB培养基内添加80%体积分数发酵料浸提液培养平菇菌丝,细胞内囊状体、线粒体数量增加,细胞大小基本无变化。
3.2 讨论
酶与食用菌的生长发育有密切的关系,它们能分泌各种胞外酶,这些胞外酶主要有纤维素酶、半纤维素酶、漆酶、蛋白酶等,通过这些酶的作用将原料分解成可溶于水的小分子糖、氨基酸等,然后再被细胞吸收,这些小分子物质进入细胞后,在胞内酶系的作用下,进一步分解形成能源、还原力和碳架以供食用菌生长和发育的需要。食用菌分泌酶能力的大小和酶量的多少,很大程度上决定了食用菌菌丝生长的快慢、好坏[14-18]。本研究在PDB培养基内添加80%体积分数的发酵培养料浸提液,随菌丝的生长漆酶活性呈上升趋势,CMC酶、蛋白酶、木聚糖酶呈下降趋势,与液体培养姬松茸漆酶活性变化一致;80%体积分数平菇菌丝生长速度、生物量、漆酶、蛋白酶、CMC酶、木聚糖酶活性菌高于CK(对照)培养基,与完全培养基培养斑玉蕈菌株5种胞外酶(漆酶、锰过氧化物酶、木素过氧化物酶、木聚糖酶、纤维素酶)活性高于低碳氮盐培养基结果一致[19],表明添加了发酵浸提液的液体培养基营养较CK丰富。酶活高,菌丝生长快,生物量高,这与吴亚召等[20]、陈国梁等[21]的研究一致。
酶活性的大小受温度、pH值[22]、营养、光照[23]、生长调节物质[24-25]、外源添加物[26]、微量元素[27]等因素的影响。低浓度的IAA、Mg2+可以促进食用菌菌丝的生长,提高平菇菌丝胞外酶的活性。Mg2+是植物光合作用的主要元素,在玉米芯等农作物秸秆中广泛存在,秸秆原料在发酵过程中微生物的代谢是否降解产生游态的Mg2+,微生物代谢过程中是否产生IAA等生长素还有待进一步验证和检测。平菇、双孢蘑菇培养料发酵过程中通过细菌作用使秸秆的木质素、纤维素、半纤维降解为简单糖类,放线菌将培养料的 N 源物质转化为菌丝可吸收利用的蛋白氮[28-29],平菇菌丝能够很好地同化葡萄糖和蔗糖等简单糖类已成共识,推断是这些简单的可以直接利用的糖类及蛋白氮促进了平菇菌丝胞外酶活性的提高,与金针菇漆酶[30]活力在简单碳源和氮源培养基高于复杂碳源、氮源培养基的结果相一致。琥珀酸脱氢酶(SDH)、ATP酶、AKP酶位于线粒体上,参与细胞的呼吸和能量代谢[31],菌丝干质量增加,线粒体和囊状液泡的增加,促进了琥珀酸脱氢酶(SDH)活性增加,呼吸作用增加,菌丝生长加快,代谢能量增强,ATP酶的活性增加。
