基于蛋白质二级结构热稳定性的正交方法
2021-04-26陈中卢星宇
陈中 卢星宇
(1. 中山大学化学学院,广州 510275;2. 西湖大学分子科学公共实验平台 浙江省功能分子精准合成重点实验室,杭州 310024)
蛋白质是由氨基酸经“脱水缩合”的方式组成的多肽经过折叠形成的具有一定空间结构的物质,是构成生物体的三大基础物质之一,机体所有重要的组成部分都需要蛋白质的参与。人体内蛋白质都是由20 种氨基酸按不同比例组合而成,但是性质和生物功能各不相同,其原因与蛋白质的空间结构密切相关。确定蛋白质构象最准确的方法是X-射线晶体衍射[1-6],但对结构复杂、柔性的生物大分子蛋白质来说,得到所需的晶体结构较为困难。二维、多维核磁共振技术能测出溶液状态下较小蛋白质的构象[3,7-9],可是对分子量较大的蛋白质的计算处理非常复杂。近十多年来,冷冻电镜发展迅速,成为蛋白结构解析的利器,在生命科学领域实现了很多重大科学成果的突破[10-12],然而其价格非常昂贵,机时紧张,需要非常专业的技术人员,尚不足以满足大量课题组的需求。
通过测量蛋白质的CD 谱,能够分析和计算出蛋白质大分子的二级结构组成,方法简单、快捷,广泛应用在蛋白质折叠,蛋白质构象研究,酶动力学等领域[4-5,13-18]。如图1 所示,圆二色光谱的远紫外波段,近紫外波段及可见波段分别可以研究蛋白的二级结构、三级结构及金属蛋白复合结构的相互作用。通常蛋白质的二级结构都会在CD 谱的紫外区段(180-260 nm)有明显的信号,主要生色团是肽链,这一波长范围的CD 谱包含了生物大分子主链构象的信息。如表1 所示,主要构象包括α-螺旋、β-折叠、β-转角、P2 结构及无规卷曲。
蛋白质在一定的物理和化学条件(加热、加压、脱水、振荡、紫外线照射、超声波、强酸、强碱、尿素、重金属盐、十二烷基硫酸钠)下,其空间构象容易发生改变而失活,因此研究蛋白的构象和构型变化对其功能和应用有重要的价值。蛋白质的变性作用主要是由于蛋白质分子内部的结构被破坏。天然蛋白质的空间结构是通过氢键等次级键维持的,而变性后次级键被破坏,蛋白质分子就从原来有序的卷曲的紧密结构变为无序的松散的伸展状结构(但一级结构并未改变)。热变性是蛋白质变性中最常见的一类现象,圆二色光谱的变温检测可以研究蛋白热变性过程,并通过拟合直接获取蛋白质的热变性中点温度Tm 值和记录整个热变性过程,对研究蛋白组分的热稳定性及在外界环境改变时的变性过程具有重要的科学价值。
本实验开发一种测定蛋白二级结构热稳定性的正交方法,以在180-260 nm 范围内的圆二色全光谱热变性测试来考察蛋白质构象随温度的变化而改变的全过程。同之前的单波长法相比,本方法的操作难度没有增加,耗时和样品量保持一致,避免了单波长如何选点的问题,通过一次测量,既观测了各个波长的圆二色信号随温度变化的曲线,也观测了圆二色光谱在程序升温过程中的各个温度点的变化,从而更全面地观测蛋白质的整体结构热变性过程,这是单波长法无法观测到的信息。

图1 圆二色光谱用于蛋白结构的分析
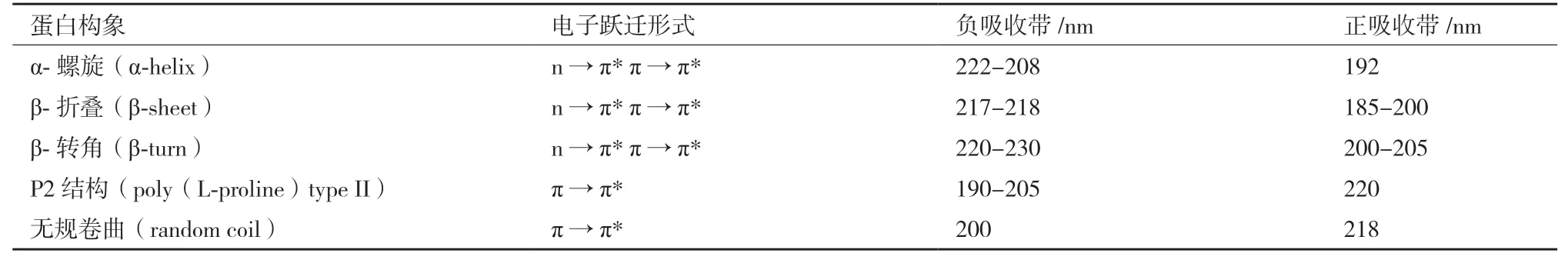
表1 蛋白二级结构空间构象的CD 谱分析
1 材料与方法
圆二色光谱仪采用英国应用光物理公司Applied Photophysics Ltd 的Chirascan-V100。牛血清蛋白(CAS号:9048-46-8)和血红蛋白(CAS 号:9008-02-0)来自上海阿拉丁生化科技股份有限公司。配溶液用的纯水来自屈臣士纯净水。圆二色光谱检测用的比色皿的光程为0.5 mm。
2 结果
下面以牛血清蛋白(BSA)和血红蛋白(HGB)为例,用全光谱正交法来分析蛋白样品的热变性过程。
2.1 蛋白热变性实验的浓度优化
为了选择合适的蛋白浓度进行热变性实验,配置了从0.01-1 mg/mL 的5 种浓度的蛋白,分别测试它们的吸光度值和CD 值。
如图2 所示,当蛋白浓度在0.1-0.5 mg/mL 时,吸光度值在0.4-2 左右,此区间是测试CD 谱的合适范围,对应的CD 谱曲线除强度不同,形状完全一致。当蛋白浓度低于0.01 mg/mL,曲线已不能准确看出蛋白结构。当蛋白浓度在1 mg/mL 的量级上,其吸光度在3.5 左右,吸光度值过高导致圆二色光谱不能准确检测,在CD 谱上可见180 nm 附近的曲线方向与其他3 个稍有不同。将有CD 信号的4 个浓度的蛋白进行热变性实验。同时监控它们的吸光度和CD 谱曲线的变化。

图2 BSA 蛋白的不同浓度的吸光度(A)和圆二色光谱(B)
通过图3 的吸光度曲线分析,可以看出BSA蛋白的吸光度在0.1 mg/mL 和0.25 mg/mL 时随着温度的升高变化较小,在0.5 mg/mL 时变化较大,而1 mg/mL 时变化明显。图4 的CD 谱曲线表明当蛋白浓度小于1 mg/mL 时,蛋白的热变性趋势接近一致,而1 mg/mL 的蛋白由于吸光度较大,CD 谱曲线在高吸光度区域出现大幅度震荡的噪音信号,显示其不是适于进行蛋白二级结构的检测的合适浓度,所以测试蛋白的热变性过程的浓度在0.1-0.5 mg/mL为宜。
2.2 蛋白热变性构象的软件分析
当测完一组蛋白的热变性实验后,通过Global3热力学分析软件,如图5 的每一个图都有6 个窗口,从左上方到右下方可以得到以下信息:(1)每个波长的圆二色变温曲线;(2)特征温度点的圆二色图谱(如起始图谱、变性中点温度的图谱);(3)温度-波长CD 三维图;(4)计算出的浓度分布作为温度的函数;(5)噪音三维图;(6)计算出的热力学参数(Tm 值和构象的焓变)。前5 个窗口根据每个波长的变温曲线,逐步计算出此蛋白的Tm值,同时也证实此分析结果的可靠性发现,3 种适合浓度BSA 的Tm 值都在65.5℃;所以只要吸光度在合理的区间(0.2 < A < 3),Tm 值不受浓度的影响。

图4 BSA 蛋白4 种浓度热变性的CD 谱

图5 Global3 软件分析BSA 蛋白3 种浓度热变性结果
除了热变性分析软件,使用CDNN 软件做蛋白构象的拟合分析,从蛋白热变性过程的圆二色谱中的选取3 个温度的波长曲线:起始温度点(20℃),中间温度点(56℃)和最终温度点(96℃),用软件计算其蛋白的二级结构。图6 的结果可以看到,BSA 蛋白最初的状态是螺旋态为主,随着温度的逐渐升高,CD 谱的强度下降,螺旋结构向转角和无规卷曲逐渐变化,具体表现为构象从α 螺旋向β 转角和无规卷曲转化,说明随着温度的上升,蛋白构象的总体变化是一个从有序到无序的过程,最终无规卷曲所占的比例最大。
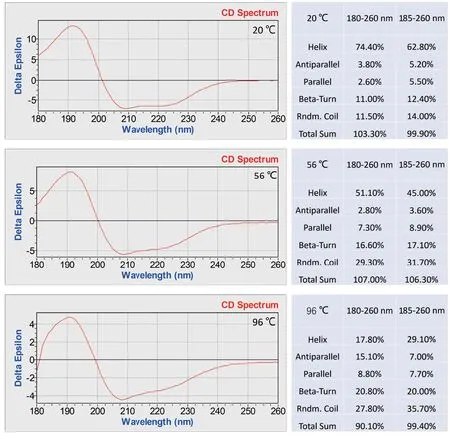
图6 BSA 蛋白构象CDNN 软件分析结果
2.3 其他蛋白的热变性测试分析
除了BSA 蛋白外,还用血红蛋白(Hemoglobin,HGB)进行热变性实验,根据上述测试结果,血红蛋白的浓度选用0.25 mg/mL 进行测试。
测试结果如图7 所示,相比于BSA 血清蛋白,血红蛋白的热变性过程更加明显,当温度在96℃时,蛋白的CD 信号非常微弱,剧烈的热变性过程表明此蛋白对于温度变化更加敏感。从图8 的Global 3软件可以分析出此血红蛋白的Tm 值55.9℃,略低于前面的血清蛋白,也说明血红蛋白的热稳定性相对血清蛋白较低。图9 的CDNN 的分析结果与血清蛋白类似,随着温度上升,同样是发生从α 螺旋向β 转角和无规卷曲的构象转化。
2.4 单波长测试对比
作为对比,采用单波长法重复上面的实验。以BSA(0.25 mg/mL)为例,进行一组蛋白热变性单波长法的测试。如图10 和表2 所示,根据全谱曲线选出3 个极值点(191 nm、208 nm、222 nm),一个随机点(235 nm),一个端点(260 nm)和一个特殊的交叉点(203 nm),分别做6 个单波长蛋白热变性曲线。数据经拟合图10 所示,在所有的极值点的Tm值都在65-66℃,中间随机点也在65-66℃,端点有两个值分别在的在54℃和80℃附近,特殊交叉点在52℃左右。所以单波长测试与选取的波长位置有很大关系,选取的3 个极值点的结果都是一致的,与全谱所测的Tm 值基本一致,因为极值点反应的是蛋白构象对温度最敏感的部分,中间任意点只要有足够的变化,也能正确反应热变性的过程,只有变化特别小的特殊点和几乎不变化的端点会给出错误信息(拟合的曲线方程不相同),所以采用单波长测试时宜选择变化大的点更能反应蛋白结构稳定性的真实信息。

图7 血红蛋白热变性测试结果
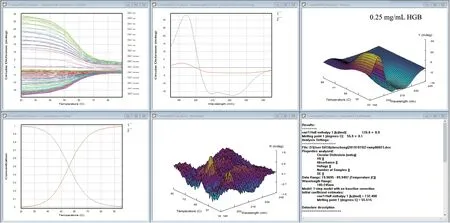
图8 Global3 软件分析HGB 蛋白热变性的结果
3 讨论
蛋白质的热稳定性探索是研究蛋白功能及开发新药物的一个重要环节。相比于复杂昂贵的核磁、XRD 及冷冻电镜,圆二色光谱是一种相对简单的手段,在研究蛋白质折叠,蛋白质构象领域非常必要,不同于传统的单波长法,热变性过程中只求得蛋白的Tm 值信息,效率非常低下。本研究成功构建了蛋白二级结构的正交方法,追踪各个温度下的蛋白结构变化过程,覆盖了蛋白热变性过程中的非常全面的信息。
本实验首先通过4 组浓度梯度的测试,优化出蛋白的热变性过程的适宜浓度为0.1 mg-0.5 mg。从蛋白的热变性全谱中,选取了BSA 蛋白变温过程中的3 组曲线,发现蛋白的构象从α 螺旋向β 转角和无规卷曲转化,说明随着温度的上升,蛋白构象的总体变化是一个从有序到无序的过程,最终无规卷曲所占的比例最大。用HGB 进行重复实验得到相似的实验结果,充分证明了实验设计的可靠性。这些分析结果是用热变性单波长法无法实现的。此外,这种全谱测试方法,在药物开发如生物类似药Biosimilar 的开发过程中,可以同步观测生物类似药与参比药物的结构变化过程的一致性,非常适合于药物筛选。
为了验证本方法所测试Tm 值的可靠性,将相同的BSA 蛋白用单波长法分别进行蛋白热变性的6组实验发现,当波长取在极值点和变化大的点所测试的Tm 值结果和全谱法完全一致,而波长取在变化小的端点和交叉点与本研究结果差别较大,而且拟合曲线也不正常。所以相比于单波长,本方法既不需要对波长的选取有任何顾虑,又综合了热变性过程中所有的结构变化的信息,所得的分析结果也是最全面,最准确的。

图9 HbC 蛋白构象CDNN 软件分析结果
4 结论
本实验基于蛋白的热稳定性测试开发了一种全光谱的正交方法,通过与单波长法的对比,我们发现当吸光度在合理的范围内,两种方法都能正确地测试出蛋白的热变性温度(Tm 值),且Tm 值不受浓度的影响。全光谱法测试所花的时间和单波长法测试的时间是一样的,单波长测试观测某一特定波长的变化,所得的信息有限;而全光谱法能反应蛋白在所有波长段的热稳定性状况,所得的结构信息更完整,包括各种螺旋、折叠结构等随温度的变化情况,有利于了解蛋白质的二级结构的整体热变性过程,将对蛋白药物的稳定性监控和药物筛选提供更全面信息。
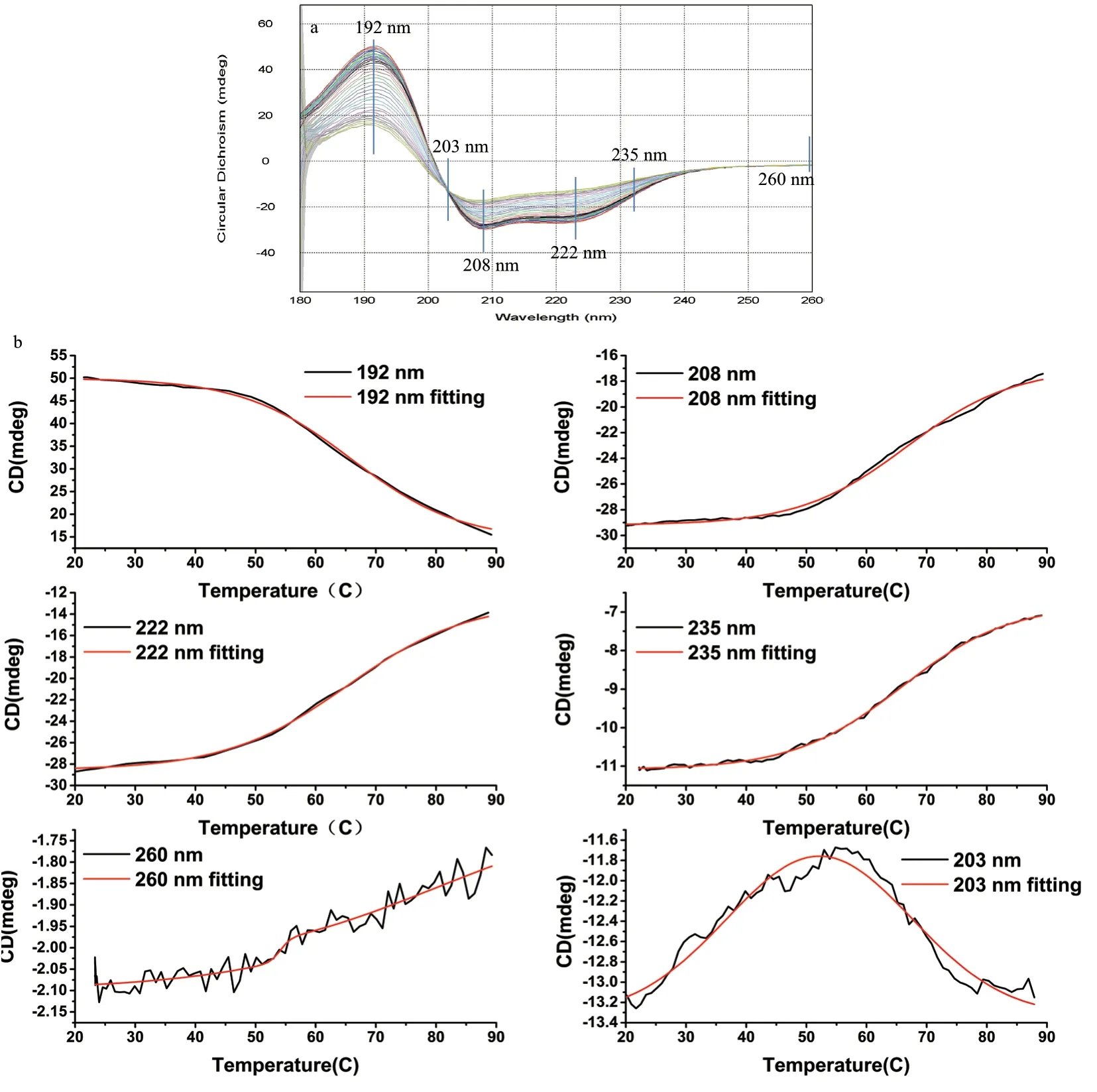
图10 六个代表性点的热变性过程的温度-CD 强度图

表2 六个代表性点的热变性过程的温度-CD 强度的拟合方程和拟合结果