微纳米气液分散体系氧化脱除天然气汽车尾气中的复合污染物
2021-04-25马梦蝶李登新
王 凡,马梦蝶,王 曦,杨 明,李登新
(1. 东华大学 环境科学与工程学院,上海 201620;2. 东华大学 分析测试中心,上海 201620)
近年来,在能源结构优化和环境污染控制的驱动下,天然气汽车的数量日益增多。与燃油车相比,天然气汽车尾气中的碳氢化合物(HC)、NOx、SO2的排放量减少,但HC中较难氧化的CH4增加[1],并且HC与NOx会发生化学反应,产生光化学烟雾[2]。目前,国内外的汽车尾气处理工艺主要有稀薄燃烧+氧化型催化转化器(DOC)尾气后处理[3]、当量燃烧+三元催化后处理[4]、当量燃烧+冷却废气再循环(EGR)+三元催化后处理[5]、等离子体催化氧化[6]等。三元催化技术在尾气处理过程中得到广泛应用,但催化剂所需的贵金属资源有限,价格昂贵,且制备方法复杂[7]。随着国家第六阶段机动车污染物排放标准的颁布,采用传统的汽车尾气处理工艺很难达到排放要求,另一方面,能够达到排放标准的处理工艺因技术复杂而难以实施。因此,探究一种高效、节能、环保的新型汽车尾气处理技术具有重要意义。
微纳米气液分散体系,凭借微纳米气泡的比表面积大、水中停留时间长、Zeta电位高、传质效率高、产生羟基自由基等特点而具有药剂投加量少、二次污染小、反应效果强等优点,被广泛应用于环境治理中[8]。研究表明,微纳米气泡技术对NO、SO2及挥发性有机化合物的氧化脱除效果明显[9-10]。
本工作采用微纳米气液分散体系对天然气汽车尾气中的复合污染物进行氧化脱除,研究了不同反应参数下污染物的脱除效率,并探究了反应机理。
1 实验部分
1.1 试剂和仪器
N a C l、盐酸、N a O H、F e C l2·4 H2O、MnCl2·4H2O、十二烷基硫酸钠(SDS),均为分析纯。实验用水为蒸馏水。
LF02-PT型微纳米气泡发生器:上海行恒科技有限公司;Testo 350型烟气分析仪:北京菲尔伯环境科技有限公司;FA2004B型分析天平:上海越平科学仪器有限公司;PHSJ-3F型实验室pH计:上海仪电科学仪器股份有限公司;ICS-1100型离子色谱仪:美国戴安公司。
1.2 实验装置及方法
尾气氧化脱除装置由气体缓冲装置、微纳米气泡发生装置、吸收反应塔、循环装置、尾气吸收装置、测试仪器等组成,如图1所示。本实验所用的微纳米气泡发生装置的额定进水流量为300 mL/min,额定进气压力为0.5 MPa,进气流量为30 mL/min。吸收反应塔有效容积为4 L。通过查阅资料以及现场测试天然气汽车尾气浓度,将自行配制的一定浓度的CH4、NO及SO2的混合气体进入缓冲装置后直接泵入吸收反应塔,探究以普通空气为气源的微纳米气泡在不同进气浓度、吸收液pH、NaCl投加量、SDS投加量、金属离子投加量条件下的尾气脱除效果。具体实验过程为:吸收液储存桶(13)中的吸收液经水泵(14)从吸收反应塔(8)下部进入到达塔顶部出水处,关闭水泵并关闭塔底部的阀门;打开CH4钢瓶(1)、NO钢瓶(2)、SO2钢瓶(3)和空气钢瓶(4)的阀门,通过转子流量计(5)控制,在气体缓冲装置(6)中得到混合气体;用计算机(12)启动微纳米气泡发生装置(9)的程序,气泡水从吸收塔下部进入,在吸收反应塔(8)中产生乳白色微纳米气泡水;打开气泵(7),混合气以100 mL/min 的流量由吸收塔底部经分布板进入吸收装置(8),吸收液与气泡水混合,从反应塔上部流入循环装置(10),循环装置(10)中的混合溶液进入微纳米气泡发生装置(9)实现循环;尾气从吸收塔顶部进入循环装置(10),运行25 min后,将烟气分析仪(11)与(10)连接进行测试,测试结束关闭微纳米气泡发生装置(9)和气泵(7);改变吸收液的条件,重复以上步骤。

图1 尾气氧化脱除装置
1.3 分析方法
按式(1)计算尾气中CH4/NO/SO2的脱除率。

式中:η为CH4/NO/SO2的脱除率,%;m1为进气CH4/NO/SO2质量,mg;m2为处理后出气CH4/NO/SO2质量,mg。
m1和m2分别按式(2)和式(3)计算。
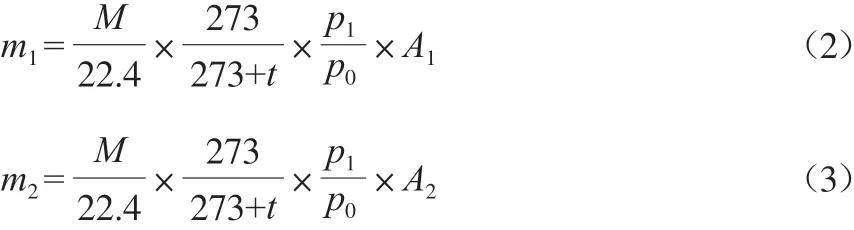
式中:M为CH4/NO/SO2的摩尔质量,g/mol;22.4为标准状况下的气体摩尔体积,L/mol;273为绝对零度的换算温度,℃;t为实验室温度,℃;p1为气体减压后的压力,Pa;p0为大气压,Pa;A1和A2分别为进气和处理后出气中CH4/NO/SO2质量浓度,mg/m3。
采用烟气分析仪测定CH4/NO/SO2的进气和处理后出气的质量浓度。采用离子色谱仪分析吸收液中的物质组分。
2 结果与讨论
2.1 进气浓度对脱除率的影响
在不调节吸收液pH、不投加药剂的条件下,改变进气CH4质量浓度,NO及SO2质量浓度不变,探究脱除率的变化,结果如图2所示。
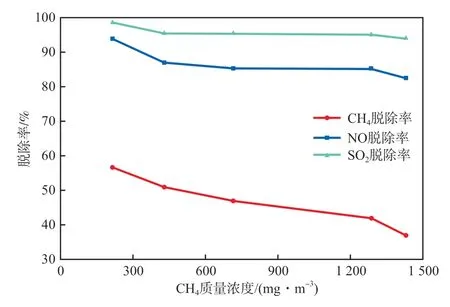
图2 进气CH4质量浓度对脱除率的影响
由图2可以看出,在NO及SO2进气浓度一定时,CH4的脱除率随着CH4浓度的增高而降低,而NO及SO2的脱除率相对稳定。这是因为,微纳米气泡在溃灭裂解时产生大量羟基自由基,羟基自由基具有超高的氧化还原电位,具有强氧化性,可以降解还原物质[11],但由于微纳米气泡产生的自由基数量有限,故随着CH4浓度的增大,CH4的脱除率逐渐降低。研究表明,NO及SO2还原电位低,易被氧化,故微纳米气泡可以氧化脱除高浓度的NO及SO2,且脱除率较高[12]。由于天然气汽车尾气中NO及SO2的浓度相对较低,因此二者的脱除率较高且相对稳定。根据天然气汽车尾气排放的实际情况并结合上述结果,后续实验选择CH4质量浓度429 mg/m3、NO质量浓度267 mg/m3、SO2质量浓度571 mg/m3。
2.2 吸收液pH对脱除率的影响
在仅改变吸收液pH(不投加药剂)的条件下,考察其对脱除率的影响,结果如图3所示。

图3 吸收液pH对脱除率的影响
由图3可以看出,CH4的脱除率受pH影响较大,NO及SO2的脱除率所受影响较小。在酸性条件下,三者的脱除率随着pH的增大而增大。在pH=6时,CH4,NO,SO2的脱除率均达到了峰值,分别为77.83%,94.96%,100%。pH增至7时三者脱除率均降低,继续增大pH三者脱除率先升后降。研究表明,水中的微纳米气泡由于H+与OH-的吸引而呈双电层结构[13],在强酸作用下,溶液中H+会与气泡表面的OH-相互结合,导致气泡稳定性较差,氧化能力下降,导致三者的脱除率在强酸条件下相对较低。潘习习等[14]通过实验证实,pH=6时微纳米气泡在水中含量最多,因此本实验中三者的脱除率也最高。当吸收液呈弱碱性时,溶液中少量的OH-与气泡表面的H+结合,使微纳米气泡的负电位增大,有利于脱除率的提高,但溶液中过多OH-会与微纳米气泡表面的OH-相互排斥,使气泡稳定性变差,故碱性条件下三者脱除率随pH的增大而先升后降。
2.3 NaCl投加量对脱除率的影响
不调节吸收液pH,向吸收液中投加NaCl,探究其投加量对脱除率的影响,结果如图4所示。
由图4可以看出,三者的脱除率均受盐度的影响,均随着NaCl投加量的增大而先升后降。在NaCl投加量为0.5 g/L时,CH4,NO,SO2的脱除率最高,分别达到75.64%,93.71%,97.46%。实验中Na+和Cl-离子的水合能分别为-406 kJ/mol和-317 kJ/mol,水合能越小,越容易吸附在气泡表面[15]。在盐度较低时,Na+会先与OH-相结合,使微纳米气泡的Zeta电位变高,NaCl浓度为0.5 g/L时,Zeta电位达到最大[16],此时气泡在水中停留时间长,从而提升了脱除率。当盐度过大时,大量Cl-会吸附在气泡表面,降低了传质效率,导致脱除率下降。CH4受盐度变化的影响较大,而NO和SO2的相对浓度较低,脱除率浮动较小。
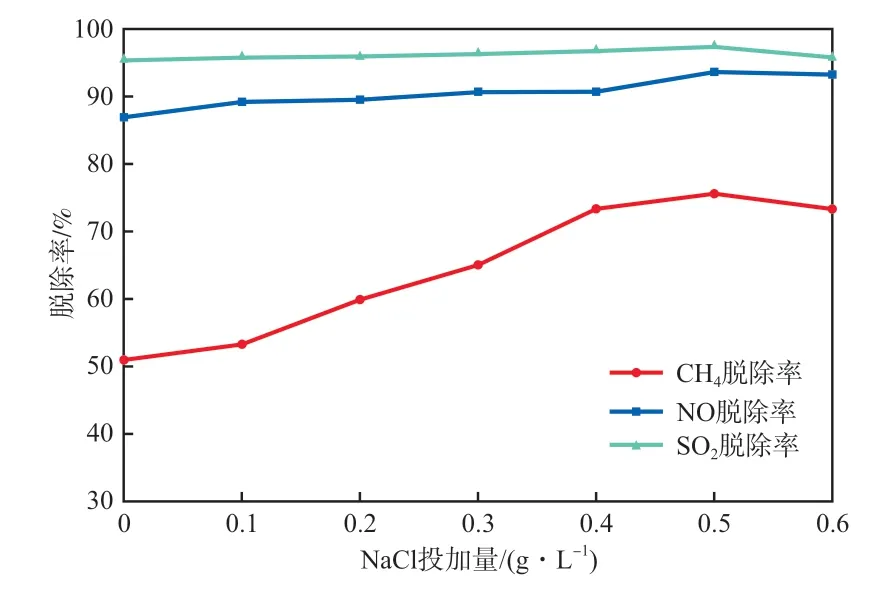
图4 NaCl投加量对脱除率的影响
2.4 SDS投加量对脱除率的影响
不调节吸收液pH,向吸收液中投加SDS,探究其投加量对脱除率的影响,结果如图5所示。
由图5可知,三者脱除率均受SDS影响,但NO和SO2的脱除率变化幅度较小。随着SDS投加量的增加,三者的脱除率均先升后降。在SDS投加量为4 mg/L时,CH4,NO,SO2的脱除率最高,分别达到77.25%,92.36%,99.03%。在水中添加表面活性剂后,会降低表面张力系数,从而降低生成的气泡的粒径,使气泡在水中的停留时间变长[17]。投加SDS后,当浓度较低时,气泡粒径变小造成气泡内压变大,破裂时产生巨大能量,使脱除率提高,且随着停留时间的延长,气液接触面积变大,也会增加三者的脱除率。当SDS浓度过高时,气泡直径变化减缓,氧化增强作用不明显,但过高浓度的SDS与羟基自由基的接触概率变大,易被自由基氧化而消耗自由基,导致三者的脱除率变低。
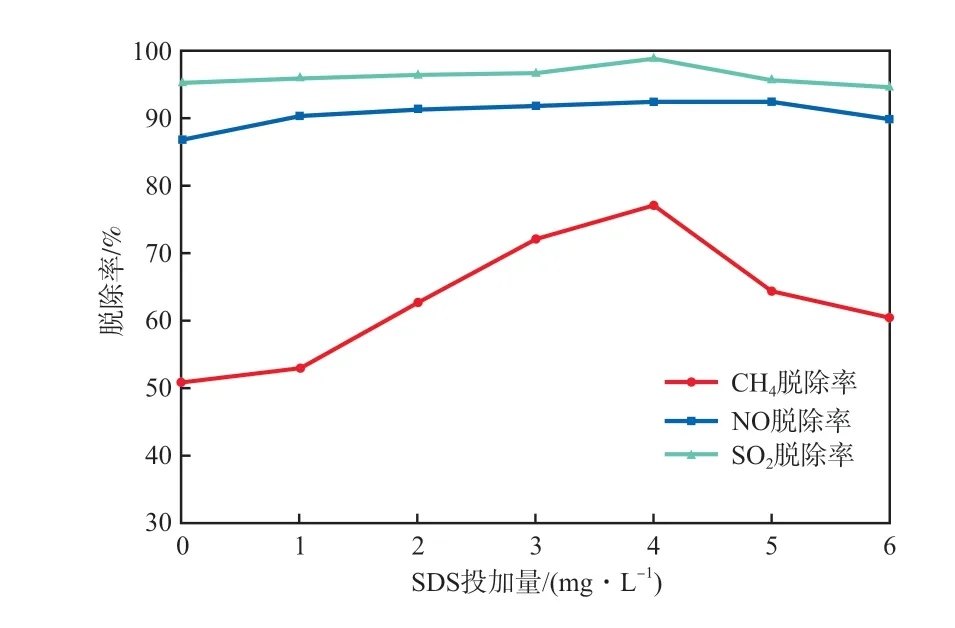
图5 SDS投加量对脱除率的影响
2.5 Fe2+投加量对脱除率的影响
不调节吸收液pH,向吸收液中投加FeCl2·4H2O,探究其投加量对脱除率的影响,结果如图6所示。
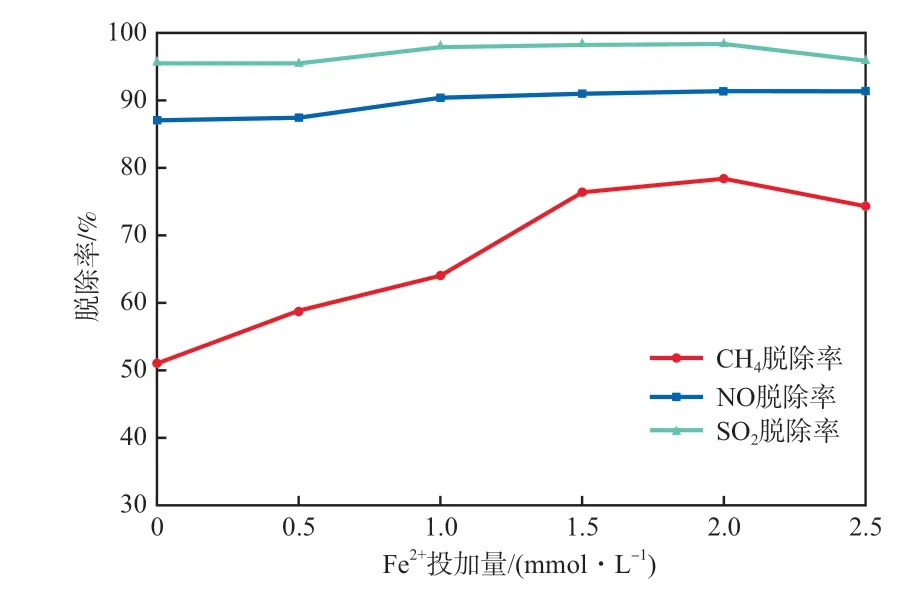
图6 Fe2+投加量对脱除率的影响
由图6可知,CH4,NO,SO2三者的脱除率均受Fe2+的影响,但NO和SO2的脱除率变化幅度较小。随着Fe2+浓度增加,三者的脱除率逐步增加,当离子浓度增至2.0 mmol/L时达到最大,分别为78.33%,91.33%,98.32%。之后,随着Fe2+浓度的增加,脱除率均降低。在Fe2+浓度较低时,微纳米气泡中的溶解氧使Fe2+变为Fe3+,同时产生羟基自由基提高催化氧化效果,提高脱除率[18]。当Fe2+浓度超过2.0 mmol/L时,一方面,Fe2+与水中的物质发生络合反应,导致三者在气液两相之间的传递速率变慢;另一方面,Fe2+浓度过高会发生水解反应,使其催化氧化能力下降,综合结果导致三者脱除率下降。
2.6 Mn2+投加量对脱除率的影响
不调节吸收液pH,向吸收液中投加MnCl2·4H2O,探究其投加量对脱除率的影响,结果如图7所示。

图7 Mn2+投加量对脱除率的影响
由图7可知,CH4,NO,SO2三者的脱除率均受Mn2+的影响,但NO和SO2的脱除率变化幅度较小。随着Mn2+浓度增加,三者的脱除率逐步增加,当Mn2+浓度增至2.0 mmol/L时,脱除率均达到最大,分别为80.43%,91.42%,96.63%。之后,随着Mn2+浓度的增加,脱除率均降低。Mn2+的催化作用同Fe2+相似,都是被自由基氧化成高价态后产生催化作用并且也会发生络合反应与水解反应。图6与图7比较来看,Mn2+催化能力比Fe2+强,因为Mn2+较Fe2+而言不易发生水解反应和络合反应[19],这就会使三者脱除率比Fe2+催化时略高。因此,应优先选用锰系催化剂来提高三者的脱除率。
综上,本实验的最佳脱除条件为吸收液pH 6、NaCl投加量0.5 g/L、SDS投加量4 mg/L、Mn2+投加量2.0 mmol/L。在此条件下处理CH4质量浓度429 mg/m3、NO质量浓度267 mg/m3、SO2质量浓度571 mg/m3的气体,CH4,NO,SO2的脱除率分别为85.83%,96.00%,100%。
2.7 氧化脱除机理分析
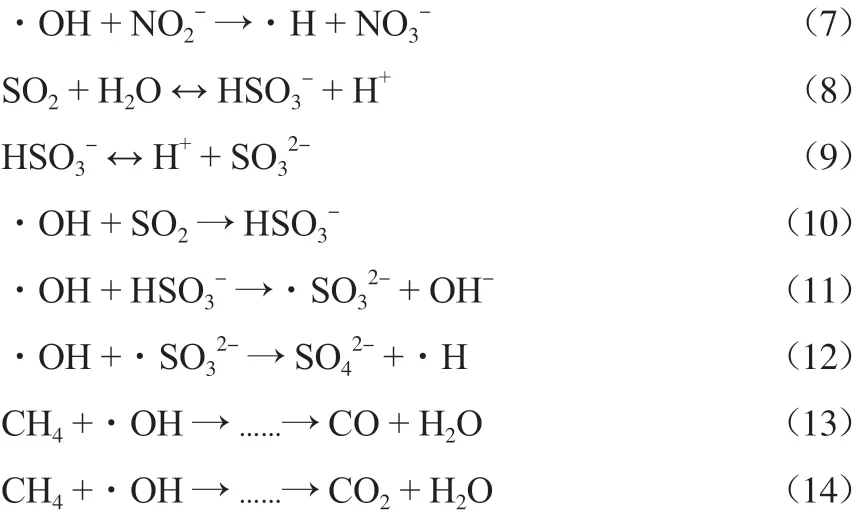
通过改变吸收液的条件可以改变微纳米气泡的特性从而影响NO,SO2,CH4的脱除率。在吸收液中添加铁锰系催化剂,通过催化作用也会影响三者的脱除率。通过离子色谱仪测出实验结束后的吸收液中有NO3-,NO2-,SO42-存在,通过烟气分析仪测出实验结束后的尾气中含有CO和CO2。通过查阅相关文献,得知微纳米气泡在水中破裂时产生羟基自由基等。根据上述测试结果,结合微纳米气泡的性质对微纳米气液分散体系氧化吸收NO,SO2,CH4的机理作出初步分析,其反应化学方程式如下:
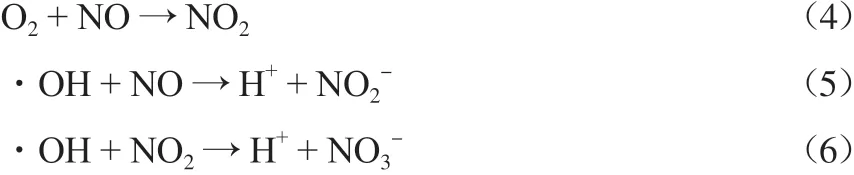
加入锰铁系催化剂后的催化机理如下:
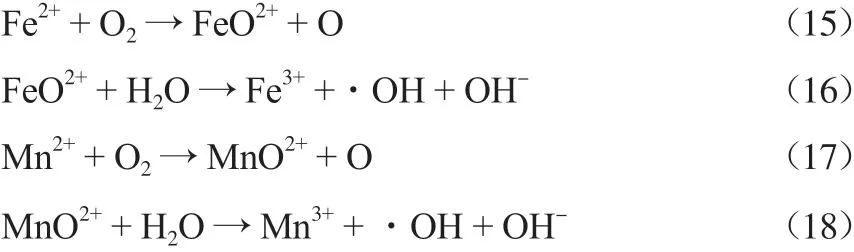
由上可知,在整个体系中,羟基自由基等将NO氧化成NO2,溶于水后生成NO3-和NO2-,SO2遇水会先生成HSO3-和SO32-,经过羟基自由基氧化后变成SO42-。羟基自由基使CH4中的碳链结构发生断裂,最终生成CO、CO2和H2O等小分子物质而得以降解。
3 结论
a)吸收液pH、盐度、表面活性剂、铁锰金属离子会对微纳米气泡的特性产生影响,从而影响CH4,NO,SO2的脱除率。三者的脱除率均随着NaCl、SDS、Fe2+和Mn2+投加量的增加而先升高后降低,三者的脱除率在酸性和碱性条件下随着pH的增大均呈现先升高后降低的趋势,但NO和SO2的变化幅度较小。
b)在进气CH4质量浓度为429 mg/m3、NO质量浓度为267 mg/m3、SO2质量浓度为571 mg/m3,循环25 min的工况下,最佳脱除条件为吸收液pH 6、NaCl投加量0.5 g/L、SDS投加量4 mg/L、Mn2+投加量2.0 mmol/L,在此条件下CH4、NO和SO2的脱除率分别为85.83%、96.00%和100%。
c)微纳米气泡产生羟基自由基,将CH4氧化成CO、CO2和H2O,NO氧化成NO3-和NO2-,SO2氧化成SO42-。Fe2+和Mn2+作为催化剂诱导微纳米气泡产生较多的自由基,自身被氧化为氧化性较强的高价离子,从而促进还原物质被氧化。
