不同民族HBV疫苗志愿接种者PBL中CD4+T细胞TCRβ链CDR3谱系的监测及CDR3分子特征初步分析
2021-04-25王小妹毕晓英贺晓燕姚新生
王小妹,毕晓英,马 锐,贺晓燕,马 龙,姚新生
(1.遵义医科大学 免疫学教研室,贵州 遵义 563099; 2.湖南中医药大学第一附属医院 医学检验与病理中心,湖南 长沙 410000)
乙型肝炎(乙肝)是由乙型肝炎病毒(HBV)感染引起的以肝脏炎性病变为主并可引起多器官损害的一种传染病,是一种全球性的传染性疾病。据报道[1],全球HBsAg阳性人群占到了全球总人数的4%~9%,近3.64亿人。每年约有100万人死于因HBV感染而导致的肝衰竭、肝硬化和肝癌等疾病。我国属于HBV高地方性流行地区。目前我国乙肝病毒携带者人数有近1.2亿,约占全球的45%,乙肝表面抗原携带者人数为全球最多,发病率一直处于法定传染病的前列;尤其高等院校的在校大学生感染人数居高不下,高校大学生乙肝感染率高达6%~8%[2]。但仅人类等少数灵长类的动物能被HBV感染,理想的HBV感染体外细胞培养和动物模型比较难以建立,故而很大程度地限制了对HBV的生物学特征及其详细致病机制的深层次研究。有研究者通过建立HBV 转基因模型进行研究,结果显示HBV引起的肝脏炎症过程中,由HBV抗原诱导的T细胞免疫应答起到了重要作用[3]。HBV抗原介导的活化T细胞免疫应答紊乱是HBV持续存在和造成炎症反复活动的重要原因。但是,HBV感染机体后,T细胞参与机体免疫应答和耐受的详细机制仍没有具体阐明[4-6]。Yang等[7-8]利用GMSP(Gene melting spectral pattern)方法检测到了急性乙肝病毒感染痊愈患者体内CD4+T细胞以及CD8+T细胞家族取用的偏向,可能是针对乙肝病毒应答导致了T细胞偏向取用了部分家族及恒定表达CDR3谱系,并辅助其特异的B 细胞应答。
国内外大量研究成果提示基因重组HBV疫苗的接种能很好的预防HBV的感染和乙肝的发病[9-12]。通过接种HBV疫苗,HBV能诱发机体发生细胞免疫应答及体液免疫应答。CD8+毒性T 细胞(CTL)、特异的CD4+辅助性T 细胞(Th 细胞)、非特异的单核巨噬细胞(MΦ)、自然杀伤细胞(NK 细胞)及部分细胞因子等免疫分子会参与到其免疫应答与病毒清除的过程中。而只有90%左右个体在乙肝疫苗接种后会产生HBsAb,部分接种HBV疫苗个体基本不产生HBsAb,即不应答现象,而相关机制仍未完全阐明[13]。另外,不同人群对HBV的应答反应强弱、药物对不同乙型肝炎人群的治疗效果及乙型肝炎患者发展为肝硬化和肝癌的概率等,均与个体对HBV应答的不同优势T细胞表位、不同个体的HLA型别(特异的不同民族HLA背景)、T细胞在炎症过程中应答、耐受消长情况等密切相关[14-15]。
近年来,研究者将T/BCR CDR3免疫谱型分析研究应用到感染(如HBV携带者、CHB患者、CHB治疗前后)、自身免疫相关疾病(如系统性红斑狼疮疾病)、肿瘤(如T淋巴细胞白血病)及其他特异B/T细胞B/TCR分子机制及相关特征的研究[7-8]。Ma等[16]通过BCR CDR3谱系分析发现个体间未找到完全相同的IgG或IgM H 链 CDR3氨基酸序列,考虑为个体间不同的HLA-DR位点、抗原提呈和T细胞辅助激活B 细胞的差异造成。群体间VDJ基因重组表现出差异很大,但在IgAN病人中,发现了4个高频取用的VDJ 基因重组序列[17]。Shi等[18]通过对正常人外周血TCR CDR3谱系分析发现了假基因的V区取用缺失分布特征及功能基因在J和D基因取用上的特征。
核酸分子检测方法中,实时荧光定量PCR技术的准确性、敏感性及重复性均处于领先水平;可通过该方法得到相应的产物的熔解曲线走向图,进而分析个体整体TRBV家族CDR3 基因克隆性增生情况。本实验采用荧光定量PCR熔解曲线法分析HBV疫苗志愿者外周血中CD4+TCRβ链CDR3区表达特征,从分子免疫的角度来观察不同民族志愿接种者的T细胞对HBV疫苗的应答状况,观察T细胞应答在机体对HBV疫苗应答中的作用;并通过对同一HLA型别志愿者PBL CD4+T细胞TCRβCDR3谱系分析,找到机体T细胞对HBV应答的可能特异性TCR CDR3序列,分析其共性及可能产生的机制,为研发新的HBV表位疫苗及对相同HLA型别HBV患者进行个体化诊治提供依据。
1 材料与方法
1.1 材料
1.1.1 标本 20例HBV疫苗接种志愿者(汉族、布依族、苗族、侗族)均为遵义医科大学临床医学本科学生。在获得遵义医科大学伦理委员会认可和志愿者知情同意后,排除自身免疫性疾病及恶性肿瘤,用电化学发光法检测所有志愿者乙肝全套(乙肝表面抗原、抗体,乙肝e抗原、抗体,乙肝核心抗体),乙肝五项全部阴性的志愿者则符合本次研究要求;每位志愿者注射3次HBV疫苗,并采血3次。采血时间分别为第1次HBV疫苗接种前1 d、第2次HBV疫苗接种14 d后、第3次HBV疫苗接种14 d后,每次采15 mL静脉血。
1.1.2 主要实验试剂 HBV疫苗(深圳康泰生物制品有限公司);MACSRCD8MicroBeads磁珠(Miltenyi Biotec);MACS柱子(Miltenyi Biotec);荧光定量PCRKit(东洋坊,日本);cDNA合成试剂盒(MBI Fermentas);总RNA提取试剂盒(Omega Bio-Tek,美国);琼脂糖凝胶DNA回收试剂盒(北京天根生物技术有限公司);淋巴细胞分离液(国药集团化学试剂有限公司);TRBV24个家族、TRBC、GAPDH等引物(上海Invitrogene公司合成);Goldview TM 核酸染料(北京赛百盛基因技术有限公司);Percp Anti-human(BD公司,美国);FITC Anti-human CD4(BD公司,美国);Percp/FITC/PE Mouse IgG1(BD公司,美国)。
1.2 方法
1.2.1 每例健康志愿者均采用0、1、6月HBV疫苗接种的原则(0.5 mL/次)。
1.2.2 采集外周血时间 第1次接种的前1天、第2次接种后第14天和第3次接种后的第14天(15 mL/次)。
1.2.3 采用密度梯度离心法分离PBL中的单个核细胞。
1.2.4 志愿者PBL中CD4+T细胞采用磁珠法进行分选。
1.2.5 采用流式细胞仪检测CD4+T细胞的纯度。
1.2.6 HLA基因组分型 取志愿者5 mL外周血(EDTAk2抗凝),采用PCR-SBT法分型,即采用群特异性引物(5'端加尾修饰)对靶DNA进行扩增,然后通过特异性引物对获取的扩增产物进行测序,再与HLA序列数据库进行比对后对待测标本进行HLA分型(由深圳华大基因研究院完成)。
1.2.7 提取淋巴细胞CD4+T细胞总RNA并合成cDNA。
1.2.8 采用FQ-PCR 对CD4+T细胞的TRBV家族CDR3区段cDNA进行扩增 T细胞TRBV 26个家族上游引物根据文献[19-20]而设计并合成,并在β链恒定区选取、设计下游引物和对照引物(引物由上海英骏生物技术有限公司合成)。体系的反应条件为:94 ℃ 3 min,1个循环;94 ℃ 30 s,55 ℃ 30 s,72 ℃ 50 s,运行45个循环;72 ℃ 10 min运行1个循环; 75~95 ℃按0.2 ℃/s对荧光值进行监测,运行100个循环,熔解曲线分析后的PCR产物再按照上述相同反应条件及步骤,将45个循环改成5个循环后进行PCR扩增,并用8微升产物于琼脂糖凝胶(1.5%)上进行电泳,剩余产物于-20 ℃保存备用。
1.2.9 对克隆性增殖的CD4+T细胞TRBV家族CDR3区进行PCR扩增 反应条件:(1)94 ℃ 3 min运行1个循环;(2)94 ℃ 60 s,55 ℃ 60 s,72 ℃ 60 s,运行35个循环;(3)72 ℃ 10 min运行1个循环。将产物于-20 ℃保存备用。
1.2.10 对普通琼脂糖凝胶中的CD4+T细胞26个TRBV家族的PCR扩增产物进行回收并纯化。
1.2.11 对克隆性增殖的CD4+T细胞TRBV家族CDR3区段进行测序,应用IMGT databas分析CDR3区的基因并对测序结果进行生物信息学分析。
2 结果
2.1 20例HBV疫苗志愿接种者不同时间段乙肝表面抗体(HBsAb)检测值 20例疫苗志愿接种者HBV疫苗接种前乙肝五项检测阴性;接种重组乙肝疫苗后,筛选的HBV疫苗接种志愿者均产生了保护性反应(完成全程接种后产生的HbsAb的滴度:<2.1 IU/L为无反应;2.1~10 IU/L为弱反应;>10 IU/L为有保护反应),见表1。
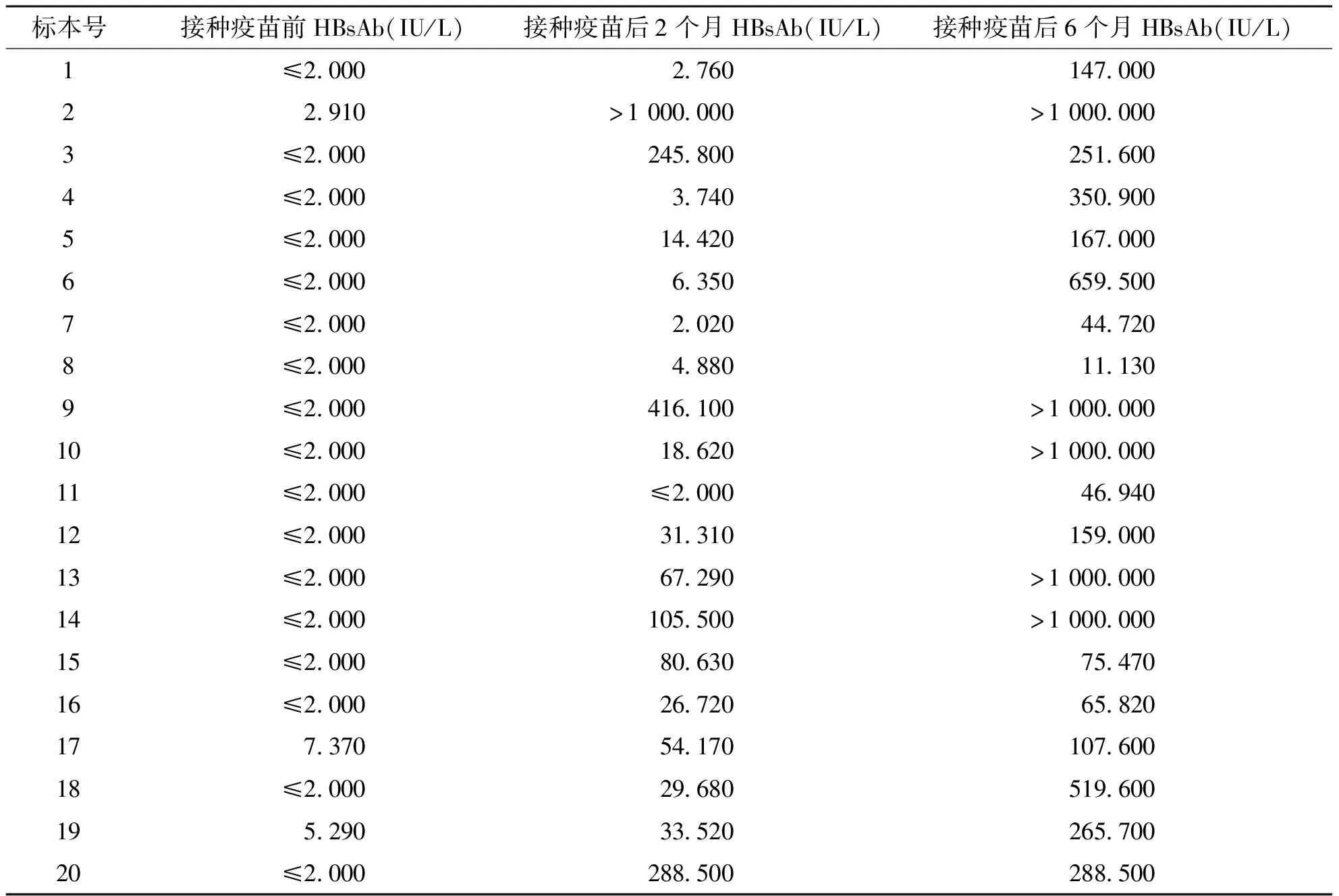
表1 20例HBV疫苗志愿接种者不同时间段乙肝表面抗体(HBsAb)检测值
2.2 20例HBV疫苗志愿接种者的基本资料及HLA-DR检测分型(见表2)

表2 20例HBV疫苗志愿接种者的基本资料及HLA-DR分型结果
2.3 采用MACSRCD8 MicroBeads磁珠对PBL中的CD8+T细胞进行分选,CD4+T细胞为去除CD8+T细胞后的PBL;分选CD8+T细胞的纯度全部>80%(流式细胞术)。再采用荧光定量PCR(FQ-PCR)溶解曲线法对乙肝疫苗志愿接种者PBL中CD4+细胞TCR VβCDR3分子特征进行分析(见图1~3),并对相关特征进行统计(见表3~4)。
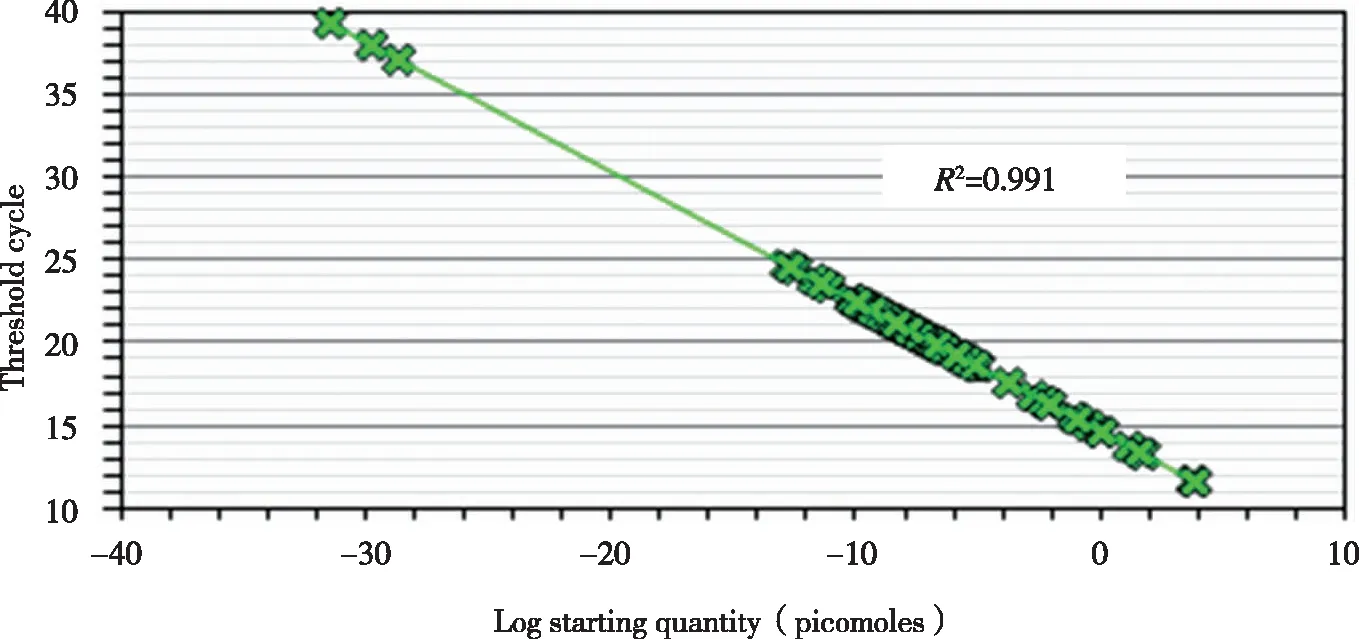
图1 1号HBV疫苗志愿者接种前 CD4+ T细胞的26个TRBV家族CDR3区扩增标准曲线
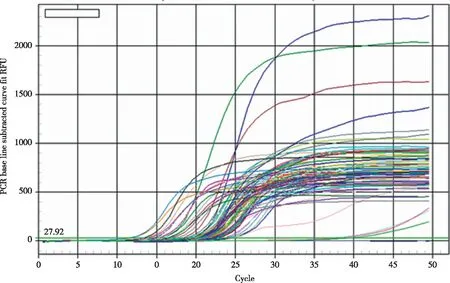
图2 1号HBV疫苗志愿接种者接种前 CD4+T细胞TRBV家族(26个)的CDR3区扩增曲线
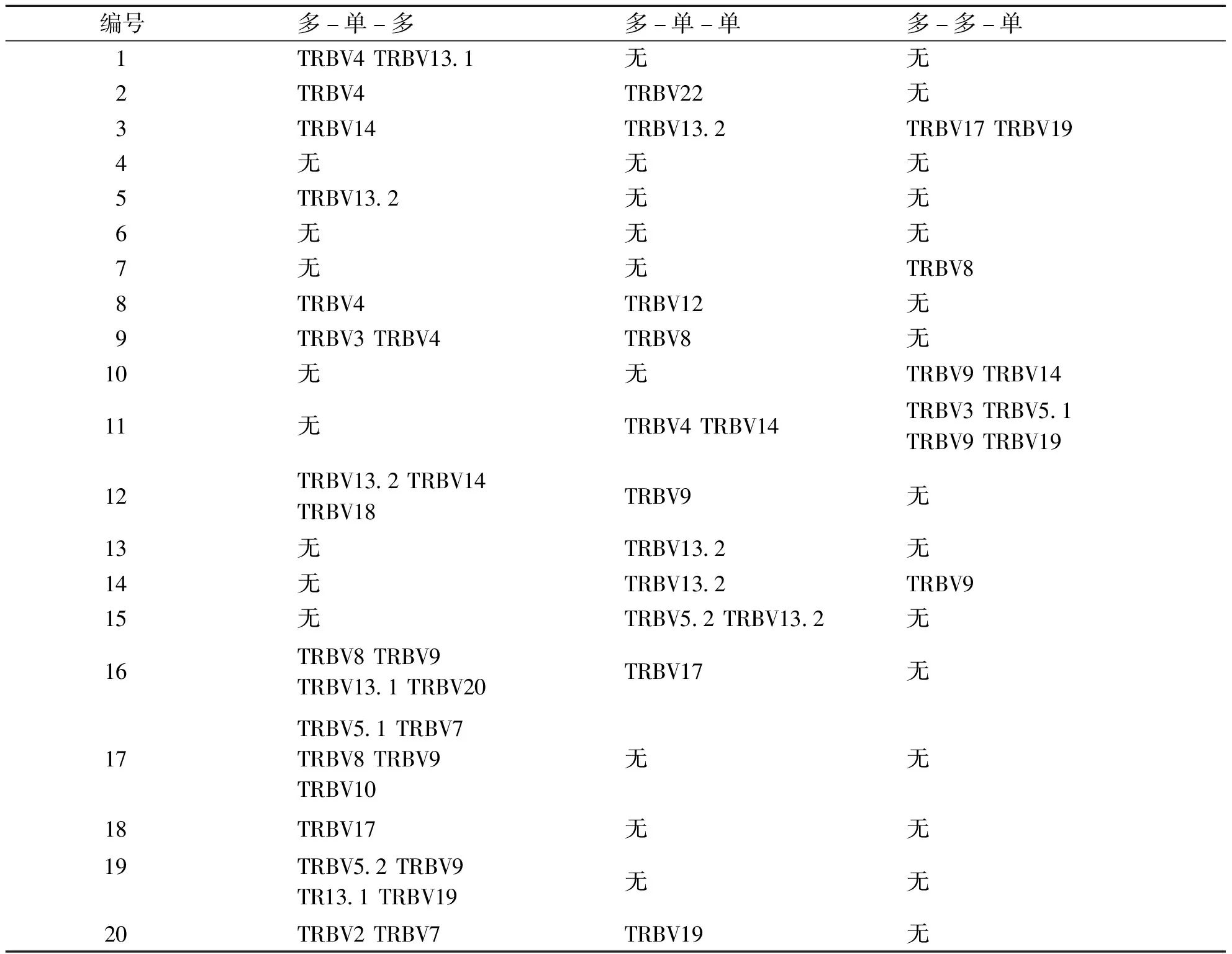
表3 20例HBV疫苗接种者接种过程中CD4+T细胞的TRBV家族(26个)出现的优势家族统计
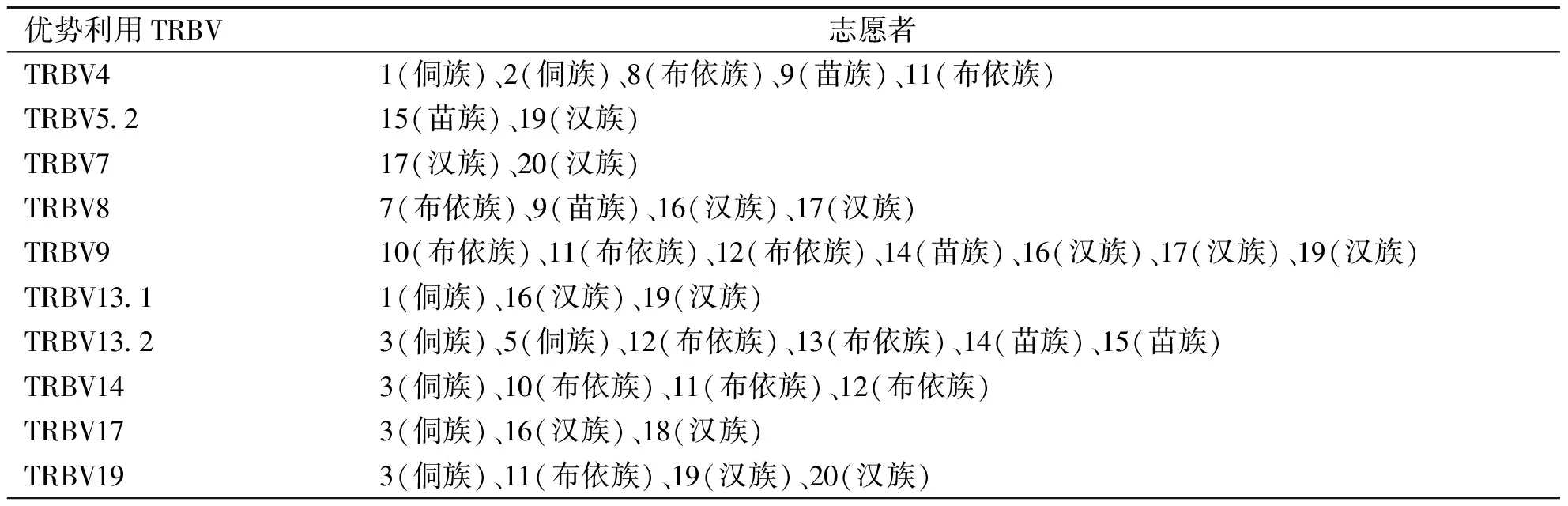
表4 具有共同优势取用CD4+T细胞 TRBV家族的个体统计
3 讨论
在无特异性抗原刺激的情况下,理论上正常人TCRβ链基因重排应是呈随机取用状态的,故而正常人外周血T细胞β链TCR CDR3家族的取用一般呈现为多克隆性增生状态,在熔解曲线上则表现为多峰。如果机体被抗原刺激,TCR CDR3区会特异性识别相应抗原,进而体内特异性T细胞会出现优势扩增,所以可以通过分析TCR CDR3优势取用情况,进而来分析T细胞克隆性[21]。
在方法学上,本研究取用适合于临床样本操作、快速又简便的荧光定量熔解曲线法对乙肝疫苗志愿者接种全程(包括接种前/后)CD4+T细胞TCRβ链各家族CDR3区基因的取用特征进行分析,从整体水平上对特异性T细胞克隆增生特点进行探讨,为乙肝发病机制的研究及进一步进行乙肝个体化的诊疗提供新的方向及途径。本研究采用乙肝五项均为阴性的志愿者(汉族、布依族、苗族、侗族)接种HBV疫苗前及接种后的外周血为实验标本,分析发现疫苗接种前志愿者PBL的TCRβ链各家族CDR3区基因基本呈多克隆增生(多峰)分布,说明各个TRBV家族均取用了多种CDR3区基因;另外,本研究分析发现所有乙肝疫苗接种志愿者在接种了乙肝疫苗后PBL标本中均表现出有一个或几个TRBV家族的单克隆性表达的现象(优势取用),这种现象提示乙肝疫苗志愿者接种乙肝疫苗后T细胞免疫应答与未接种前表现出了明显变化;本分析现象与系统性红斑狼疮个体中的TCR CDR3取用分析结论一致[22]。
第2次疫苗接种后第14天,对20例HBV疫苗志愿者取外周血进行HbsAb检测(电化学发光法),有6例志愿者抗体阴性,即检测值<10 IU/L,他们分别是1(侗族)、4(侗族)、6(苗族)、7(布依族)、8(布依族)、11(布依族)号志愿者;在第三次疫苗接种后,20例HBV疫苗志愿者HbsAb都为阳性,即检测值>10 IU/L,其中2(侗族)、9(苗族)、10(布依族)、13(布依族)、14(苗族)号志愿者HBsAb检测值均>1000 IU/L。提示HBV疫苗接种后,志愿者均对疫苗产生了特异应答;而在不同时期,TCR CDR3的优势表达情况可能不尽相同。
在本实验中,以疫苗前的TRBV熔解曲线峰图为判断基准(对照),分别与第二次乙肝疫苗接种后14 d及第3次乙肝疫苗接种后14 d的TRBV谱系熔解曲线峰图比对,从而观察TRBV谱系变化特征。在疫苗接种期间表现为某TRBV家族的优势单峰取用,当抗原被机体清除后,可能会恢复为多峰状态,对相应抗原的应答将会以记忆细胞的形式存在于机体中。对比发现,接种HBV疫苗后各位志愿者CD4+T细胞优势取用的TRBV家族表现出不完全一致,但不同志愿者之间存在着共同优势取用的TRBV家族。
20例志愿者HLA-DR位点分型表现出对HLA-DR位点有共同优势取用现象,如13(布依族)和16(汉族)号两个志愿者具有相同的HLA-DR位点,分别是DRB1*0901和DRB1*1101;DRB1*0901和DRB1*1602位点分别被6例志愿者取用,而部分位点则被单例志愿者所取用,如DRB1*0403仅被3号志愿者取用。通过对比HLA-DR取用表和优势家族取用表,不同个体乙肝疫苗接种后优势TRBV家族的取用和HLA-DR位点未表现出明显相关性。此结果提示我们这些优势利用的T细胞可能会识别乙肝病毒抗原肽的不同抗原表位,除与HLA型别相关外,可能还与TCR CDR3区的空间构型及本身的结构具有相关性。
布依族志愿者10、11、12共同优势取用TRBV9和TRBV14;汉族志愿者16、17、19共同优势取用TRBV9,另汉族志愿者16和19还共同取用TRBV13.1;汉族志愿者16和17共同取用TRBV8,提示TRBV优势家族的利用与民族属性或具有一定相关性。
不同个体的优势取用家族不完全相同,此结果与Tajiri[23]等对HBsAg特异性结合的单克隆抗体序列分析结果一致。Tajiri等分析了31条(记忆B细胞来源序列5条,浆细胞来源序列26条)HbsAb序列,这些序列与HBsAg呈现高亲和力,但家族来源呈现异质性。考虑为目前使用的基因重组HBV疫苗具有能引起机体体液免疫应答的多个HBsAg的构象表位,激活了个体的多个B 细胞克隆。
TCR CDR3谱系特征分析技术已应用于多项研究[24-28],本次在HBV疫苗研究中也显现了重大的应用价值,表现出潜在的临床应用前景。本实验采用荧光定量PCR熔解曲线法分析HBV疫苗志愿者外周血中CD4+TCRβ链CDR3区表达特征,从分子免疫的角度来观察不同民族志愿接种者的T细胞对HBV疫苗的应答状况,观察T细胞应答在机体对HBV疫苗应答中的作用;并通过对同一HLA型别志愿者PBL CD4+T细胞TCRβCDR3谱系分析,找到机体T细胞对HBV应答的可能特异性TCR CDR3序列,分析其共性及可能产生的机制,本研究结果为乙肝患者的T细胞应答机制解析及进一步的乙肝患者的个体化治疗、开发新的乙肝表位疫苗、T细胞在HBV感染后的应答与耐受分析及少数民族乙肝感染后T细胞TRBV家族取用特征分析等研究提供了实验基础。
