不完全分隔内耳畸形患者人工耳蜗植入研究进展
2021-04-25刘攀王林娥
刘攀 王林娥
首都医科大学附属北京友谊医院(北京 100050)
先天性感音神经性聋(sensorineural hearing loss,SNHL)的发病率较高,而其主要病因之一为内耳畸形(inner ear malformation)[1]。目前,治疗重度到极重度感音神经性聋的重要手段是人工耳蜗植入。但内耳畸形患者的人工耳蜗植入手术与内耳发育正常的患者相比较为复杂。不同类型内耳畸形患者的手术存在不同特点。1987年,Jackler等[2]提出了一种分类方法,将内耳畸形分为以下几种:Michel畸形、耳蜗未发育、共同腔畸形、耳蜗发育不全和不完全分隔等。其中,不完全分隔畸形又分为I型及II型。而在1971年,作为不完全分隔畸形中的一种,不完全分隔III型被首次发现[3]。不完全分隔畸形曾被认为是人工耳蜗植入手术的禁忌症,但随着相关研究的进展,越来越多的不完全分隔畸形患者也顺利接受了人工耳蜗植入手术。本文就不完全分隔内耳畸形所致的重度、极重度感音神经性聋患者人工耳蜗植入手术的相关研究进展作一综述。
1 不完全分隔的历史演变
自上世纪八十年代起,不完全分隔内耳畸形作为内耳畸形的一种,逐渐被人们所认识。
1987年,根据胚胎学研究及多轨迹体层摄影研究,Jackler等[2]提出了一种分类方法,将内耳畸形分为以下几类:①Michel畸形;②耳蜗未发育;③耳蜗发育不全;④不完全分隔;⑤共同腔畸形;⑥前庭及半规管畸形;⑦大前庭导水管综合征等类型。但其中的不完全分隔分类尚不完善。
根据Jackler等[2]的分类方法,不完全分隔内耳畸形也称“Mondini畸形”,与此后的分类不同的是,其描述中实际包含了两种不同类型的畸形。其一为耳蜗缺乏全部筛区和蜗轴,整个耳蜗呈囊状,且常伴有大的囊状前庭,即我们常用分类中的IP-I;其二即经典的Mondini畸形,其耳蜗的顶部为囊状,由中间周与顶周相融合形成,且伴有前庭和前庭导水管的扩大。Jackler等将其描述为严重型和轻微型不完全分隔畸形,但未对其特征做详细描述。此后,Mondini畸形的定义也曾被混淆。
2002年,Sennaroglu等[4]通过对以上两种不同类型的内耳畸形进行形态学及组织胚胎学的比较,提出一种新的、更精确的分类方法。他在此版分类中将不完全分隔分为IP-I及IP-II两类。但仍未明确描述IP-III畸形的定义。
1971年,Nance等[3]首次发现了一种特殊的不完全分隔,即IP-III,并将其描述为一种X染色体连锁遗传性聋。Phippard等[5]称其为“伪Mondini畸形II期”,并将其描述为一部分耳蜗发育不全,伴有镫骨固定及内听道的扩大,且与蜗管的异常沟通。
2010年,Sennaroglu[6]重新将内耳畸形进行了分类,此次分类引入了3类不完全分隔的概念,也是目前应用较为广泛的分类方法。在此版分类中,将内耳畸形分为以下几个类型:a.Michel畸形;b.耳蜗未发育;c.共同腔畸形;d.耳蜗发育不良I型;e.耳蜗发育不良II型;f.耳蜗发育不良III型;g.不完全分隔I型;h.不完全分隔II型;i.不完全分隔III型;j.前庭及半规管畸形;k.大前庭导水管综合征;l.内听道狭窄。
其中,IP-III畸形已被证实为X染色体隐性遗传病,其特点为蜗轴缺失在耳蜗底周部分最为明显,同时内听道与耳蜗相连的底部宽大而缺少了骨性分隔,导致内听道底与耳蜗的底周相通,部分患者甚至形成耳蜗与内听道共同腔。
2 不完全分隔的概念及分类
不完全分隔内耳畸形主要表现为患者耳蜗的蜗轴缺如,按照目前公认的分类方法,其主要包含3类:
①不完全分隔I型(imcomplete partition type I,IP-I):IP-I畸形也被称为囊状耳蜗-前庭畸形。此类患者耳蜗和前庭均呈囊状,其耳蜗蜗轴和分隔同时缺如,缺乏全部蜗轴及筛区。见“图1A”[7]。
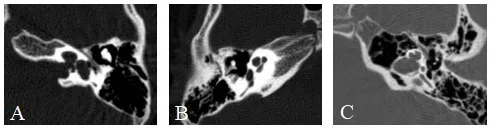
图1 A不完全分隔I型,B不完全分隔II型,C不完全分隔III型Fig.1 A Incomplete partition type I,B Incomplete partition type II,C Incomplete partition type III
②不完全分II型(imcomplete partition type II,IP-II):IP-II即Mondini畸形。此类畸形患者耳蜗顶部呈囊状,其顶部的蜗轴和分隔缺如,并伴有前庭及前庭导水管的扩大。IP-II畸形患者的耳蜗中间周和顶周融合,使得及耳蜗仅含有1.5周。见“图1B”[7]。
③不完全分隔III型(imcomplete partition type III,IP-III):IP-III也称为 Mondini畸形II期[4]。其耳蜗蜗轴缺如,但分隔正常。患者的耳蜗蜗轴和筛状板缺如,但存在中间分隔结构。同时,其内听道底与耳蜗底周之间缺少骨性分隔,且内听道的发育呈畸形,基底部球形膨大。见“图1C”[7]。
3 人工耳蜗植入术
不完全分隔内耳畸形曾经是人工耳蜗植入手术的禁忌症。但近年来,随着影像学技术的提高,术前诊断日渐明确。同时,人工耳蜗技术的发展、手术医师操作技术的提升、术中CT等影像学手段的应用[8]等因素,也不断提高人工耳蜗植入手术的成功率及术后的康复效果。目前的研究表明,即使是不完全分隔内耳畸形患者,同样能接受人工耳蜗植入手术[7]。
3.1 IP-I畸形的人工耳蜗植入
目前国内对于IP-I畸形患者的人工耳蜗植入手术报道较少,但国外的研究表明,此类患者同样可以安全、有效地接受人工耳蜗植入手术[9]。
对于IP-I畸形的患者,脑脊液“井喷”是人工耳蜗植入手术的一个重要问题,而且发病率较高。在Suk Y等[10]的研究中,23名IP-I患者的25耳接受人工耳蜗植入术,“井喷”的发病率为56%。Kontorinis G等[11]的研究中,11例接受手术的IP-I畸形患者,“井喷”发病率为63.6%。而在Catli T等[12]的研究中,所有病例均出现“井喷”。但Berrettini S等[13]统计了4例在其医院行人工耳蜗植入的IP-I畸形患者,4例均未出现“井喷”。虽然术中“井喷”的发生率较高,但上述研究中,术后远期并发症的发病率极低,术后效果尚可。
在术式的选择上,IP—I畸形患者多采用传统的经乳突-面隐窝入路行人工耳蜗植入[10,12],术中虽易出现“井喷”及电极误入内听道,但经过有效的处理后,术后效果尚理想。根据Sennaroglu[6]的研究,当IP-I患者伴有面神经畸形时,如面神经前移等改变时,可考虑行“经外耳道入路”植入。此外,对于IP-I畸形的患者,选择直电极能增加电极与螺旋神经节细胞接触的可能性。
3.2 IP-II畸形的人工耳蜗植入
对于IP-II畸形的患者来说,其手术难度同样较大。在刘兰等[15]的研究中,7例IP-II畸形患者接受人工耳蜗植入术,其“井喷”发生率为14%。
目前的研究表明,虽然IP-II畸形增加了人工耳蜗植入的手术难度,且使得术中“井喷”的发生率显著提高,但术前若能明确诊断,根据内耳畸形情况灵活选择手术方案,并发症的发生率将大大减低,且术后康复效果较好[14,15]。
王林娥等[16]曾总结了19例IP-II畸形患者的人工耳蜗植入术,其术式包括:①经面隐窝入路,暴露圆窗龛,经圆窗龛前上缘钻孔进入鼓阶;②经鼓岬开窗进入鼓阶;③经卵圆孔钻孔,进入内耳间隙;④经圆窗龛前下缘钻孔进入鼓阶,植入电极。此外,还可采取乳突切开、开放面隐窝入路[17],以及前后鼓室联合进路或经半规管入路[18]。
对于严重的Mondini畸形患者,若同时还患有内耳骨迷路的畸形,将会使手术中电极植入的难度大大增加,且并发症发生的风险较大。此时,耳蜗电极的选择较为重要。例如:对于骨迷路无明显畸形的患者,长电极或标准电极较为适用;而对于耳蜗发育小的患者来说,直电极或短电极较为有利。
3.3 IP-III畸形的人工耳蜗植入
IP-III畸形的一个特点是蜗轴缺失在耳蜗底周最为明显,内听道与耳蜗相连的底部宽大、缺少骨性分隔,这导致内听道与耳蜗的底周相通,部分患者甚至形成了耳蜗与内听道的共同腔。因此,IPIII畸形患者在人工耳蜗植入术中出现电极植入内听道,或由于“井喷”造成电极无法植入的风险会大大高于其他类型的耳蜗畸形[19]。
在卢宇涵等[20]的研究中,11例IP-III畸形患者接受人工耳蜗植入手术,所有手术均于术中应用CT检查以防止电极植入内听道;其中9例均出现了“井喷”现象;于术中进行肌肉填塞封闭脑脊液漏后,9例患者术后均未出现脑膜炎。
针对电极误入内听道风险,曾有学者[21]在术中多次使用X线照相来观察电极植入的位置,从而确保电极在耳蜗腔内。但此方法术中操作繁琐,且并未根本解决电极误入内听道的问题,存在术中辐射大、反复植入电极易造成耳蜗内基底膜损伤、耳蜗内出血、毛细胞损伤等风险,可能影响术后效果。王林娥等[22]提出,若术中发生“井喷”,可在井喷时植入电极,利用压力差来避免电极植入内听道,另外,可应用人工耳蜗电极植入辅助套管来辅助植入电极,可有效避免电极误入内听道,术后效果良好。针对脑脊液“井喷”风险,国内外学者在改进电极设计和电极选择方面进行深入研究。可将电极末端的环形塞改为锥形塞,从而更好地封闭耳蜗开窗口,降低脑脊液漏的发生率。选择直电极而不选择预弯电极,避免电极短路问题。
4 术后康复效果
针对不完全分隔内耳畸形患者的人工耳蜗植入后康复效果报道较少,且目前的研究采用的评价指标较多。
4.1 IP-I畸形
在Eftekharian A等[23]的研究中,采用听觉行为分级标准(categories of auditory performance,CAP)、言语可懂度分级(speech intelligibility rating,SIR)和有意义言语使用量表(meaningful use of speech scale,MUSS)来评估IP-I畸形患者的人工耳蜗植入术后其听觉言语康复效果。其中,所有患者的听觉和言语康复效果均令人满意。
而在Berrettini S等[24]的报道中,通过对4名IPI畸形患者的限定词表和非限定词表的言语识别率评估,及通过对声场测试助听听阈平均值的评估,发现患者的听觉能力均有很大提高,但口语表达相对较差。
张道行等[25]曾对135例IP-I畸形患者人工耳蜗植入术后的听觉言语康复效果进行分析,采用了听神经反应遥测(NRT/ART)、声场测试助听听阈、单韵母言语识别率、单声母言语识别率等检测指标。其结果表明,IP-I畸形患者人工耳蜗植入术后听觉言语识别能力较内耳正常患者差。
4.2 IP-II畸形
刘兰等[15]分析了包括IP-II畸形在内的30例内耳畸形患者人工耳蜗植入术后疗效,采用听觉行为分级标准和言语可懂度分级标准进行评估,通过与耳蜗结构正常的患者进行对比,发现其术后的言语康复效果与内耳结构正常的患者相比无明显差异。
而Chen X等[26]曾对31例Mondini畸形的患者进行人工耳蜗植入术后随访,应用婴幼儿有意义听觉整合量表(infant-toddlermeaningful auditory integration scale,IT-MAIS)进行评估,其结果表明,耳蜗植入术后 3、6、9个月,IP-II畸形患者 IT-MAIS平均得分与内耳发育正常患者比较有明显差异,但术后第1、12、24、36个月,两者平均得分未见显著差异。人工耳蜗植入对于IP-II患者来说,是一个积极有效的干预措施,但在耳蜗植入术后第一年,患者需要比耳蜗发育正常的患者付出更多的精力进行康复。
4.3 IP-III畸形
既往的不少研究认为,IP-III畸形患者的人工耳蜗植入术后听觉感知能力和语言获得能力较差[27]。但近期的研究表明,即使是IP-III畸形的患者,其人工耳蜗植入术后仍可获得较好效果。
安鹏等[28]通过对患者术后听阈、语言识别率、扬扬格词表等的评估表明,尽管IP-III畸形患儿植入人工耳蜗存在井喷风险,但积极做好预防及补救措施,术后患者听力恢复效果很好。陈见清等[29]的研究也表明,IP-III畸形患者适合行人工耳蜗植入,而且可以获得较好的效果。Alballaa A等[30]通过对患者术后语音识别的评估,发现IP-III畸形患者分数低于对照组患者的平均分数,但其差异无统计学意义。
5 小结
不完全分隔内耳畸形是一种较为严重的内耳畸形,随着医疗技术的发展,这类畸形逐渐被人们所认识,其治疗方法也逐步改善。近几年,不完全分隔内耳畸形患者的人工耳蜗植入术后效果较前明显改善,但手术风险的规避方法仍需进一步完善,术后康复效果还存在提升空间。
