自体PRP治疗KOA的疗效及对相关介质的影响
2021-04-25李悦沈斌陈利宁倪向明徐仲翔吴峰淼吕存贤
李悦 沈斌 陈利宁 倪向明 徐仲翔 吴峰淼 吕存贤*
膝骨性关节炎(KOA)是一种累及膝关节组织的关节疾病,病情进一步发展易导致关节软骨的变性和脆裂,影响患者的正常活动[1-2]。临床KOA的治疗主要以减轻患者疼痛与改善运动能力为主要目标[3]。目前研究认为,KOA患者疾病进程中疼痛介质因子的水平较正常者显著升高[4-5],关节腔内注射药物治疗可使药物直接到达病灶,其效果显著优于口服药物治疗[6]。自体富血小板血浆(PRP)富含各种生长因子,能够促进产生软骨细胞和骨基质,已逐渐应用于关节炎、肌腱炎等疾病的治疗[7-8]。本文探讨关节腔内注射自体PRP治疗KOA的效果及对相关介质的影响。
1 资料与方法
1.1 一般资料 选取2016年7月至2019年3月温州市中医院收治的KOA患者100例。(1)纳入标准:①符合《骨关节炎诊疗指南(草案)·2003年》[9]的诊断标准;②年龄19~85岁;③主要症状表现为关节疼痛、肿胀,病程>4个月;④影像学检查K-L分级为Ⅱ级~Ⅳ级。(2)排除标准:①强直性脊柱炎;②伴有精神系统、神经系统疾病;③骨原发肿瘤或肿瘤骨转移、骨结核;④糖尿病并发症下肢血管病变;⑤严重的肝肾功能疾病。按随机数字表法分为观察组和对照组,每组各50例。观察组,男19例,女31例;年龄56~84岁,平均(66.1±6.4)岁;K-L分级,Ⅱ级13例、Ⅲ级32例、Ⅳ级5例;平均病程(33.7±8.2)个月;左侧23例、右侧27例。对照组,男23例,女27例;年龄52~85岁,平均(64.7±8.0)岁;K-L分级,Ⅱ级16例、Ⅲ级30例、Ⅳ级4例;平均病程(32.5±7.8)个月;左侧26例、右侧24例。两组基线资料比较无统计学意义(P>0.05),具有可比性。本项目经本院医学伦理委员会批准,所有患者均签署知情同意书。
1.2 治疗方法 (1)基础治疗:两组患者均口服依托考昔片(默沙东公司),30 mg/次,1次/d,连续2周。(2)PRP制备:抽取患者外周静脉血36 ml,置于无菌离心管,再用注射器抽取4 ml柠檬酸钠与其混合,进行离心,从底部至界面下方约3~5 mm处抽出最低层红细胞并丢弃,然后平衡剩余血液,再次离心,之后从顶部吸取约3/4的上清液并丢弃,最后约6 ml血浆保留在离心管中,即PRP。(3)观察组患者自体PRP注射:由高级职称医师操作,操作设备经过严格消毒。1支注射器吸取10 ml PRP,另1支注射器吸取2 ml透明质酸,将两者连到三通上。患者仰卧位,穿刺部位消毒,从髌骨外侧上边缘或髌骨内侧下边缘进行穿刺,当针尖探测为空,提示已达到关节腔,缓慢推注药物,注射完成后,膝关节略微屈伸以均匀地散布药物。1次/2周,注射3次。
1.3 观察指标 (1)膝关节功能评估:分别于治疗前、治疗后3、6个月后进行。①采用WOMAC骨关节炎指数评分[10],分值0~96分,分值越低代表膝关节功能状态越好。②采用Lysholm膝关节评分表[11]评估日常生活的活动功能,分值0~100分,分值越高代表患者功能状态越好。(2)实验室检测:分别于治疗前、后取两组患者空腹静脉血10 ml,以4000 r/min速度离心10 min,静置取上清液于-80 ℃保存备用。检测血清前列腺素E2(PGE2)、P物质(SP)、白三烯B4(LTB4)、白三烯C4(LTC4)水平,采用Elisa法,试剂盒由上海美旋生物科技有限公司提供;血清基质金属蛋白酶3(MMP3)、基质金属蛋白酶抑制物-1(TIMP-1),MMP3、TIMP-1试剂盒购自美国RB公司。(3)疗效评价:依据治疗前后的WOMAC评分变化对疗效进行评价。显效:治疗后WOMAC评分降低>80%,临床症状得到明显缓解,实验室检测指标降低显著;有效:治疗后WOMAC评分降低>30%,临床症状得到一定程度的减轻,实验室检测指标有所改善;无效:未达到上述标准。
1.4 统计学方法 采用SPSS 21.0统计软件。计量资料以(±s)表示,采用t检验,计数资料以n(%)表示,采用卡方检验或非参数检验。以P<0.05为差异有统计学意义。
2 结果
2.1 两组患者膝关节功能评分比较 见表1。
表1 两组患者膝关节功能评分比较[分,(±s)]
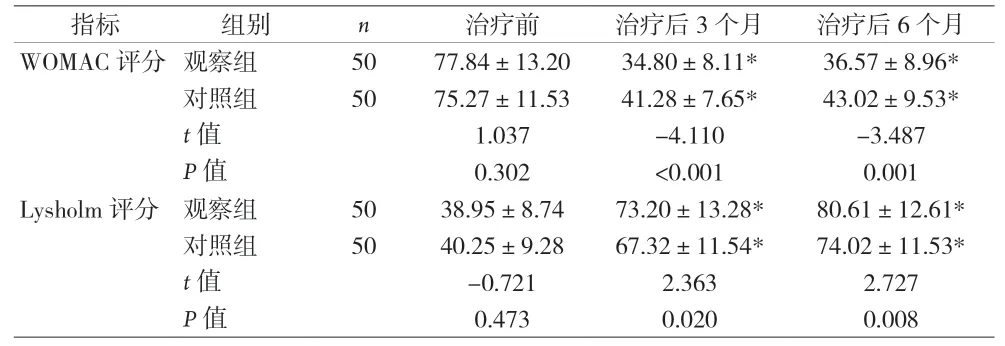
表1 两组患者膝关节功能评分比较[分,(±s)]
注:*P<0.05
指标 组别 n 治疗前 治疗后3个月 治疗后6个月WOMAC评分观察组 50 77.84±13.20 34.80±8.11* 36.57±8.96*对照组 50 75.27±11.53 41.28±7.65* 43.02±9.53*t值 1.037 -4.110 -3.487 P值 0.302 <0.001 0.001 Lysholm评分观察组 50 38.95±8.74 73.20±13.28* 80.61±12.61*对照组 50 40.25±9.28 67.32±11.54* 74.02±11.53*t值 -0.721 2.363 2.727 P值 0.473 0.020 0.008
2.2 两组患者实验室指标比较 见表2。
表2 两组患者实验室指标比较(±s)
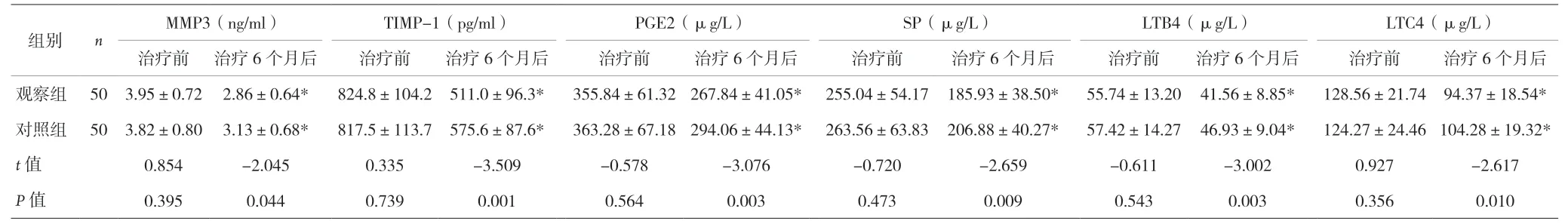
表2 两组患者实验室指标比较(±s)
组别 n MMP3(ng/ml) TIMP-1(pg/ml) PGE2(μg/L) SP(μg/L) LTB4(μg/L) LTC4(μg/L)治疗前治疗6个月后 治疗前 治疗6个月后 治疗前 治疗6个月后 治疗前 治疗6个月后 治疗前 治疗6个月后 治疗前 治疗6个月后观察组50 3.95±0.72 2.86±0.64* 824.8±104.2 511.0±96.3* 355.84±61.32 267.84±41.05*255.04±54.17 185.93±38.50* 55.74±13.20 41.56±8.85* 128.56±21.74 94.37±18.54*对照组50 3.82±0.80 3.13±0.68* 817.5±113.7 575.6±87.6* 363.28±67.18 294.06±44.13*263.56±63.83 206.88±40.27* 57.42±14.27 46.93±9.04* 124.27±24.46 104.28±19.32*t值 0.854 -2.045 0.335 -3.509 -0.578 -3.076 -0.720 -2.659 -0.611 -3.002 0.927 -2.617 P值 0.395 0.044 0.739 0.001 0.564 0.003 0.473 0.009 0.543 0.003 0.356 0.010
2.3 两组患者疗效比较 见表3。

表3 两组患者疗效比较[n(%)]
3 讨论
KOA发病机制与免疫功能网络(例如基质金属蛋白酶)失衡有关,但是尚不清楚哪些因素在KOA发作中起主导作用。临床常通过关节腔内注射透明质酸钠治疗KOA,但具有局限性,且远期疗效不佳、易复发。透明质酸作为一种高分子量多糖,进入膝关节腔后可起到润滑作用,防止关节受到严重磨损,还能够促进机体内部透明质酸的合成[12]。手术治疗多适于重症KOA患者,且具有治疗费用高、恢复时间长,及机体伤害大等缺点;不能够手术者,常通过将某种药物注入关节腔内来缓解疼痛并修复膝关节[13]。选择保守治疗还是手术治疗,一直是临床面临的问题[14]。ALI等[15]研究发现,透明质酸注射液和PRP联合应用可以修复退化的软骨并延缓KOA的发展。PRP被激活后,能够释放巨噬细胞和生长因子,可减少机体炎症反应,清除坏死组织,促进软骨修复。
本资料结果显示,治疗3、6个月后,观察组WOMAC评分低于对照组,而Lysholm评分高于对照组。表明,PRP和透明质酸联合应用可缓解疼痛,有助于患者更好地做康复运动。观察组显效率(64%)明显高于对照组(44%)。治疗6个月后,两组血清PGE2、SP、LTB4和LTC4水平均降低,观察组较对照组降低更显著。LTB4、LTC4能够使NF-KB信号通路增强,进而使炎症因子大量释放,从而强烈趋化炎性细胞,使其分泌较多致痛及致敏因子,加剧患者疼痛感,且上述因子高表达会促使KOA患者膝关节滑膜和软骨细胞的PGE2、SP等其他疼痛介质大量释放。PGE2是一种通过激活感觉神经末梢受体降低疼痛阈值的疼痛介质;SP是分布在神经细纤维中的一种伤害性刺激神经肽,可传播疼痛信息,引发患者疼痛感[16]。观察组患者关节腔注射自体PRP,由于PRP中有较多血小板衍生生长因子、炎症调节因子等,能够减轻机体炎症反应状态,使软骨基质大量合成,刺激软骨细胞正常增殖,改善机体微环;PRP中的炎症调节因子还能够影响NF-KB信号通路,减弱机体释放白三烯的强度,进而阻碍白三烯降解软骨基质的过程;PRP中的各类因子相互作用,促进干细胞增殖,使机体合成大量蛋白聚糖与胶原蛋白以修复关节软骨,从而减轻疼痛,改善患者症状。
MMP-3是一种基质溶素,TIMP是MMP-3的特异性抑制剂,通过抑制MMP-3的活性抑制软骨基质的裂解[17]。本资料结果表明,治疗6个月后,观察组血清MMP3和TIMP-1水平均低于对照组。分析原因,关节腔内注射自体PRP后,PRP通过刺激滑膜和软骨细胞合成透明质酸,下调软骨的分解代谢,上调II型胶原和金属蛋白酶抑制剂的表达,并降低MMP-3表达。II型胶原蛋白可减慢软骨细胞的凋亡过程,对软骨组织有修复作用。
