CD8+T淋巴细胞联合治疗线数对晚期肺癌免疫治疗疗效的预测价值
2021-04-25吴侃徐晓张敏娜杨邵瑜李鑫朱鲁程王冰汤艺夏冰陈雪琴马胜林
吴侃 徐晓 张敏娜 杨邵瑜 李鑫 朱鲁程 王冰 汤艺 夏冰 陈雪琴 马胜林*
肺癌是严重危害人类健康的恶性肿瘤之一[1],近年来以程序化细胞死亡受体1(PD1)或程序化细胞死亡配体1(PD-L1)抑制剂为代表的免疫治疗已成为继化疗、靶向治疗之后重要的系统性治疗方法[2-3]。既往研究发现各种潜在的免疫治疗疗效预测标志物,如PD-L1[4]、肿瘤突变负荷(TMB)[5],肠道微生物[6]、乳酸脱氢酶[7]、中性粒细胞/淋巴细胞比值[8]等,但仍存在检测平台和抗体的差异、截断值不明确、检测成本较高等问题。因此,开发便捷、经济、适用范围广的疗效预测手段是目前重要的研究方向。本文拟通过回顾性分析经免疫治疗的晚期肺癌患者临床特征包括基线细胞免疫功能与疗效的相关性,寻找可能的疗效预测因子。
1 材料与方法
1.1 临床资料 回顾性分析2017年1月至2020年12月本院84例接受免疫检查点抑制剂治疗的晚期肺癌患者临床资料,其中男70例,女14例;年龄36~85岁,中位年龄65岁。(1)纳入标准:①Ⅳ期;②接受PD1或PD-L1免疫治疗;③接受免疫治疗≥6个月或已出现免疫疾病完全缓解(iCR)/免疫疾病进展(iPD);④具有完整的临床资料;⑤免疫治疗前1周内均有完整的细胞免疫功能检验记录;⑥能获取最佳疗效评估结果。(2)排除标准:①病历资料不完整;②早期或局部晚期患者。疗效评价依据《免疫治疗实体瘤反应评价标准(iRECIST)1.1版》分为iCR、免疫部分缓解(iPR)、免疫疾病稳定(iSD)和iPD。
1.2 治疗方法 纳入患者均接受PD1或PD-L1免疫 治 疗,PD1药 物 包 括Pembrolizumab、Nivolumab、Durvalumab、信迪利单抗、特瑞普利单抗、卡瑞丽珠单抗;PD-L1药物包括Atezolizumab和CS1001;药物剂量参考药物说明书或临床研究方案。其中,单用免疫治疗50例,联合化疗或抗血管生成治疗34例。化疗方案包括紫杉醇/白蛋白紫杉醇联合铂类、培美曲塞联合铂类、依托泊苷联合铂类等,抗血管生成治疗包括贝伐珠单抗、安罗替尼等。
1.3 数据评估 根据iRECIST标准对所有研究对象进行疗效评估,按随访最佳疗效将其分为治疗有效组(iCR或iPR)和治疗无效组(iSD或iPD),其中未确认的PD(iUPD)必须在首次评估后4~8周内再次进行影像学评估直至确认的PD(iCPD)。
1.4 观察指标 采集并比较两组患者的临床一般资料,包括年龄、性别、KPS评分、吸烟史、病理、合并脑转移、激素用药史、抗生素用药史、联合化疗/抗血管治疗、PD-L1表达及治疗线数。采集两组患者免疫治疗前1周内的细胞免疫功能指标,包括总淋巴细胞、总T细胞(CD3+)、辅助/诱导T细胞(CD3+CD4+)、抑制/细胞毒T细胞(CD3+CD8+)、CD4/CD8比值、B细胞(CD3-CD19+)、NK细胞(CD3-CD56+)、免疫调节细胞(CD4+CD25+)、抑制性T细胞活化(CD8+CD38+),并分析各指标与疗效的相关性。
1.5 统计学处理 采用 SPSS 19.0统计软件。计量资料以(±s)表示,采用t检验或U检验;计数资料以n(%)表示,采用卡方检验;双变量相关分析采用Pearson相关性分析;多因素分析采用二元Logistic回归分析;最佳疗效联合预测指标的诊断价值评价采用ROC曲线分析。以P<0.05为差异有统计学意义。
2 结果
2.1 最佳疗效评估结果 评估为最佳疗效的时间为52.5 d(12~186 d)。治疗有效组26例,其中iCR 1例,iPR 25例,客观缓解率31.0%;治疗无效组58例,其中iSD 34例,iPD24例。
2.2 两组患者一般资料比较 治疗有效组患者激素使用率低于治疗无效组(3.8% vs 25.9%,P=0.038);一线治疗较二线及以上患者有更高的客观缓解率(57.6% vs 13.7%,P<0.001)。见表1。

表1 两组患者的临床一般资料比较[n(%)]
2.3 两组患者的细胞免疫功能指标比较 治疗有效组较治疗无效组有更高的淋巴细胞总数(P=0.026)、CD3+T细胞数(P=0.010)、CD8+T细胞数(P=0.009)和更低的免疫调节细胞百分比(P=0.005)。见表2。
表2 两组患者的细胞免疫功能指标比较(±s)

表2 两组患者的细胞免疫功能指标比较(±s)
组别 淋巴细胞总数(M/L)CD3+T细胞(M/L)CD4+T细胞(M/L)CD8+T细胞(M/L)CD4/CD8 B细胞(M/L)NK细胞(M/L)免疫调节细胞(%)抑制性T细胞活化(%)治疗有效组 1319.92±585.37 932.46±458.34 400.43±255.41 459.45±302.35 1.04±0.80 123.86±124.69 240.97±147.61 5.65±1.67 17.61±7.25治疗无效组 1029.14±368.18 667.01±266.45 326.84±164.39 288.33±115.07 1.23±0.52 76.07±65.00 264.59±154.87 7.15±3.10 18.79±8.38 t/Z值 2.334 2.752 1.349 2.797 1.303 1.845 0.655 2.869 0.625 P值 0.026 0.010 0.186 0.009 0.196 0.075 0.514 0.005 0.534
2.4 最佳疗效相关影响因素的多元Logistic回归分析 CD8+T淋巴细胞数与CD3+T淋巴细胞数(P<0.001)和淋巴细胞总数(P<0.001)均存在相关性;将单因素分析差异有统计学意义的因素包括治疗线数、CD8+T淋巴细胞数、免疫调节细胞百分比等纳入多元Logistic回归分析,结果显示治疗线数(P<0.001)及低CD8+T淋巴细胞(P=0.003)是疾病进展的独立危险因素,CD8+T淋巴细胞的最佳截断值为278.8 M/L;治疗有效组患者接受一线治疗的比例、CD8+T淋巴细胞数值均高于治疗无效组。见图1~3、表3。

图1 两组患者的CD8+T淋巴细胞数与淋巴细胞总数和CD3+T淋巴细胞数的相关性分析

图2 两组患者的CD8+T淋巴细胞分布和离散趋势,★★P<0.01

图3 两组患者的治疗线数分布,★★★P<0.001
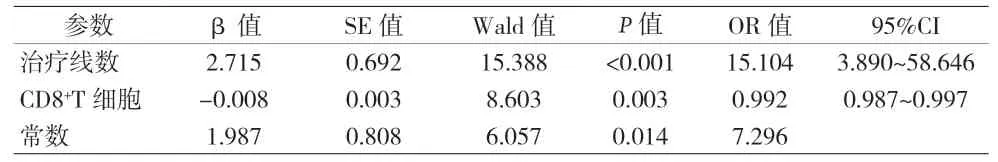
表3 最佳疗效相关影响因素的多元Logistic回归分析
2.5 治疗线数与CD8+T淋巴细胞对晚期肺癌患者免疫治疗最佳疗效的预测能力比较 基线CD8+T淋巴细胞ROC曲线下面积为0.713,治疗线数ROC曲线下面积为0.745,二者联合ROC曲线下面积为0.853,与参考线下的面积相比差异均有统计学意义(P<0.001),灵敏度88.2%,特异度73.3%。见图4。

图4 治疗线段数与CD8+淋巴细胞预测晚期肺癌最佳疗效ROC曲线
3 讨论
近年来,PD1/PD-L1抑制剂免疫治疗在NSCLC治疗中取得了良好的疗效,且总体耐受性良好,但部分患者仍有可能出现免疫相关的严重不良反应,因此亟需研发有效的疗效预测指标。PD-L1、TMB等指标与免疫治疗疗效相关,但由于敏感性、特异性不足等问题,临床应用仍存在较大局限性,本文治疗有效组与治疗无效组患者PD-L1表达无明显差异,这可能与部分患者PD-L1表达状态未知有关。单一指标的检测可能无法满足临床需求,基于多指标的联合预测将是重要的研究方向。
目前,对于免疫治疗前接受过一线甚至多线治疗的肺癌患者是否存在疗效差异仍存在争议。HERBST R S等[9]研究提示,PD1在NSCLC的后线治疗中疗效并不理想,Pembrolizumab单药二线治疗PD-L1阳性(≥1%)晚期NSCLC的客观缓解率为18%,无进展生存期为4个月。日本一项研究选取Nivolumab经治的晚期NSCLC患者79例进行回顾性分析,发现不同线数使用免疫治疗的客观缓解率不同,2线为28.3%、3线为23.1%、4线为10.5%[10]。然而,KHOZIN S等[11]选取接受免疫治疗的转移性NSCLC患者1344例进行回顾性分析,发现后线治疗并不影响患者生存时间。本研究对84例晚期肺癌患者的临床特征进行分析,发现一线治疗较二线及以上患者有更高的疾病缓解率(57.6% vs.13.7%,P<0.001),多因素分析显示后线治疗是疾病进展的独立危险因素(OR=15.104,95%CI:3.890~58.646,P<0.001)。免疫检查点抑制剂并不直接用于杀伤肿瘤细胞,而是通过激活肿瘤患者体内的免疫系统,调动能够识别肿瘤的免疫细胞,通过机体抗肿瘤免疫达到杀灭和控制肿瘤的效果。传统抗肿瘤治疗手段直接杀伤肿瘤细胞,但不可避免的也会破坏机体免疫系统,造成免疫功能低下甚至衰竭,因此后线免疫治疗机体反应不足,疗效欠佳不难解释。
既往研究显示,机体免疫系统在肿瘤患者尤其是接受免疫治疗的患者治疗结局中发挥重要作用[12-14]。2018年《Science》一项研究报道,免疫治疗有效患者有着更高密度的基线肿瘤浸润CD8+T细胞和循环CD8+T以及CD4+T细胞[15]。2019年一项Meta分析纳入晚期肺癌患者14,395例,发现肿瘤浸润性CD8+T淋巴细胞的增多与预后相关,3年总生存率AUC 0.659、5年总生存率AUC 0.665[16]。一项多中心、随机、开放III期研究Impassion130评估阿替利珠单抗联合白蛋白紫杉醇与白蛋白紫杉醇一线治疗转移性或不可手术的局部晚期三阴性乳腺癌发现,瘤内CD8+T细胞高表达者有较好的无进展生存期和总生存期[17]。此外,肺癌患者外周血CD8+T细胞激活也被认为与免疫治疗疗效相关[18]。尽管目前越来越多的证据表明,免疫微环境在PD1/PD-L1疗效预测中具有重要价值,然而尚缺乏基线外周血免疫功能与疗效相关性的研究。本研究通过比较分析患者基线细胞免疫功能指标,发现低CD8+T细胞是疾病进展的独立危险因素,多因素分析(OR=0.992,95%CI:0.987-0.997,P=0.003)维持了这一结果,提示免疫功能较差尤其是CD8+T细胞较低的患者要谨慎使用免疫治疗,278.8M/L是一个可以参考的截断值。为探索联合指标预测免疫治疗疗效,本研究通过Logistic回归模型计算基线CD8+T淋巴细胞数量与治疗线数联合预测评分,ROC曲线分析发现联合指标的曲线下面积为0.853,联合指标达到0.517时,灵敏度为88.2%,特异度为73.3%,此时的Youden指数最大,相比单一指标具有更高的预测价值。
综上,本研究首次采用基线CD8+T淋巴细胞联合治疗线数预测免疫治疗疗效,与既往研究的治疗后淋巴细胞以及肿瘤浸润淋巴细胞相比,基线 CD8+T淋巴细胞可以指导治疗并能更早地预测疗效,临床开展便捷且具有无创性。本研究尚存在一定的局限性,这是一项回顾性研究,且样本量有限,有待大样本的前瞻性研究予以验证。
