梗死体积及相关生化指标对心源性卒中抗凝治疗后早期出血性转化的预测价值
2021-04-25沈雨莎吴承龙
沈雨莎 吴承龙
出血性转化(HT)是脑梗塞的常见并发症,可引起早期神经功能恶化[1-2],并会影响长期功能预后。心源性卒中患者HT的发生率高于其他卒中患者[3-4]。20%的缺血性卒中是由于心脏栓子脱落所致,最常见原因是心房颤动(AF),房颤患者易在左心房及二尖瓣瓣膜处形成血栓,其栓子脱落进入脑内导致脑血管栓塞。相较于动脉粥样硬化性脑梗死,AF导致的栓子稳定性较差,易因溶解或自发性移动使再灌注发生于已损伤的血管。因此AF可导致更严重的脑卒中和更持久的短暂性脑缺血发作(TIA)[5]。对于伴有房颤的缺血性卒中患者,口服抗凝剂治疗是二级预防的重要策略[6],但抗凝治疗可能会增加HT的风险[7]。既往研究发现,较大的梗死体积和严重的神经功能缺损是预测HT的危险因素[8],其他如高血压[9]、高血糖[10]、低血小板计数[11]、较低的低密度脂蛋白水平[12]等,也可能与HT的发生有关。本文探讨梗死体积及相关生化指标对心源性卒中患者抗凝治疗后早期发生HT的预测价值。
1 资料与方法
1.1 临床资料 收集2017年3月至2020年3月绍兴市人民医院急性心源性脑梗塞患者306例。纳入标准:(1)年龄≥18岁;(2)非瓣膜病房颤(NVAF)患者,新诊断为轻度缺血性卒中(NIHSS<8);(3)使用口服抗凝剂利伐沙班、达比加群、华法林或阿司匹林其中之一;(4)签署知情同意书;(5)有生育能力的患者同意在试验期间和完成研究治疗后的数周内使用可接受的避孕措施。排除标准:(1)肾功能损害(CrCl<30 ml/min);(2)抗凝治疗前诊断出血性转化或颅内出血;(3)无法控制收缩压<160 mmHg;(4)血小板计数<100×109/ L;(5)既往自发性出血性转化病史;(6)30 d内大手术或创伤史;(7)6个月内临床显著胃肠道出血史;(8)怀孕或其他严重疾病(如肿瘤患者),预期寿命<6个月;(9)利伐沙班、达比加群、华法林、阿司匹林禁忌证;(10)在本研究之前和期间参与另一项干预性研究的患者。306例患者中男185例,女121例;年龄50~92岁。其中利伐沙班组69例,达比加群组57例,华法林组120例,未抗凝组60例。
1.2 方法 (1)药物治疗:利伐沙班组患者接受利伐沙班20 mg,1次/d(肌酐清除率:30~49 ml/min和/或年龄≥75岁和/或体重≤50 kg,15 mg,1次/d)长期治疗;达比加群组患者接受达比加群110 mg,2次/d;华法林组患者接受华法林5 mg,1次/d;未抗凝组患者将接受阿司匹林肠溶片100 mg,1次/d。对于HT患者,立即停止抗凝药物治疗。(2)影像学检查:所有患者入院时均行头颅MRI检查,通过本院影像学系统计算脑梗死体积。入组(30±3)d行磁敏感成像(SWI)。由神经内科主治医师以上阅片诊断是否存在HT。(3)生化指标检测:所有患者入院时均行血常规、生化组合(空腹)、凝血谱、D-二聚体检测,记录Plt、CPR、D-二聚体、LDL、Hcy、PT、APTT、TT、INR及空腹血糖值。
1.3 统计学方法 采用SPSS 25.0统计软件。多组间比较采用方差分析;用单因素及多因素Logstic回归分析可能的危险因素及预测值,用受试者工作曲线(ROC)曲线分析梗死体积及相关生化指标的预测值。以P<0.05为差异有统计学意义。
2 结果
2.1 四组患者临床资料比较 见表1。
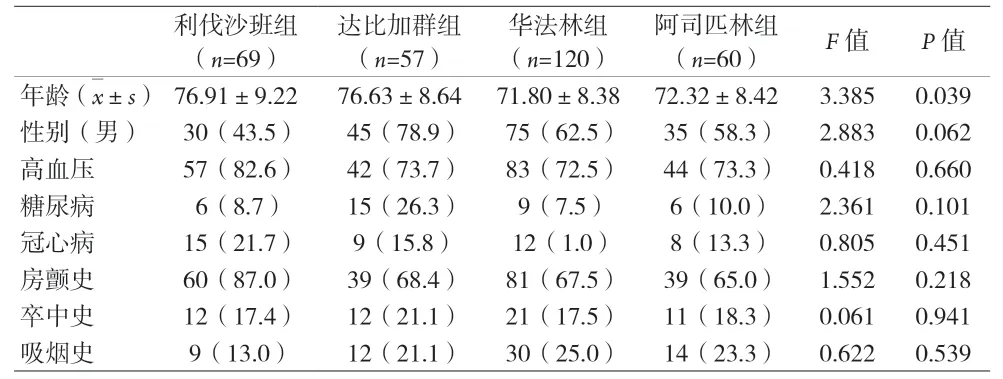
表1 四组临床资料比较[n(%)]
2.2 四组HT发生率比较 四组使用不同药物治疗30 d内通过SWI确诊是否合并HT。利伐沙班组HT15例,发生率为21.7%;达比加群组HT18例,发生率为31.6%;华法林组HT30例,发生率为25%。阿司匹林组无HT发生。
2.3 HT的危险因素比较 单因素分析结果显示,Plt、D-二聚体、PT、INR、空腹血糖、MRI梗死体积与卒中出血性转化存在相关性(P<0.05)。见表2。多因素分析结果显示,吸烟史、D-二聚体、PT、空腹血糖、MRI梗死体积是卒中HT的危险因素。见表3。
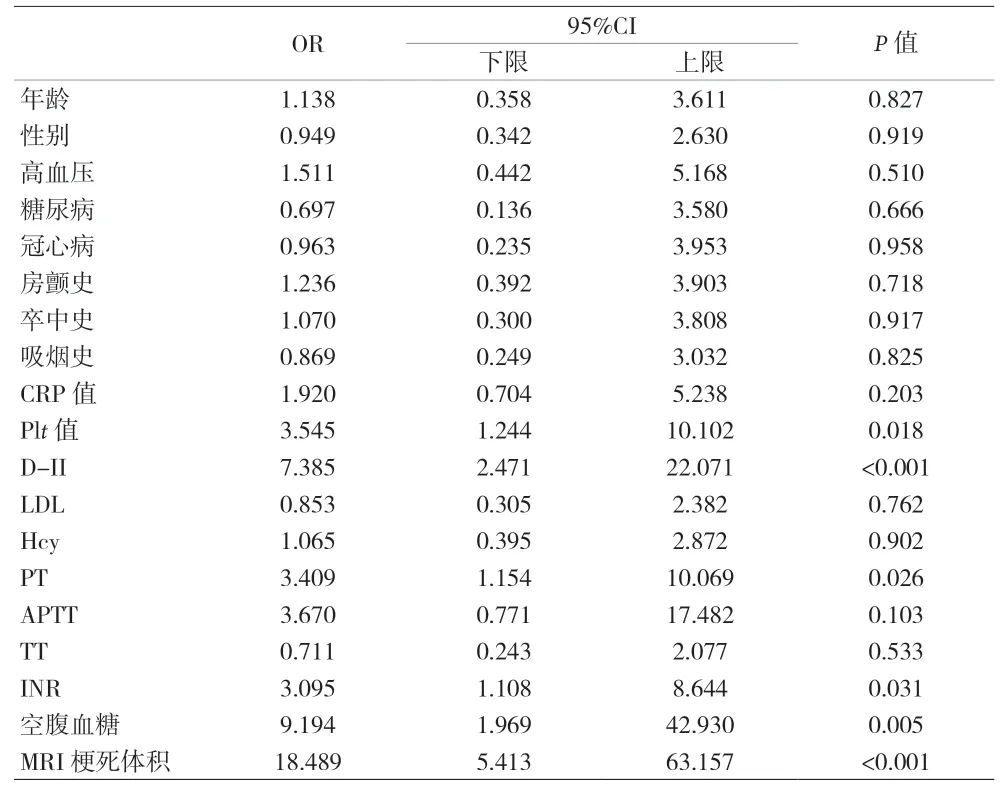
表2 单因素Logistic回归分析
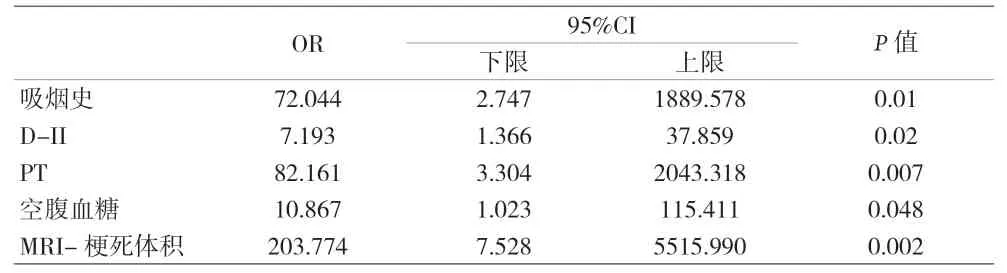
表3 多因素Logistic回归分析
2.4 HT危险因素的预测值 HT危险因素的ROC曲线见图1。D-二聚体、空腹血糖、MRI梗死体积对HT具有诊断效应(P<0.05),其诊断准确度分别为69.9%、65.7%、90.9%。其最大约登指数分别是0.454、0.347、0.724。当满足最大约登指数时,其预测值分别是0.84 ng/L、4.81 mmol/L、14,910 mm3。见表4。
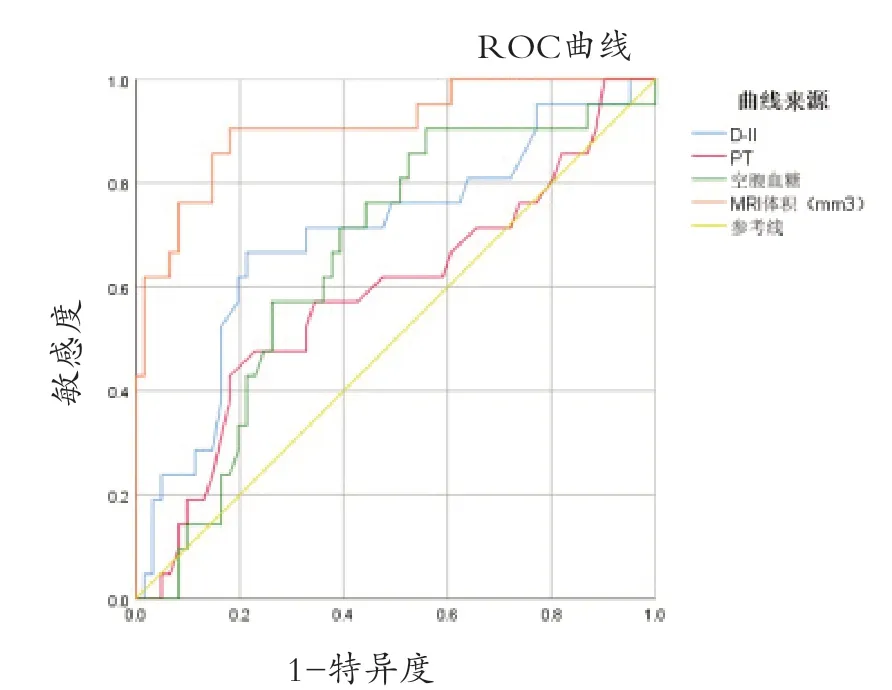
图1 HT危险因素评估的ROC曲线
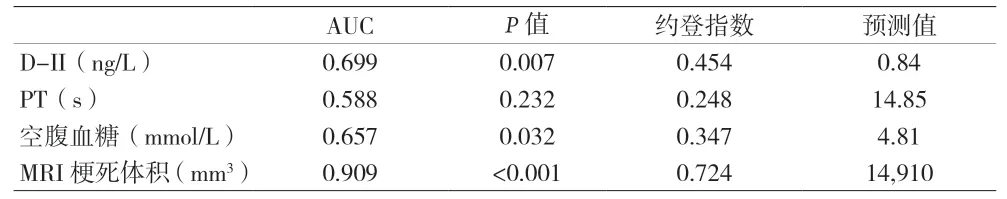
表4 HT危险因素的ROC曲线分析
3 讨论
AIS患者HT的发生机制至今仍未完全阐明。目前为大多数学者所认同的是在血脑屏障被破坏的基础上发生的再灌注损伤及炎症反应所致。有证据表明在缺血性卒中发生后,血脑屏障的破坏可在10 min内发生[13]。而血脑屏障的开放可能与梗塞和灌注状态有关[14]。在脑梗塞发生的24 h内,血脑屏障持续性破坏,并可持续数周。活性氧(ROS)在出血性转化中起重要作用,缺血组织再灌注可从多种来源产生ROS,包括细胞内线粒体、NADPH氧化酶、黄嘌呤氧化酶、细胞膜受体和炎症介质等[15]。缺血再灌注产生的ROS可通过破坏内皮细胞、周细胞、平滑肌细胞和星形胶质细胞从而破坏神经血管单位。而促成ROS产生的因素包括年龄、葡萄糖、梗塞面积、充血性心力衰竭及肾功能不全等[16]。故这些因素均可能导致HT的发生。近年来,对于HT预测因素的研究日渐增多。有研究表明[10],高血糖大鼠的HT发生率更高,其原因可能是较高水平的血糖引发血栓炎症级联反应,从而放大颅内动脉闭塞的下游微血管血栓炎症,加剧神经血管损伤、血脑屏障破坏和出血性转化。在一项纳入474名缺血性脑卒中患者的队列研究表明,HT与更多的FLAIR高信号血管征、血栓长度(>8 mm)及更大的梗死体积相关[17]。
本资料结果显示,吸烟史、D-二聚体、PT、空腹血糖及MRI梗死体积均为抗凝治疗后HT的危险因素(P<0.05)。进一步ROC曲线分析可知,D-二聚体、空腹血糖及MRI梗死体积对HT结局具有预测价值(P<0.05),这对临床指导治疗心源性卒中患者或许有一定价值。当心源性卒中患者考虑使用抗凝剂治疗前,其D-二聚体、空腹血糖、MRI梗死体积若大于诊断临界值,对于抗凝剂的使用及剂量需要一定的调整,评估其利弊及风险,以减少HT的发生,最大程度提高卒中患者的预后。
