亚急性与慢性皮肤红斑狼疮的临床及免疫学特征比较
2021-04-25宣小芳洪宝建苏丽韫
宣小芳 洪宝建* 苏丽韫
红斑狼疮(LE)是一种慢性自身免疫系统疾病,受遗传、环境及激素等因素影响,表现为不同临床特征。皮肤受累几率约70%~80%,可表现为特异性或非特异性,前者根据病变的临床特征又可分为急性(ACLE)、亚急性(SCLE)和慢性(CCLE),CCLE最常见的形式是盘状红斑狼疮(DLE),表现为红斑、毛细血管扩张、萎缩及瘢痕形成等[1]。SCLE的特征是阳光暴露位置出现银屑和(或)环形病变,存在抗Ro/SSA抗体,且常与人淋巴细胞抗原(HLA)-DR3相关,但广泛性的DLE亦可能有光分布的病变,存在抗Ro/SSA抗体的DLE患者可被误认为是SCLE[2]。研究发现,病变皮肤组织学特征中SCLE相对稀疏,浅表浸润,DLE则较为浓密,浸润较深[3];免疫荧光研究显示能够较好地对两者进行区分,SCLE表皮呈颗粒状染色,DLE中则存在明显颗粒-表皮交界位置[4]。本文回顾分析SCLE与CCLE的临床与免疫学特征差异。
1 资料与方法
1.1 临床资料 回顾性分析2017年1月至2019年12月本院就诊的598例皮肤红斑狼疮患者的临床资料,其中SCLE 275例,CCLE 323例。纳入标准:(1)依据2019年欧洲抗风湿病联盟(EULAR)联合美国风湿病学会(ACR)共同发布了系统性红斑狼疮的分类标准诊断SLE[5];SCLE和CCLE的诊断则依据中华医学会皮肤性病学分会红斑狼疮研究中心2019版皮肤型红斑狼疮诊疗指南[6],按照临床和病理学特点,SCLE包括环形红斑型和丘疹鳞屑型,CCLE则包括局限性和广泛性盘状红斑狼疮、疣状红斑狼疮、肿胀性红斑狼疮、深在性红斑狼疮、冻疮样红斑狼疮、Blaschko线状红斑狼疮;(2)住院资料完整。排除标准:(1)药物相关的皮肤损害;(2)先天性遗传病者。
1.2 方法 (1)基本数据采集:患者临床与血清学特征:①CLE的类型;②发病年龄,即最初出现的临床表现明显归因于CLE;③确诊年龄;④入院时年龄;⑤免疫学特征,包括抗核抗体ANA、抗DNA、抗-Ro、抗-La、抗-Sm及抗核糖核蛋白RNP抗体。(2)临床特征与免疫学检测:临床表现包括雷诺现象、关节炎、关节疼痛、浆膜炎、肾病、干眼症、口干症和系统性红斑狼疮SLE。SCLE与CCLE间的区别仅基于皮肤临床发现,未参考组织学或血清学检查结果。SLE皮肤特征为环形病变(阳光暴露位置呈环形红斑,鳞状病变,逐渐消退无瘢痕或萎缩)或丘疹鳞屑样变(离散红斑鳞屑丘疹主要位于面部和手背,愈后不留瘢痕或萎缩)。盘状病变的皮肤特征是红斑、毛细血管扩张、萎缩和瘢痕形成。(3)对所有患者进行随访评估,参照Gilliam和Sontheimer报告的标准对皮肤病变进行分类,任何红斑狼疮特异性皮损类型的评估依据美国风湿病学会(ACR)对SLE的标准,SLE的诊断至少满足4项ACR标准。通过采用欧蒙斑点法检测试剂盒检测ANA(ANA+≥1∶32);通过酶联免疫吸附试验(ELISA)定量检测到抗双链(dsDNA)抗体(正常浓度为0~75 IU/ml)。采用免疫印迹法检测核抗原(ENA)的抗体,包括Ro/SS-A、La/SS-B、U1-snRNP和Sm;通过免疫散射速率比浊法检测类风湿因子;补体因子C3(正常0.79~1.52 g/L)和C4(正常0.16~0.38 g/L)通过免疫散射速率比浊法检测;CH50通过溶血技术测定。活检组织标本首先固定于福尔马林中,后进行石蜡包埋和切片,采用苏木精-伊红染色及阿尔辛蓝高碘酸雪夫染色,根据Bangert等提出的LE组织学标准进行分析;暴露于阳光下的病灶和非病灶皮肤进行直接的免疫荧光检查。
1.3 统计学方法 采用SPSS 19.0统计软件。计量资料以(±s)表示,组间比较采用t检验或Mann-Whitney U检验,计数资料比较用χ2检验或Fisher精确检验,P<0.05为差异有统计学意义。
2 结果
2.1 一般资料 CCLE患者中男女比例为136∶187,首次出现症状的年龄(41.5±3.6)岁;确诊时年龄(43.8±5.0)岁;入院时平均年龄(44.8±4.5)岁。病程(2.7±1.3)年。SCLE患者中男女比例为113∶162,首次出现症状的年龄(42.0±6.8)岁;确诊时年龄(43.9±3.9)岁;入院时平均年龄(45.1±4.7)岁。病程(2.2±1.2)年。
2.2 SCLE与CCLE患者临床特征比较 见表1。
2.3 实验室及免疫学结果 SCLE患者中贫血、细胞减少症、蛋白尿、类风湿因子升高、红细胞沉降率(ESR)升高、ANA、抗DNA、抗-Ro、抗-La、抗RNP、抗-Sm抗体水平均高于CCLE患者,而补体C3、C4则偏低(P<0.05)。CCLE患者中与局部性DLE相比,广泛性DLE患者中光敏性、贫血及抗DNA抗体升高几率升高(P<0.05);SCLE患者中147例ANA抗体阳性,与阴性患者相比其关节痛、关节炎、肾病、口干症、SLE等发病率升高(P<0.05);49例患者抗DNA抗体呈阳性,与阴性患者相比临床表现亦呈现出类似的趋势;抗Ro抗体、抗La抗体、抗Sm抗体、抗RNP阳性患者的临床表现发生率均高于阴性患者(P<0.05)。见表2。
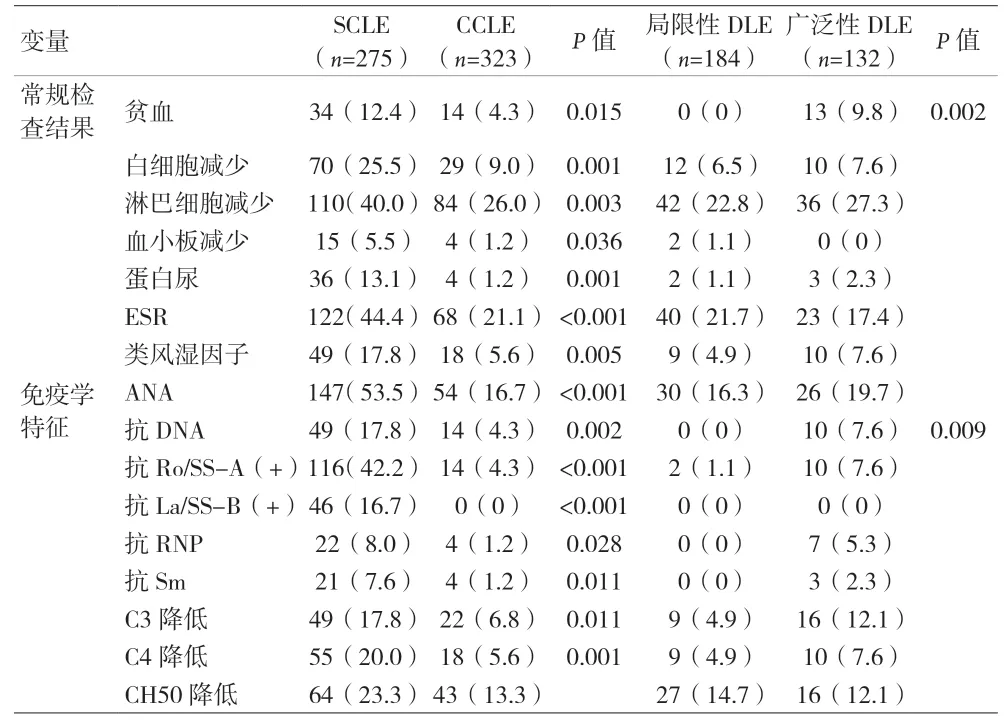
表2 SSLE与CCLE患者实验室检查结果[n(%)]
2.4 系统性红斑狼疮差异比较 所有患者中118例(19.7%)诊断为SLE,SCLE患者同时合并SLE时脱发、雷诺现象、关节痛、干眼症等临床疾患的发病率升高(P<0.05);其中贫血、血细胞减少、血沉及各类因子异常的几率高于非SLE患者人群(P<0.05)。CCLE患者合并SLE时亦有类似的差别,患者出现躯干、手臂、下肢病变的几率显著升高(P<0.05),见表3。

表3 是否合并SLE的免疫学检查结果[n(%)]
3 讨论
本资料结果显示,对于病变的分布和类型、系统特征及免疫学,CCLE和SCLE表达存在差异。SCLE应视为红斑狼疮独立的亚组,其与CCLE的病程和预后不同。与CCLE患者相比,SCLE患者的皮肤病变、环形与丘疹病变、雷诺现象、黏膜溃疡、蝶形斑、光敏感、血管炎等频率更高,而盘状病变及脱发的频率偏低。广泛性盘状病变的光敏性、脂膜炎和SLE患病率高于局限性病变者,这与文献报道结果一致[7],也有学者指出盘状病变由局部至广泛性的转变是SLE发生前的警报信号[8]。一项研究指出抗疟药一般难以阻止皮肤红斑狼疮的进展,伴有光敏性、脱发、口腔溃疡、雷诺现象患者的临床预后通常较差[9]。本资料中SCLE患者黏膜溃疡与ANA、抗DNA、抗Sm和抗RNP抗体有关,而口干症仅与ANA相关。
非特异性抗体与疾病相关皮肤损伤的鉴别具有重要的临床意义,因为其可能提示潜在的系统性疾病。有学者在SLE患者活动期发现红斑狼疮非特异性皮损[10],本研究中不仅SLE患者中发现非特异性皮损,还发现于非SLE的患者中,此外,血管炎与ANA和抗DNA抗体有关,而雷诺现象与ANA、抗Sm和抗RNP抗体有关。SCLE患者的常见主诉是非皮肤病变,例如关节疼痛、关节炎等,患者发生肾炎、严重中枢神经系统疾病的几率通常较低,而CCLE患者则多以皮肤病变为主,这与文献中的相关报道观点一致[11]。有学者指出对于CLE患者若其表现出肾病、关节疼痛和ANA滴度升高则可具有发展成为SLE的风险[12]。本研究中整体而言,光敏性、关节痛、关节炎、肾病和干眼症都与SLE有关;SCLE合并SLE的患者还伴有脱发、雷诺现象、黏膜溃疡、血管炎和口干症。关节痛与ANA、抗DNA和抗Ro抗体相关,关节炎与ANA、抗DNA抗体相关,肾病与ANA、抗Ro和抗La抗体有关。
本资料显示,由皮肤病变进展为SLE的患者常表现为临床症状和(或)持续实验室检查异常,包括关节炎、持续活跃的广泛性皮损、ESR持续升高、ANA持续阳性和(或)贫血存在,SLE与ANA、抗DNA、抗Ro、抗Sm和抗RNP抗体相关。SCLE患者的实验室与免疫学异常患病率高于CCLE患者,不同的学者发现与局部性病灶相比,广泛性病变的实验室检查结果异常更为常见[13-15],也有研究中报道SCLE患者更容易出现ESR升高[16]。DLE患者中白细胞减少症是SLE的表现之一,虽然本研究中CCLE患者异常的实验室检查结果并不常见,但淋巴细胞减少症发生率高于其他部分研究报道的结果[17],且广泛性盘状病变与贫血及抗DNA抗体相关。
本资料结果显示,无论SCLE患者还是CCLE患者,白细胞减少症、淋巴细胞减少症、ANA、抗DNA抗体、抗Ro抗体均与SLE相关;SCLE患者中除血小板减少和抗La抗体外,所有实验室检查参数均与SLE相关。ANA是红斑狼疮患者中最常检测到的自身抗体,有研究显示ANA滴度常与SLE的发展风险有关[18],本资料中ANA与关节痛、口干症、血管炎等临床表现间存在关联。抗dsDNA抗体,特别是IgG同种型的抗dsDNA抗体,通常被认为是SLE的标志且与疾病活动相关[19],其与关节疼痛、关节炎、血管炎、黏膜溃疡和SLE间存在关联,在SCLE患者中发现抗Ro和抗La抗体,但在CCLE患者中较少发现,抗体阳性患者的临床表现亦通常较多,补体水平异常在CCLE患者中较为少见,更多见于SLE患者中,且研究报道此类患者进展为肾病、血管疾病和抗体系统异常的几率较高。
综上所述,CCLE和SCLE的差异主要表现在病变的分布和类型、系统特征及免疫学检测结果,SCLE患者皮肤病变的患病率、系统特征及免疫学检查结果异常的几率显著高于CCLE,因此与SLE更为接近。
