HBeAg阴性慢性乙型肝炎患者HBV MHR外变异临床意义
2021-04-24顾超章晓鹰孙学华张珏高月求
顾超 章晓鹰★ 孙学华 张珏 高月求
乙型肝炎肝病毒(hepatitis B virus,HBV)e 抗原(HBeAg)为病毒复制标志,HBeAg 转阴代表了慢性感染的免疫控制,被称为是乙型肝炎病毒感染自然史中的里程碑[1-2]。非活动性乙型肝炎病毒表面抗原(HBsAg)携带者预示着较好的临床转归预后。然而部分非活动性HBsAg 可产生HBV 再复制,发展为HBeAg 阴性慢性乙型肝炎[3],治愈难,预后较差,与肝癌、肝硬化的发生具有较大关联[2,4]。HBV 的感染史取决于病毒、宿主和环境之间的相互作用[5]。HBV S 蛋白即为俗称的HBsAg或澳大利亚抗原,S 蛋白分为主要亲水区(major hydrophilic region,MHR)与MHR 外两部分,由226个氨基酸组成。MHR 区为B 细胞表位(“a”决定簇位于此区域),MHR 外区包含细胞毒T 淋巴细胞(cytotoxic T lymphocytes,CTL)和辅助T 细胞(T-helper,Th)免疫表位区(CTL+Th 免疫表位区)与非免疫表位区[6-8],在刺激宿主相关的免疫功能中扮演重要角色[9]。本实验前期研究发现:经历HBeAg 血清学转换后,HBV S 蛋白的MHR 外出现明显变异,且此区域变异在HBeAg 阴性慢性乙型肝炎组达峰值[10]。本研究进一步分析HBeAg 阴性慢性乙型肝炎患者HBV MHR 外免疫表位区与非免疫表位区变异特征,同时探讨变异临床意义。
1 资料与方法
1.1 一般资料
选择2019年3月至2019年12月本院东院肝炎科门诊或住院慢性乙肝患者154 例。依据2019版《慢性乙型肝炎防治指南》[5],分为非活动性HBsAg携带状态组55 例,其中男性32 例,女性23 例,平均年龄(38.80±9.90)岁,B 基因型34 例,C 基因型21 例;HBeAg 阴性慢性乙型肝炎组99 例,男性57例,女性42 例,平均年龄(43.23±10.56)岁,B 基因型50 例,C 基因型49 例。两组基因型与性别无关,差异无统计学意义(P>0.05)。本实验经本院伦理委员会审批通过,所有患者均知情并同意。
纳入标准:①非活动性HBsAg 携带状态组:HBsAg 阳性、HBeAg 阴性、抗HBeAb 阳性,HBVDNA<2 000IU/mL,丙氨酸氨基转氨酶(alanine aminotransferase,ALT)与天门冬氨酸氨基转氨酶(aspartate aminotransferase,AST)正常;②HBeAg阴性慢性乙肝组:HBsAg 阳性、HBeAg 阴性、抗HBeAb 阳性,ALT 持续或反复异常,HBV-DNA>2 000 IU/mL。以上所有患者均有抗病毒药物治疗史。排除标准:排除合并其它病毒感染。
1.2 方法
1.2.1 试剂/仪器
DNA 提取试剂盒与DNA 第一次纯化试剂盒(购自德国QIAGEN 公司),DNA 第二次纯化试剂盒(购自美国Applied Biosystems 公司),基因分析仪3500DX(购自美国Applied Biosystems 公司)。
1.2.2 HBV-DNA S 区基因测序
患者血浆(EDTA 抗凝管)200 μL 用于核酸提取,按操作说明书进行操作。按Genbank HBVDNA(HBV genotype B DNA,complete genome,LC036263;HBV genotype C DNA,complete genome,AB644286)的S 基因序列,利用Primer Primer 5.0 设计引物(表1)。二者均涵盖整、MHR 区域与MHR 外区域。
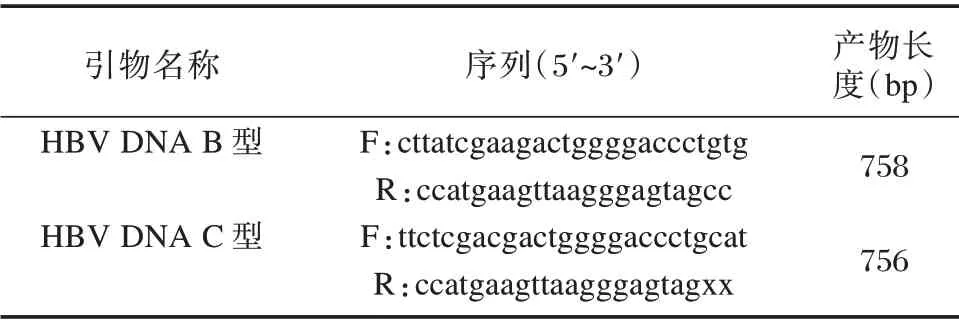
表1 HBV-DNA S 区引物序列Table 1 Primer sequence of HBV-DNA S region
HBV-DNA 核酸提取后分别进行PCR 第一轮扩增与纯化,获得的PCR 产物进行测序PCR 扩增与纯化,纯化后的测序PCR 产物直接加入10μL 的去离子甲酰胺(Hi-Di Formamide),短时振荡溶解DNA,95℃变性5 min,迅速置于冰上或4℃冷却4 min,3500 DX 基因分析仪上样测序。利用Primer Primer 5.0 将核苷酸序列翻译成氨基酸序列,BLAST 分析软件进行氨基酸序列比对。见表2。
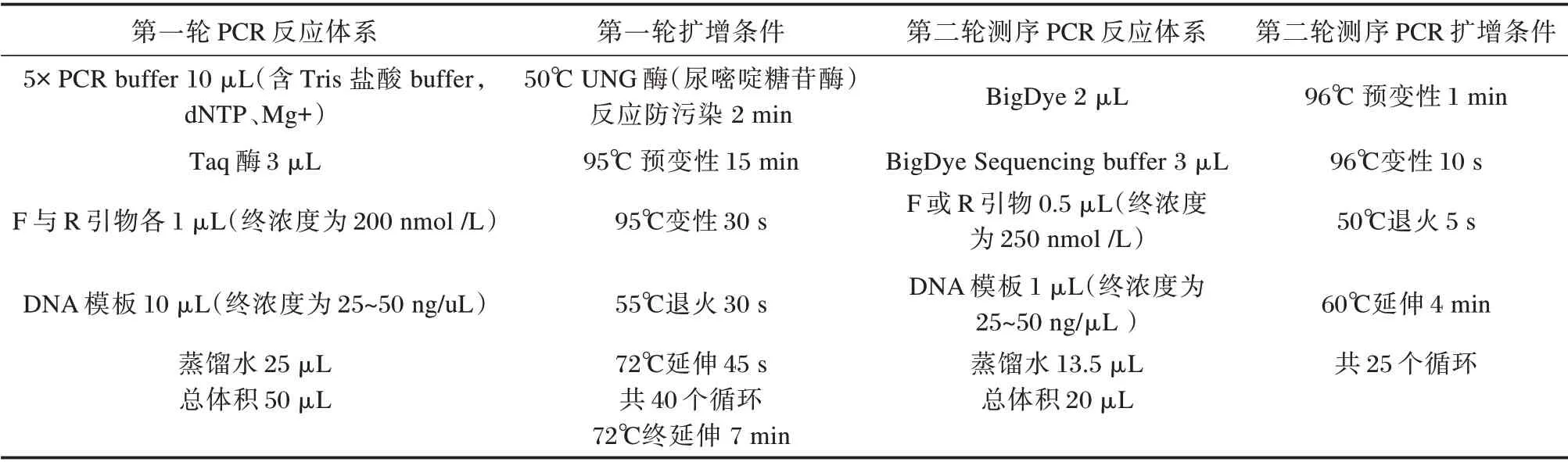
表2 PCR 反应体系Table 2 PCR reaction system
1.3 统计学方法
利用SPSS 16.0 统计软件,计数资料用n(%)表示,采用χ2检验;非正态分布采用中位数(M)[四分位数(P25~P75)]表示,两组间比较采用非参数Mann-WhitneyU检验;P<0.05为差异有统计学意义。
2 结果
2.1 两组HBV MHR 与MHR 外各区域变异比较
HBeAg 阴性慢性乙型肝炎组MHR 外总体变异率显著高于非活动性HBsAg 携带组,差异有统计学意义(P<0.05)。MHR 外的变异差异主要来自CTL+Th 免疫表位区,CTL+Th 免疫表位区的HBeAg 阴性慢性乙型肝炎组变异率显著高于非活动性HBsAg 携带组,差异有统计学意义(P<0.01)。此外,MHR 与其区域内的“a”决定簇变异率两组之间差异无统计学意义(P>0.05)。见表3。
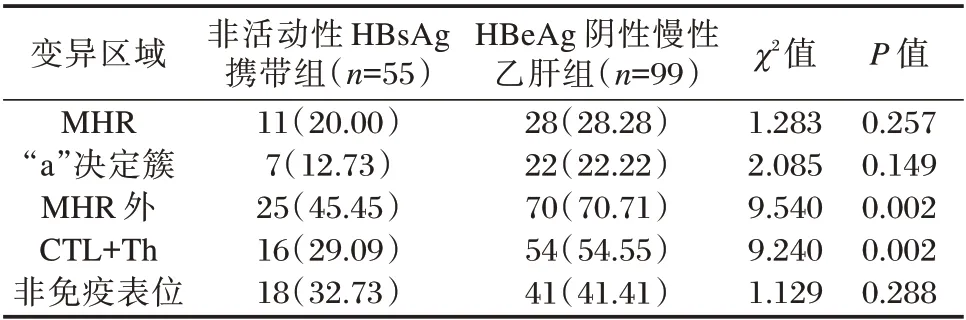
表3 两组HBV MHR 与MHR 外各区域变异比较[n(%)]Table 3 Comparison of variation in HBV MHR and other regions between the two groups[n(%)]
2.2 两组HBV MHR 与MHR 外各区域热点变异位点比较
MHR 与“a”决定簇热点变异位点为T/I126/T/S/A,此位点在HBeAg 阴性慢性乙型肝炎组变异频次为16.16%,高于非活动性HBsAg 携带组,差异无统计学意义(P>0.05)。MHR 外CTL+Th 免疫表位区热点变异位点在非活动性HBsAg 携带组是F220L,在HBeAg 阴性慢性乙型肝炎组是L21S;MHR 外非免疫表位区两组均为I68T/N。HBeAg 阴性慢性乙型肝炎组MHR 外总体变异频次为17.17%,高于非活动性HBsAg 携带组,差异无统计学意义(P>0.05)。见表4。
3 讨 论
非活动性HBsAg 携带状态者约20%~30%会出现病毒再复制,成为HBeAg 阴性慢性乙型肝炎[3]。非活动性HBsAg 携带者通常血清中HBVDNA 低于检测限或接近检测限,但低于检测限患者无法进行病毒DNA 测序。因此,本研究选取HBV DNA<2000 IU/mL 患者为非活动性HBsAg 携带组观察对象。结果显示非活动性HBsAg 携带者MHR 外总体变异率明显低于HBeAg 阴性慢性乙型肝炎患者,其变异主要出现在CTL+Th 免疫表位区,并使HBeAg 阴性慢性乙型肝炎发生概率增加2 倍以上。相关研究表明,CTL、Th 细胞介导的细胞免疫相较B 淋巴细胞介导的体液免疫,在病毒清除过程中具有更主导、更关键性作用[11],如果CTL+Th 免疫表位区出现变异可影响患者的细胞免疫功能[7]。HBV 变异可以自然产生,但大部分是由免疫压力所致[12]。我们的前期研究也证实:MHR 外变异主要出现在血清学转换后[10],而血清学转化主要发生在免疫清除期[13],由此推测:病毒在血清学转换过程中强大的免疫压力之下,HBV MHR 外区以及与位于该区域的CTL+Th 免疫表位区产生变异,导致细胞免疫逃逸,这可能是病毒再复制与感染持续的原因之一。国外研究报道多集中在对于HBV MHR 区域研究,认为该区域变异与疫苗免疫逃逸以及抗体检测逃逸有关[6],如T/I126/T/S/A 与疫苗免疫逃逸有关[14],并报道MHR 变异与基因型、病毒持续感染以及抗病毒治疗有关[15],而对于HBV S 蛋白尤其是MHR 外变异的研究非常少,目前未查见MHR 外变异与乙肝复发相关性报道。本研究并未发现T/I126/T/S/A位点与病毒再复制有关,而其它热点变异位点如L21S、F220L 与I68T/N 尚未见相关报道,这可能是由于这些位点位于MHR 外,而MHR 外区域的相关研究报道较少。

表4 两组HBV MHR 与MHR 外各区域变异热点位点比较[n(%)]Table 4 Comparison of HBV MHR and MHR variation hot spots in different regions between the two groups[n(%)]
综上所述,HBV S 蛋白的MHR 外区的CTL+Th 免疫表位区及非免疫表位区变异可增加HBeAg 阴性慢性乙型肝炎发生概率。但本研究所选取的患者与血清病毒滴度低于检测限者相比,复发概率相对较高,这也是本实验缺陷之处,值得临床重视并做进一步研究。
