老年血液循环因素对年轻小鼠椎间盘衰老表型的影响*
2021-04-24雷昌斌林宏生唐新文郭志文蔡永得
雷昌斌 林宏生 唐新文 郭志文 蔡永得 唐 光 王 东 王 炯△
(1 湘南学院附属医院(临床学院)临床医学研究中心,郴州423000;2 暨南大学第一附属医院骨科,广州510632 ;3 匹兹堡大学,弗格森实验室,Pittsburgh 匹兹堡15261)
随着人口老龄化进程,退变性疾病逐渐成为影响人们健康和生活水平的主要疾病[1]。腰痛也随之成为第二大常见病及多发病。据统计有超过80%的人一生中会出现过腰痛,是病人手术的第5 大病因[2]。而椎间盘退变 (intervertebral disc degeneration, IDD)是引起腰痛的主要病因,造成了重大的社会经济和医疗负担[3]。椎间盘退变可由衰老、氧化应激、炎症、DNA 损伤、生物力学改变及全身因素、吸烟、肥胖等引起,其中衰老是引起椎间盘退变的最重要因素[4,5]。椎间盘既坚韧又富有弹性,具有缓冲脊柱受压和冲击的作用。椎间盘是人体最大的没有血液供应的器官,内部髓核营养物质及代谢产物,主要通过上下终板及纤维环的外1/3 毛细血管的渗透作用[4]。衰老的椎间盘包括脱水、纤维化、裂隙,椎间盘高度降低等改变,容易造成纤维环破裂、髓核突出[6]。目前的治疗和研究都集中在椎间盘局部因素使椎间盘细胞损伤、细胞基质损失,导致椎间盘细胞死亡或衰老[7]。也有少量研究证实椎间盘外因素如骨质疏松和血管硬化症[8]、肌营养不良[9]等可以加速椎间盘退变。但是尚无血液循环因素对椎间盘退变的影响研究。
异时联体共生模型 (heterochronic parabiosis model)通过将年轻和年老个体的皮肤及软组织相连,使个体间毛细血管融合达到血液和代谢产物交换的目的,距今已有150 多年的历史[10]。联体共生模型有在肿瘤、移植、免疫耐受方面的应用,但直到20 世纪中后叶才开始在衰老研究中应用。Loffredo 等[11]报道异时联体共生模型通过血液交换,年轻小鼠血液中生长分化因子11 (growth differentiation factor 11, GDF11)蛋白可以逆转年老小鼠心肌细胞衰老肥大。本研究团队的前期实验也证实异时联体共生模型血液循环因素可以影响脊柱椎旁肌肉组织的衰老退变[12]。椎间盘是人体最大的缺少血液供应器官,营养物质仅通过上下椎板及外围纤维环渗透吸收。联体共生模型能否通过血液循环因素影响缺少血液供应的椎间盘组织的衰老退变?因此,我们假设老年小鼠血液循环因素可以加速年轻小鼠椎间盘衰老退变。本研究通过建立小鼠异时联体共生模型,对比同时联体(isochronic parabiosis) 共生模型,评估血液循环因素对小鼠脊柱椎间盘退变的影响,探讨其作用机制,为重新认识椎间盘衰老的原因并探索新的治疗思路提供理论基础。
方 法
1.试剂与仪器
培养基:90% DMEM/F-12(1X)(Life Technologies 公司,美国);10% 胎牛血清 (Fetal Bovine Serum, FBS)(ATLANTA 公司,美国)。抗体:p16、p21、ADAMTS4、MMP13 (abcam 公司,美国),LC3(Thermo 公司,美国)。DAPI:(4', 6-diamidino-2-phenylindole) 即4', 6-二脒基-2-苯基吲哚,规格:2 ml;型号:P36935(Invitrogen 公司,美国)。Quant-iT PicoGreen ds DNA 试 剂 盒(Invitrogen 公司,美国);流式细胞仪:2030 Multilabel Reader VicToR X3(PerkinElmer 公司,美国)。聚偏二氟乙烯膜(poly vinyli⁃dene difluoride, PVDF, Bio-Rad公司,美国),Western Blot 仪器:(Bio-RAD 公司,美国)。清洁操作台、病理切片机及荧光显微镜(Nikon Eclipse Ts100; Nikon 公司,美国)。
2.实验动物
实验通过动物伦理委员会审查和审批,并严格遵守国家卫生和医学研究委员会对实验动物护理和管理的相关指南。选用C57BL/6J 野生型雌性小鼠,其中年轻小鼠选择3 个月龄,年老小鼠选18 个月龄,对体重无明显限制。联体手术后按标准条件下每对联体小鼠单笼饲养,给予充足的食物和水,并注意消毒和使用抗生素预防联体病。
3.动物模型的建立和分组
将年轻和年老的小鼠异时联体 (heterochronic parabiosis, Y-O),年轻和年轻小鼠同时联体 (isochronic parabiosis, Y-Y),年老的和年老的小鼠同时联体 (isochronic parabiosis, O-O),分别联体融合8周。术前进行1 周的适应治疗,并注意做好小鼠保温及清洁消毒,手术从一侧小鼠上肢肘关节沿腹部到下肢膝关节处切开皮肤,从筋膜层分离皮瓣,为了增大血液交流面积将皮肤及部分腹膜融合,后者注意连续缝合。麻醉苏醒后检测,可将小鼠放置37℃温箱有助于小鼠体温调节恢复。每个笼子只能饲养一对共生小鼠,提供充足的水及食物。术后24 h 从尾部静脉注射Evan blue 染料检测联体小鼠是否共享血液循环。文献报道异时联体2 周后,两个不同个体的血液循环可达到动态平衡。联体8 周后处死小鼠,解剖小鼠脊柱椎间盘组织检测。
4.组织H&E 染色及免疫荧光染色
取各组脊柱腰椎 (L5-6) 功能单位 (functional spine unit, FSU),FSU 一侧尽量靠近终板避免破坏椎间盘组织,另一侧保留2 mm 骨组织便于后期包埋操作。将FSU 浸泡在2%多聚甲醛中24 h,用1%PBS 清洗2 遍后加入70%酒精继续浸泡24 h,后用石蜡包埋及切片,进行标准H&E 染色和组织免疫染色(LC3)。
5.组织免疫荧光 (immunofluorescence, IF)
解剖脊柱腰椎 (L1-L4) 椎体功能单位,将FSU 浸泡于2%的多聚甲醛中过夜,取出后用1%PBS 冲洗3 次,将冲洗后FSU 浸泡在30%的蔗糖溶液中放置4℃房间过夜。取出FSU 用包埋剂 (optimum cutting temperature, OCT) 包埋(注意将保留骨组织的一端朝上),放置-80℃冰箱1 天后冰冻切片,组织厚度设定为7 μm,切片需要包括纤维环组织及内部髓核组织。贴片后的载玻片放入1% PBS 液5 min洗3 次,封闭1 h 后加入150 μl 一抗(aggrecan 1:200稀释) 避光过夜。第2 天用PBS 液洗5 次,再加入二抗150 μl (抗体按1:500 稀释),再次用1%PBS液洗5 次后加入DAPI 染色盖上盖玻片,注意避光孵育。样本使用尼康荧光显微镜读片,使用相同的设置和曝光时间获取不同组别的图像并进行等效处理。
6.蛋白印痕检测 (Western blot analysis)
解剖提取颈椎和胸椎椎间盘组织,称重后按1 g:10 ml 加入蛋白裂解液,提取各样本组织蛋白,平衡蛋白浓度后每孔加入30 μg 蛋白量,使用4%~20%聚丙烯酰胺凝胶跑胶,之后用PVDF 转膜。室温下在5%的脱脂牛奶封闭1 h。分别加入一抗P16、P21、MMP13、ADAMTS4(1:1000 稀释)在4℃摇摆平台上过夜。第2天用TBS-T缓冲液清洗3遍PVDF膜,每次10 min,之后在室温下加入二抗(1:1 0000 稀释)并避光摇晃1 h。后再用PBS-T 洗涤3 次,使用奥德赛成像仪以化学显色蛋白质条带,并且通过使用仪上的软件进行定量分析。
7. RT-qPCR 检测RNA 表达
解剖提取腰椎L1-L3椎间盘组织后,用Trizol法提取组织总RNA 并进行逆转录。按照预先设定的热学过程: 95℃预变性 10 min,95℃变性 15 s,58℃退火30 s,62℃延伸1 min,50 个循环,保存设置。用 GAPDH 作为内参使基因表达标准化。每个样品做 2 个复孔。系统自动绘制扩增曲线和熔解曲线,并采集CT 值。引物序列(5'-3'):GAPDH 上游引物,GGTTGTCTCCTGCGACTTCA;下游引物,TGGTCCAGGGTTTCTTACTCC。P16 上游引物,AATCTCCGCGAGGAAAGC;下游引物,GTCTGCAGCGGACTCCAT。P21 上游引物,GGAGACTCTCAGGGTCGAAA;下游引物,GGATTAGGGCTTCCTCTTGG。MMP13 上游引物,TCCCTGCCCCTTCCCTATGGT;下游引物,CTCGGAGCCTGTCAACTGTGGA。ADAMTS4 上游引物,ATGGCTATGGGCACTGTCTC;下游引物,GTGTTTGGTCTGGCACATGG。
8.统计学分析
实验结果采用Shapiro-Wilk 检验法进行正态性检验。实验结果的统计学分析采用4 组独立实验数据的平均值,将所有回收的资料统一编号后,采用Graphpad Prism 7.03 统计软件包对数据进行统计描述和统计分析。对于双变量非参数数据,采用Mann-Whitney 检验,用Bonferroni 校正方差分析对多个实验组的数据进行多重比较。P值取双侧概率,进行统计描述和统计推断,P< 0.05 为差异有统计学意义。
结 果
1. H&E 染色及免疫组化染色
实验结果显示,从阴性对照组Y-Y 中可观察到健康的椎间盘组织H&E 染色后可见:椎间盘纤维环结构完整,纤维环及髓核组织没有裂痕,纤维环及髓核分界清楚,髓核组织含大量髓核细胞,基质完整;Y-O 组H&E 染色可见:纤维环基质结构破损并出现裂痕,纤维环及髓核分界不清,髓核细胞数相比Y-Y 组明显减少,O-O 组H&E 染色可见:髓核细胞大量消失,纤维环及髓核基质出现大量裂痕(见图1)。
2.组织免疫荧光IF 检测aggrecan 表达
IF 检测Y-O 组年轻小鼠aggrecan 含量较Y-Y组年轻小鼠减少了20.1%±3.2%,IF 检测O-O 组椎间盘组织aggrecan 含量较Y-Y 组下降23.9%±3.7%(P< 0.05,见图2)。
3.衰老基因表达的差异性
本研究检测特异性基因P21 及P16 蛋白表达和RNA 转录的差异性。Western Blot 检测显示:Y-O组P16 蛋白表达较Y-Y 组升高77.1±20.5%,O-O 组P16蛋白表达较Y-Y组升高206.7±53.5% (P< 0.05)。Y-O 组P21 蛋白表达比Y-Y 组有升高趋势,但无明显统计学差异。RT-qPCR 检测P16 基因异时联体后有升高的趋势但组间无统计学差异。RT-qPCR 检测P21 基因三组的表达分别为Y-Y:1±0、Y-O:1.405±0.067、O-O:1.955±0.242,组间比较有统计学差异(P< 0.05,见图3)。
4.椎间盘组织金属蛋白酶表达差异性
实验数据显示,MMP13 蛋白表达及mRNA 基因检测均是Y-O 组较Y-Y 组升高,MMP13 蛋白表达量O-O 组较年轻小鼠Y-Y 组升高,组间有统计学差异(P< 0.05)。Western Blot 检测椎间盘基质代谢产物ADAMTS4 蛋白表达分别为Y-Y:1±0、Y-O:1.331±0.085、O-O:2.690±0.324,Y-O 及O-O 组明显升高,与Y-Y 组比较有明显统计学差异(P<0.05)。RT-qPCR 检 测ADAMTS4 基 因 表 达Y-O 组比Y-Y 组升高33.5±22.6%,但无统计学意义(P>0.05),O-O 组与Y-Y 组比较明显升高,组间比较有统计学差异(P< 0.05,见图4)。
讨 论
联体共生模型 (parabiosis model) 早在150 年前就已建立,通过两个独立的个体血液融合对免疫、移植、肿瘤、衰老等进行研究[10,13,14]。异时联体共生模型使年轻和年老个体血液嵌合,从而达到体内营养物质和代谢产物的交换,改变细胞所处的外环境[15]。Sinha 等[16]通过对小鼠联体共生模型研究发现全身血液环境中的GDF11 水平的增加可以改善肌肉结构和功能,逆转肌肉衰老。Yamasaki 等[17]使用联体共生模型研究外周血细胞 (peripheral blood cells, PBCs) 对同样缺少血液供应的关节软骨的影响研究,发现PBCs 可以修复早期关节软骨损伤,逆转关节软骨退变。本实验通过建立小鼠同时和异时联体模型,证实椎间盘的衰老不仅受椎间盘局部因素的影响,血液循环因素也可以影响椎间盘组织的衰老退变。

图1 小鼠腰椎间盘组织石蜡切片H&E 染色及免疫组化染色小鼠腰椎间盘组织石蜡切H&E 染色Y-Y 组纤维环及髓核结构完整,无裂痕,分界清楚,内部髓核基质完整,有大量的髓核细胞;Y-O 组可见纤维环与髓核交界处分界不清,髓核基质部分裂缝(红色箭头),内部髓核细胞明显较Y-Y 组减少;O-O 组可见髓核细胞减少(红色三角符号),基质周围出现裂缝(红色箭头) 标尺 = 200 μmFig. 1 Impact of circulatory factors from aged mice on gross disc morphology H&E staining of lumbar disc was performed to assess the gross morphological changes with aging. In Y-Y group, the structure of AF and NP was intact, without cracks, and the boundary was clear. There were a lot of NP cells in the inner NP matrix; In the Y-O group, the junction between the AF and NP was not clear, and part of the NP matrix was cracked (red arrow), and the number of NP cells in the Y-O group was significantly less than that in the Y-Y group; In O-O group, the number of NP cells decreased (red triangle symbol), and cracks around the matrix (red arrow). Scale bar = 200 μm

图 2 血液循环因素对年轻小鼠椎间盘aggrecan 蛋白表达的影响(n = 4)红色为aggrecan 染色,蓝色为细胞核DAPI 染色,可见Y-Y 组红色aggrecan 明显较Y-O 及O-O 组多,定量分析显示各组间有明显差异,所示数据为四组独立实验(±SD)。*P < 0.05Fig. 2 Effects of circulatory factors from aged mice on aggrecan protein expression in intervertebral discs in mouse heterochronic parabionts (n = 4)Red is aggrecan staining, blue is DAPI staining. It can be seen that red aggrecan in Y-Y group is significantly more than that in Y-O and O-O groups. Quantitative analysis shows that there are significant differences among the groups. Data shown are ±SD of 4 independent experiments, *P < 0.05.
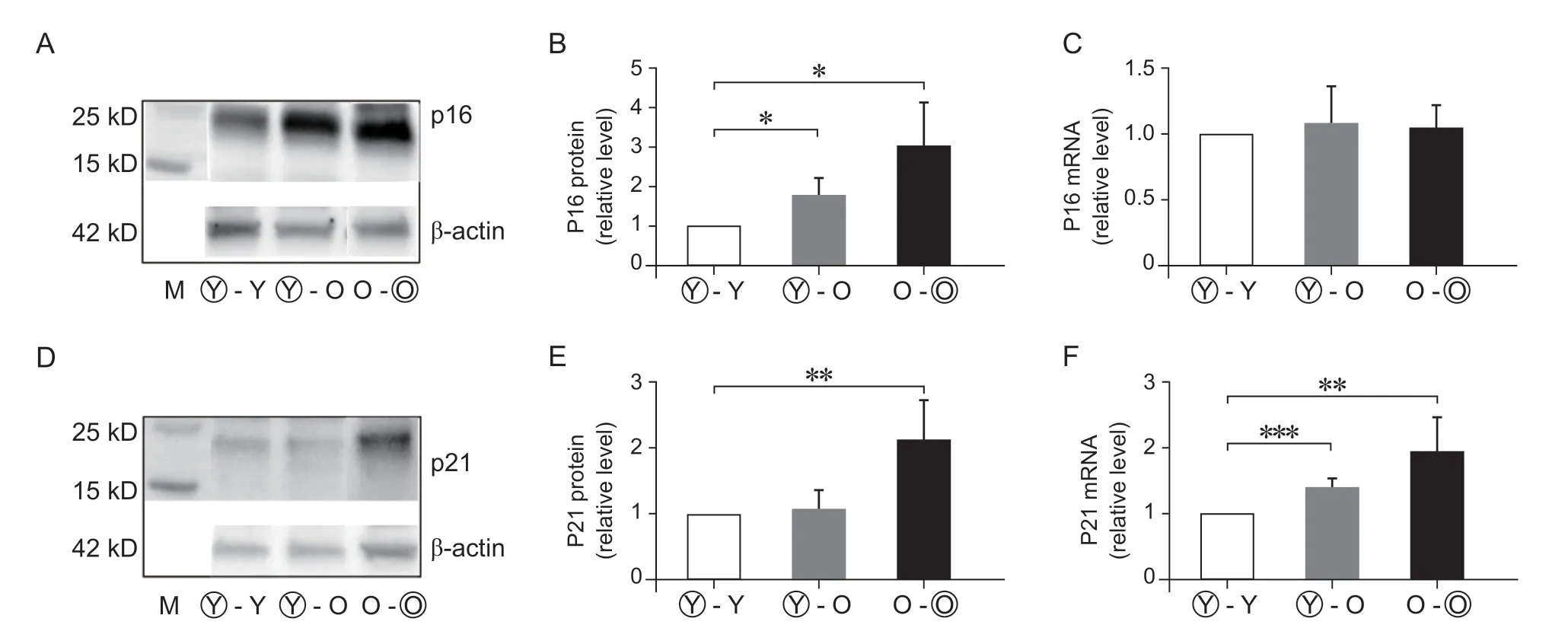
图3 血液循环因素对小鼠异时联体椎间盘衰老基因蛋白和基因表达的影响 (n = 4)(A) Western Blot 检测结果显示Y-O 及O-O 组衰老基因P16 表达量较Y-Y 组升高;(B) P16 蛋白表达量Western Blot 定量分析结果;(C) P16 基因RT-qPCR 定量检测结果;(D) Western Blot 检测结果显示O-O 组衰老基因P21 表达量较Y-Y 组明显升高;(E) P21 蛋白表达量Western Blot 定量分析结果,Y-O 组较Y-Y 组升高不明显;(F) P21基因RT-qPCR 定量检测结果,Y-O 及O-O 组表达量较Y-Y 组明显升高。*P < 0.05,**P < 0.01,*** P <0.001Fig. 3 Effects of circulatory factors from aged mice on expression of cellular senescence markers in IVDs in mouse heterochronic parabiotants (n = 4)(A) The expression of P16 was detected by Western blot; (B) P16 in Y-O and O-O groups was higher than that in Y-Y group; (C)P16 gene was detected by RT-qPCR; (D) The expression of P21 was detected by Western blot; (E) Western blot analysis showed that the expression of P21 protein in Y-O group was not signifciantly higher than that in Y-Y group; (F) The expression of P21 gene in Y-O and O-O groups was signifciantly higher than that in Y-Y group. *P < 0.05, **P < 0.01, ***P < 0.001.
1.老年血液循环因素对椎间盘组织形态的影响
本研究中通过异时联体,椎间盘组织石蜡切片H&E 染色见,通过老年小鼠血液环境的影响年轻小鼠椎间盘组织中央的髓核细胞明显减少,并且纤维环组织出现裂痕,纤维环及髓核交界处分界不清楚。Isaac 等[9]对杜氏肌营养不良症 (duchenne muscular dystrophy, DMD) 模型研究中发现,肌肉组织的退化可以加速脊柱椎间盘组织的退变。这些都证明椎间盘外的因素可以影响椎间盘组织和细胞的衰老退变。Smith 等[18]报道衰老的系统环境中免疫相关分子和细胞变化可以负向调节细胞的形成和分化。

图 4 血液循环对小鼠异时联体椎间盘分解代谢蛋白和基因表达的影响(n = 4)(A) Western Blot 检测各组MMP13 蛋白印痕结果;(B) MMP13 蛋白表达量Western Blot 定量分析结果;(C)MMP13 基因RT-qPCR 定量检测结果;(D) Western Blot 检测各组ADAMTS4 蛋白印痕结果;(E) ADAMTS4 蛋白表达量Western Blot 定量分析结果;(F) ADAMTS4 基因RT-qPCR 定量检测结果。*P < 0.05Fig. 4 Effects of circulatory factors from aged mice on catabolic gene expression in intervertebral discs obtained from mouse heterochronic parabionts (n = 4)(A) MMP13 protein was detected by Western blot; (B) The expression of MMP13 protein was analyzed by Western blot;(C) MMP13 gene was detected by RT-qPCR; (D) ADAMTS4 protein was detected by Western blot; (E) The expression of ADAMTS4 protein was analyzed by Western blot; (F) ADAMTS4 gene was detected by RT-qPCR. *P < 0.05.
2.老年血液循环因素对椎间盘细胞衰老基因表达的影响
文献报道,椎间盘衰老细胞 (senescent cells,SnCs) 可以引起细胞DNA 损伤、炎症反应、造成细胞基质分解代谢和合成代谢失平衡等加速细胞衰老退变[19]。其中P53-P21-Rb 和P16-Rb 信号通路被激活,是调控细胞衰老的重要通路[20]。衰老细胞内P53-P21-Rb 和P16-Rb 信号通路被激活,导致细胞复制停止在G1 期和抑制CDK4、CDK6 导致Rb 和Hb 的低磷酸化状态引起细胞衰老。Liu 等[21]Western Blot 检测小鼠异时联体共生年轻与年老小鼠联体后肾脏组织中P16 蛋白表达量比年轻与年轻小鼠同时联体时升高。本研究RT-qPCR 检测发现老年小鼠椎间盘组织mRNA 中衰老基因P16 及P21 基因的表达较年轻小鼠明显升高。异时联体共生组 (Y-O)椎间盘组织P16、P21 的蛋白表达明显较同时联体共生组 (Y-Y) 升高,与文献报道一致。因此,异时联体共生,老年小鼠血液环境可以加速衰老基因的表达。
3.老年血液循环因素对椎间盘组织基质代谢的影响
椎间盘 (intervertebral disc, IVD) 主要由上下椎板、外围纤维环及内部髓核组成,其主要成分为糖胺聚糖 (glycosaminoglycans, GAG)、I 和II 型胶原蛋白 (collagen) 及聚蛋白多糖 (proteoglycan) 为基础组成[22]。聚糖蛋白聚糖 (aggrecan)是椎间盘组织基质的重要成分,随着椎间盘衰老会出现纤维化、蛋白水解及水分含量下降导致aggrecan 含量减少[23]。本研究IF 检测异时联体后Y-O 组椎间盘中aggrecan 含量较Y-Y 组减少,导致椎间盘基质含水量减少、弹性下降,加速细胞凋亡。金属蛋白酶与肿瘤细胞迁移、细胞外基质降解和细胞凋亡相关,椎间盘组织衰老与金属蛋白酶MMP13、ADAMTS4表达呈正相关。与此同时金属蛋白酶MMP13 及ADAMTS4 可以加快细胞外基质降解,ADAMTS4可以酶切aggrecan 多个结合位点,降解蛋白多糖核心结构[24]。异时联体共生老年血液循环因素可以使年轻小鼠椎间盘MMP13、ADAMTS4蛋白表达升高,促进年轻小鼠椎间盘组织老化,但其具体机制仍需要进一步研究。
综上所述,异时联体共生模型通过血液循环因素,可以影响小鼠脊柱椎间盘组织的衰老退变,老年小鼠血液循环因素可以加速年轻小鼠椎间盘组织衰老。全身血液环境通过椎间盘组织营养物质吸收与交换,调控椎间盘外周基质的分解与合成代谢的平衡、促进自噬、氧自由基清除及干细胞修复等方面影响脊柱椎间盘组织的衰老进程。因此,在治疗椎间盘退变的同时不仅需要考虑椎间盘局部因素,也需要考虑全身血液循环因素对椎间盘组织的影响。另外,需要进一步研究血液循环因素影响脊柱椎间盘衰老的作用机制及具体通路的分子调控关系。
