新型口服纳米胶束跨膜转运机制研究Δ
2021-04-23陶小妹隋航烁王淑梅马英杰
陶小妹,赵 雪,隋航烁,王淑梅,马英杰#
(1.首都医科大学附属北京世纪坛医院药剂科,北京100038; 2.临床合理用药评价北京市重点实验室,北京 100038; 3.北大医疗鲁中医院临床营养科,山东 淄博 255400; 4.承德市中心医院临床营养科,河北 承德 067000)
通过纳米载体改善药物输送是近年来的研究热点。了解纳米载体与细胞的相互作用,包括其跨细胞行为,对于口服纳米药物递送系统的设计以及潜在纳米材料的安全性研究都是至关重要的。迄今为止,大多数研究都集中在纳米载体而非口服途径的跨膜转运。关于纳米载体口服途径的跨膜转运机制研究较少。聚乙二醇-二硬脂酰磷脂酰乙醇胺(PEG-DSPE)通常用于制备脂质体。近年来发现PEG-DSPE可单独制备成胶束,用来递送小分子抗肿瘤药和难溶性药物。聚合物胶束由于具有增溶性、高稳定性、良好的生物相容性、高负载能力、长循环、选择性靶向以及可以改变所包载药物的内化途径和亚细胞定位特性,因此显示出了巨大的药物输送潜力[1-3]。
MDCK细胞是马丁达比犬的肾近区小管上皮细胞,其和Caco-2细胞是目前用于体外跨膜转运研究的两个最主要的单层细胞模型[4-5]。本研究选择MDCK细胞作为上皮细胞模型,探讨PEG-DSPE胶束的口服跨膜转运机制。
1 材料
1.1 仪器
Nano ZS型激光粒度测定仪(英国Malvern instruments公司);HH-1型数显恒温水浴锅(国华电器有限公司);昆山舒美KQ-100DB型超声波清洗仪(昆山市超声仪器有限公司);BSA223S型电子分析天平(德国sartorius公司);TG-16W型高速离心机(山东博科公司);MERS00002型跨膜电阻测定仪(美国Millipre公司);伯乐680型酶标仪(美国Biorad公司);TCS SP5型激光共聚焦扫描显微镜(德国Leica公司)。
1.2 试剂
mPEG2000-DSPE(日本油脂株式会社);香豆素6(美国Sigma-Aldrich公司),DMEM高糖培养基、胎牛血清(美国Life Technologies 公司),Hoechst 33258、罗丹明-鬼笔环肽(美国Molecular Probes公司),100 U/ml青霉素、100 μg/ml链霉素及0.25%胰蛋白酶/0.02%乙二胺四乙酸(EDTA)(北京迈晨生物科技有限公司);氯丙嗪、蔗糖、阿米洛利、氯丙嗪及甲基-β-环糊精(美国Sigma-Aldrich公司),Transwell(12孔,孔径3 μm,聚碳酸酯膜,美国Corning Costar公司),BCA蛋白定量试剂盒(普利莱公司);其余试剂均为分析纯,购自国药集团化学试剂有限公司。
1.3 细胞
犬肾小管细胞株MDCK (中国医学科学院细胞中心)。培养液为DMEM高糖培养液,含10%胎牛血清、1%的青霉素和1%的链霉素。培养于37 ℃、相对湿度为95%,CO2含量为5%的细胞培养箱中,隔日更换细胞培养液。
2 方法
2.1 PEG-DSPE胶束的制备
采用薄膜水化法制备PEG-DSPE胶束。将PEG-DSPE溶解于乙腈中,在40 ℃的真空旋转条件下蒸发,以除去乙腈,得到一层薄薄的均匀薄膜。然后将聚合物薄膜在40 ℃的蒸馏水中超声处理5 min,使其水合。冷却至室温(25 ℃)后,获得澄清的胶束溶液。最后,将溶液通过0.22 μm的膜过滤。
2.2 载有香豆素6的PEG-DSPE胶束(C6-PD)的制备
将香豆素6添加到聚合物乙腈溶液中。其他步骤与制备空白胶束的步骤相同。在负载有香豆素6的胶束中,香豆素6与聚合物的质量比为1∶1 000。
2.3 载有C6-PD胶束的表征
使用激光粒度分布仪在25 ℃下通过动态光散射分析对C6-PD的大小和Zeta电位进行表征。为测定C6-PD的包封率,以10 000 r/min离心10 min,除去未溶解的香豆素6,将胶束溶解在甲醇中,测定包载的香豆素6含量。包封率(%)=(包封于胶束中的香豆素6/胶束制备时加入的香豆素6量)×100%。胶束体外泄露实验,使用透析袋(截留分子量为14 000 Da)装载C6-PD后,置于无血清的培养基(pH=7.4),37 ℃、100 r/min下培养,不同时间点取样测定。
2.4 细胞内香豆素6含量定量检测方法
香豆素6可以自发荧光,可用荧光分析法进行检测。建立定量检测细胞中香豆素6的荧光分析方法。取空白细胞裂解液100 μl置于1.5 ml离心管中,加入甲醇配制的系类标准溶液100 μl,涡旋1 min后,以14 000 r/min离心10 min,取100 μl上清液用酶标仪进行检测,激发波长为467 nm,发射波长为502 nm,并绘制标准曲线。样品前处理类似,取细胞样品100 μl置于1.5 ml离心管中,加入甲醇溶液100 μl,涡旋1 min后,以1 400 r/min离心10 min,取上清液100 μl进行分析。
2.5 MDCK细胞对C6-PD胶束的摄取
2.5.1 BCA法定量检测蛋白含量:使用BCA蛋白定量试剂盒检测细胞的蛋白浓度。根据试剂盒说明配制BCA工作液。用PBS缓冲液逐级稀释蛋白标准品为系列梯度的标准溶液。将BCA工作液与不同浓度的蛋白标准溶液混合,37 ℃水浴加热30 min,用酶标仪在540 nm波长处测定样品吸光度,绘制标准曲线,并计算细胞裂解液样品的蛋白浓度。
2.5.2 激光共聚焦显微镜对C6-PD进行定性分析:为验证C6-PD能否被细胞摄取,本研究采用共聚焦显微镜对C6-PD摄取进行定性研究。将C6-PD加入合格的MDCK单层细胞中进行孵育,同时计时。以空白DMEM培养基处理的细胞作为阴性对照。在共聚焦显微镜下进行荧光检测,选择的激发波长为香豆素6激发/发射波长(Ex/Em=488/502 nm),观察香豆素6绿色激发光的强度。
2.5.3 MDCK细胞对C6-PD表面吸附作用的定量分析:为定量分析C6-PD在MDCK细胞单层表面的吸附作用,采用荧光分析法测定荧光标记的PEG-DSPE胶束的表面吸附及摄取量的差异。
将MDCK细胞以1×106/ml培养于12孔板中。待细胞汇合后,用PBS洗涤细胞2~3次,再于孔板中加入制备好的C6-PD,在37 ℃条件下孵育10、30、60、90及120 min。孵育时间结束后,一组使用冰冷的PBS清洗细胞单层3次,1次3 min,以保证充分洗去细胞表面所吸附的胶束,之后加入胰酶/EDTA将MDCK细胞消化并吹打成单细胞悬液,重新将细胞离心并使用PBS洗涤细胞悬液3次,洗去悬浮的单细胞上吸附的胶束,最后以1 000 r/min离心细胞悬液5 min获取细胞沉淀,除去上清液,加入RIPA细胞裂解液于4 ℃条件下裂解细胞30 min以释放胞内胶束。此时裂解液中所含胶束的浓度即为经MDCK细胞摄取入胞的胶束的浓度。
另一组吸去MDCK细胞单层表面的胶束,不进行消化细胞的步骤,直接加入RIPA裂解细胞以释放胞内胶束。采用这种方法所得到的胶束的浓度为MDCK细胞对胶束的摄取量以及细胞单层表面及细胞间对C6-PD的吸附量之和。
对于采用上述两种方法得到的细胞裂解液,加入甲醇沉淀蛋白,室温下于黑暗处振摇12 h后以14 000 r/min离心10 min,取上清液进行香豆素6荧光分析。测定香豆素6浓度,同时对每管的细胞裂解液利用BCA蛋白定量试剂盒分别进行蛋白浓度测定。
2.6 C6-PD的跨膜转运机制研究
口服跨膜转运主要指肠上皮细胞的转运。分子可以通过两种途径在肠上皮细胞转运,即细胞旁转运和跨细胞转运。
细胞旁途径指通过打开胃肠道上皮细胞间的紧密连接来进行转运。细胞旁间隙占黏膜表面积的比例<1%,并且紧密连接的孔径<10 Å。因此,口服跨膜转运还是以跨细胞转运为主。在跨细胞途径中,上皮细胞对纳米颗粒的摄取有吸附、融合、膜间转运和内吞等方式,其中,内吞被认为是纳米粒子跨细胞转运的主要机制[6-8]。通常纳米载体首先被膜侵入,并形成内体。然后,内体将纳米载体递送至各种细胞器内,例如溶酶体、高尔基体和内质网,或再循环至细胞外环境或跨细胞递送(转胞吞作用)[9-11]。
2.6.1 不同内吞抑制剂的作用:内吞被认为是纳米粒子跨细胞转运的主要机制,包括巨胞饮作用、网格蛋白介导的内吞作用、小窝蛋白介导的内吞作用、非网格蛋白和小窝蛋白介导的内吞作用。通过加入不同内吞抑制剂可以分析C6-PD的具体内吞机制[12-15]。内吞实验中所用药物抑制剂的作用和浓度见表1。

表1 内吞实验中所用药物抑制剂的作用和浓度Tab 1 Effect and concentration of drug inhibitor used in the endocytosis experiment
(1)定量分析。37 ℃下,将内吞抑制剂与MDCK细胞共同孵育30 min,然后添加C6-PD后再孵育1 h。用荧光分析法测定细胞裂解液中所含胶束的浓度。
(2)定性分析。37 ℃下,将内吞抑制剂与MDCK细胞共同孵育30 min,然后添加C6-PD后再孵育1 h。孵育时间结束后,细胞用3.7%的多聚甲醛固定后,分别用Hoechst33258和罗丹明-鬼笔环肽与细胞孵育,以标记细胞核(蓝色荧光)和微丝(红色荧光),在激光共聚焦显微镜下观察细胞的染色情况。
2.6.2 温度对跨细胞膜转运的影响:低温会抑制能量代谢过程。为考察C6-PD的细胞摄取是否为能量依赖的过程,将MDCK细胞分为两组,一组在37 ℃条件下孵育1 h,另一组在4 ℃条件下孵育1 h。定量检测两种温度下MDCK细胞对C6-PD的摄取量的差异。
2.7 统计学方法
3 结果与讨论
3.1 载有C6-PD的表征
通过动态光散射分析确定的无血清培养基中C6-PD的典型粒径见图1。3次测定后的平均粒径为(21.7±1.7)nm,Zeta电位几乎是中性的,包封率为(92.4±1.43)%,见表2。12 h内,香豆素6泄漏总量<5%,见图2。也就是说,在接触细胞之前,几乎没有香豆素6泄漏,这表明香豆素6的行为可以代表PEG-DSPE胶束的行为。

图1 C6-PD的粒径分布图Fig 1 Particle size distribution of C6-PD

表2 C6-PD的表征Tab 2 Characterization of

图2 pH 7.4条件下C6-PD的释放曲线(n=3)Fig 2 Leakage of C6-PD under pH 7.4 condition (n=3)
3.2 MDCK细胞对C6-PD胶束的摄取
3.2.1 细胞内香豆素6含量及蛋白浓度定量检测方法:以香豆素6的质量浓度(ng/ml)为横坐标(x),以香豆素6的荧光强度为纵坐标(y),以加权最小二乘法进行回归,得到标准曲线方程为y=0.136 4x-0.029 9,R2=0.999 6,检测范围为1~1 000 ng/ml。以蛋白浓度(ng/ml)为横坐标(x),以吸光度为纵坐标(y),以加权最小二乘法进行回归,得到标准曲线方程为y=0.000 4x+0.102 1,R2=0.999 0,检测范围为8~320 μg/ml。可用于后续对细胞蛋白进行定量分析。
3.2.2 激光共聚焦显微镜对C6-PD进行定性分析:当C6-PD加入到MDCK单层细胞上后,可以在激光共聚焦显微镜下观察到胶束立刻被摄取,在120 s时细胞内的绿色荧光强度几乎达到饱和,见图3。采用两种方法处理MDCK细胞后所得到的荧光强度百分比,见图4。由图4可见,在0~120 min范围内,由细胞单层、细胞间连接吸附的胶束和内吞胶束总量均高于同时间点下MDCK细胞对胶束的内吞量。表明细胞表面确实对C6-PD存在吸附效应。同时也可以看到,在加入C6-PD 10 min时,便有大量的胶束聚集在细胞表面,随着孵育时间的延长,部分表面的胶束被内吞入胞,在90 min和120 min时,表面吸附的胶束量与内吞的胶束量趋于动态平衡,说明吸附量会随着孵育时间的延长逐渐达到饱和。

A.10 s;B.60 s;C.120 sA.10 s;B.60 s;C.120 s图3 激光共聚焦显微镜观察MDCK细胞对C6-PD的摄取(标尺=25 μm)Fig 3 Uptake of C6-PD by MDCK cells by laser confocal microscopy (Bar=25 μm)
3.2.3 MDCK细胞对C6-PD表面吸附作用的定量分析:结果见图4。

图4 MDCK单层细胞对C6-PD摄取的定量分析(n=3)Fig 4 Quantitative analysis of C6-PD uptake by MDCK monolayer cells(n=3)
3.3 C6-PD的跨膜转运机制研究
3.3.1 不同内吞抑制剂的作用:细胞膜上富含鞘磷脂和胆固醇的区域称为脂筏结构,脂筏结构包含小窝,而制霉菌素可以抑制小窝蛋白的形成,甲基-β-环糊精可以有效螯合细胞膜上的胆固醇,进而抑制小窝蛋白介导的内吞。盐酸氯丙嗪和高渗蔗糖可以抑制细胞膜上网格蛋白的组装,进而抑制网格蛋白介导的内吞。盐酸阿米洛利可以抑制巨胞饮作用。
转胞吞作用的过程包括膜的内陷、囊泡出芽以及囊泡向细胞的相对侧移动,其摄取取决于所涉及的内吞作用类型,即巨胞饮作用、网格蛋白介导的内吞作用、小窝介导的内吞作用以及小窝和网格蛋白非依赖性内吞作用。如表1所列,使用了网格蛋白介导的内吞作用抑制剂(氯丙嗪和高渗蔗糖)、巨胞饮作用抑制剂(阿米洛利)和小窝蛋白介导的内吞作用抑制剂(甲基-β-环糊精和制霉菌素)。37 ℃下MDCK细胞在不同内吞抑制剂作用1 h下对C6-PD的摄取见图5。图5中的数据提示,对C6-PD细胞内吞作用最有效的抑制剂是甲基-β-环糊精(降低88.1%,P<0.01),其次是高渗蔗糖(降低44.1%,P<0.01)、制霉菌素(降低27.9%,P<0.01)和氯丙嗪(降低29.4%,P<0.01)。与对照组相比,阿米洛利的差异无统计学意义(P>0.05)。在甲基-β-环糊精处理后,C6-PD几乎没有被内化到细胞中,而是剩余完整性的细胞骨架,见图6。
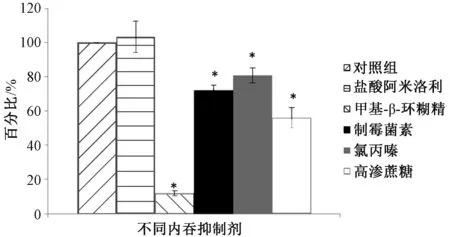
与对照组比较,*P<0.01vs. the control group, *P<0.01图5 37 ℃下MDCK细胞在不同内吞抑制剂作用1 h下对C6-PD的摄取(n=3)Fig 5 Uptake of C6-PDs by MDCK cells in the presence of different inhibitors at 37 ℃ for 1 h (n=3)
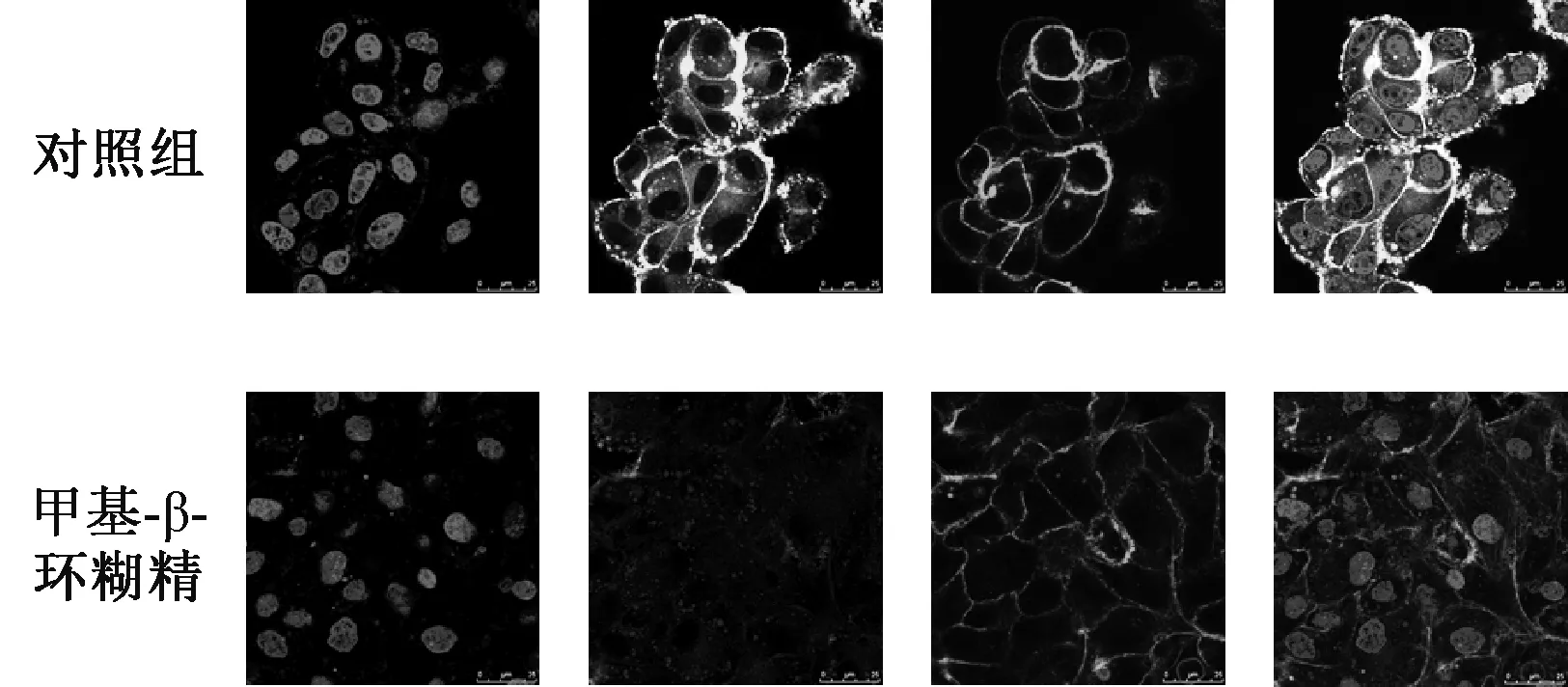
图6 37 ℃下,用或不用MβCD处理1 h后,共聚焦显微镜下MDCK细胞对C6-PD的摄取图像(标尺=25 μm)Fig 6 Confocal images of MDCK cells treated with or without MβCD at 37 ℃ for 1 h (Bar=25 μm)
甲基-β-环糊精对C6-PD吸收的抑制作用很快发生,并且在1 h内抑制了超过85%的内吞作用。胆固醇属于非极性疏水化合物,甲基-β-环糊精的疏水性空腔与胆固醇的分子结构相适宜,因此,甲基-β-环糊精可以与胆固醇螯合在一起。为了排除甲基-β-环糊精的任何药物特异性作用,使用了另一种抑制剂制霉菌素,该抑制剂可以与胆固醇结合并通过直接插入膜将胆固醇螯合为复合物来破坏脂质筏。文献报道,通过对胆固醇的螯合作用可以有效阻止小窝蛋白介导的内吞作用[16]。甲基-β-环糊精和制霉菌素的显著抑制作用表明内吞过程是具有高度胆固醇依赖性的。胆固醇被鳌合后可能引起细胞膜双层生物物理特性(例如膜张力、弯曲刚度或厚度)的变化而抑制内吞作用[17]。因此,本研究实际上证明了MDCK细胞对C6-PD的内吞作用是胆固醇依赖性和小窝蛋白介导的过程。
氯丙嗪是一种阳离子两亲分子,可通过破坏网格蛋白和细胞表面的复合物来特异性阻断网格蛋白介导的内吞作用。高渗蔗糖因干扰网格蛋白晶格在脂膜上的分散而被广泛用于抑制网格蛋白囊泡的形成[18]。高渗蔗糖通过使质膜内小叶处的网格蛋白晶格解离来抑制网格蛋白包被的小孔的形成。因此,网格蛋白介导的内吞途径也参与C6-PD的跨膜转运。
另一方面,阿米洛利通过改变钠离子的浓度来抑制巨胞饮作用[19]。巨噬细胞表面普遍存在皱褶结构,钠离子的浓度对细胞膜皱褶的形成很重要。用阿米洛利进行的研究结果表明,巨胞饮作用机制在实验条件下作用不大。这与通常粒径>150 nm的颗粒可能具有这种内吞途径的报道相符[20-21]。
使用内吞抑制剂进行的研究结果表明,C6-PD的胞吞作用可能是通过多种机制介导的。
3.3.2 温度对跨细胞膜转运的影响:为考察C6-PD的细胞摄取是否为能量依赖的过程,用荧光分析法对不同温度下的C6-PD的细胞摄取进行定量研究。低温(4 ℃)会抑制所有ATP依赖的细胞过程。如果细胞中的ATP消耗殆尽,那么其依赖能量的内吞作用就会受到抑制。将温度从37 ℃降低到4 ℃会显著降低MDCK细胞对C6-PD在不同时间下的摄取百分比,见图7。这表明跨细胞转运过程在很大程度上依赖于温度或能量,进一步说明跨细胞转运的过程可能是主动转运。
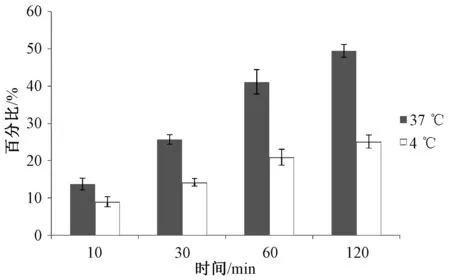
图7 不同温度下MDCK细胞对C6-PD的摄取(n=3)Fig 7 Uptake of C6-PD by MDCK cells at different temperatures (n=3)
4 结论
在本研究中,制备并表征了包含荧光探针香豆素6的典型胶束系统,并探讨了其在MDCK细胞单层中的转运。PEG-DSPE胶束具有较快的跨细胞转运能力可能与DSPE作为一种磷脂,对细胞膜具有较高的亲和力相关。通过不同内吞抑制剂和温度的研究,可以证明小窝蛋白和网格蛋白都参与了MDCK细胞对PEG-DSPE胶束的内吞作用,并且跨膜转运的过程是需要能量的主动转运过程。本研究中的发现为口服药物递送的两亲性纳米生物材料的设计提供了良好的基础。
