冠心宁注射液配伍稳定性研究
2021-04-23张睿智丁艳谱李响明宋娜娜郝欣岭孙胜斌
张睿智,丁艳谱,李响明*,宋娜娜,张 旭,郝欣岭,孙胜斌
(1.神威药业集团有限公司,河北 石家庄 051430;2.中药注射剂新药技术开发国家地方联合工程实验室,河北 石家庄 051430)
冠心宁注射液是由丹参、川芎提取精制而成的无菌水溶液,具有活血化瘀、通脉养心的功效。临床上发现冠心宁注射液对心血管疾病、脑血管疾病、呼吸系统疾病、肾病有一定的治疗效果[1]。冠心宁注射液中主要含有丹参酚酸类成分和糖类成分[2]。现代药理学研究表明,冠心宁注射液具有扩张冠状动脉、增加冠脉血流量、改善心肌缺血、改善微循环、抑制血液凝固、促进纤溶、改善血流变指标的作用。
随着冠心宁注射液在临床上的广泛应用,因配伍引发的不良反应时有发生,其配伍研究也逐渐引起重视。目前冠心宁注射液的配伍研究中稀释剂的选择,除了说明书中已经明确的5%葡萄糖注射液、0.9%氯化钠注射液外,文献报道的还有10%葡萄糖注射液、葡萄糖氯化钠注射液、复方氯化钠注射液[3],其配伍稳定性研究的监测项目主要有外观性状、pH值、紫外吸光度、不溶性微粒[4-5]、细菌内毒素[6]。黄良永等[7]发现冠心宁注射液与5%葡萄糖注射液配伍后不溶性微粒数量与配伍液的放置时间和两者配伍的比例有关。现在关于配伍的研究中,冠心宁注射液中有效物质酚酸类成分的变化鲜有报道,因此本研究中除了性状、pH值、不溶性微粒、紫外吸光度等的监测外,还增加了渗透压摩尔浓度比、酚酸类成分的含量测定。
1 试药与仪器
1.1 试药
冠心宁注射液(神威药业集团有限公司提供);5%葡萄糖注射液、0.9%氯化钠注射液(石家庄四药有限公司);丹参素钠对照品(110855-201614,98.1%)、原儿茶醛对照品(110810-201608,99.3%)、迷迭香酸对照品(111871-201706,90.5%)、丹酚酸B对照品(111562-201716,94.1%)、阿魏酸对照品(110773-201614,99.0%),以上对照品均购自中国食品药品检定研究院。乙腈为色谱纯;三氟乙酸为分析纯。
1.2 仪器
U3000高效液相色谱仪(戴安公司);CPA225D电子天平(Sartorius);FE20酸度计(梅特勒-托利多);不溶性微粒测定仪(天津市天大天发科技有限公司);紫外可见分光光度计(日本岛津公司);电热恒温水浴锅(北京科伟永兴仪器有限公司);渗透压摩尔浓度测定仪(天津天河医疗器械有限公司)。
2 方法
2.1 配伍方法
冠心宁注射液质量标准[8]中[用法与用量]中已明确“静脉滴注。一次20~40 mL,用5%葡萄糖注射液或0.9%氯化钠注射液250~500 mL稀释后使用,一日1次”[6]。为了提高滴注的顺应性,降低疼痛反应的发生率,我公司在产品说明书中“建议滴速小于40滴/分,一般控制在15~30滴/分”。
因此本研究确定冠心宁注射液的稀释液为5%葡萄糖注射液、0.9%氯化钠注射液,分别考察最小浓度、最大浓度时的配伍稳定性。结合滴速,可计算出最长滴注时间为11.6 h,最短滴注时间为2.4 h。综上,本研究分别取20 mL冠心宁注射液与500 mL稀释液(5%葡萄糖注射液、0.9%氯化钠注射液)在超净台下配伍,取40 mL冠心宁注射液与250 mL稀释液(5%葡萄糖注射液、0.9%氯化钠注射液)在超净台下配伍,配伍后在室温下静置12 h,分别在0、1、2、4、6、12 h观察配伍液的性状,测定配伍液的pH值、不溶性微粒、摩尔渗透压比、吸光度。
2.2 检测方法
2.2.1 性状 目视,静置一定时间后观察配伍液的颜色,是否有气体产生,有无浑浊或沉淀。
2.2.2 pH值 取配伍液,按《中国药典》2015年版四部通则0631测定pH值。
2.2.3 不溶性微粒 取配伍液,按《中国药典》2015年版四部通则0903测定不溶性微粒。
2.2.4 渗透压摩尔浓度 取配伍液,按《中国药典》2015年版四部通则0631测定渗透压摩尔浓度比。
2.2.5 吸光度 精密量取配伍后的药液,加水稀释至每1 mL相当于丹参2 mg的溶液。照紫外-可见分光光度法《中国药典》2015年版四部通则 0401),取相应浓度的配伍稀释液同法稀释相同的倍数后作为空白,在200~600 nm波长范围内扫描。
2.2.6 总酚酸 参照冠心宁注射液现行质量标准(WS3-B-3267-98-2012)中[含量测定]总酚酸的方法测定。取低浓度的配伍液用水稀释20倍,高浓度的配伍液用水稀释50倍后,摇匀即得供试品溶液。分别以相应的配伍稀释剂稀释相同倍数后为空白,测定其在280 nm处的吸光度。分别以相应的配伍稀释剂稀释相同倍数后作为空白溶液,测定其在280nm处的吸光度,代入标准曲线计算。
2.2.7 丹参素钠、原儿茶醛、阿魏酸、迷迭香酸和丹酚酸B 参照冠心宁注射液现行质量标准(WS3-B-3267-98-2012)中[含量测定]丹参素钠、原儿茶醛、阿魏酸、迷迭香酸和丹酚酸B的方法测定。取配伍后的稀释液,过滤,取续滤液即得供试品溶液。分别精密吸取供试品溶液10~25 μL注入液相色谱仪,测定,即得。
3 结果
根据“2.1”项下方法配伍后,分别于放置0、1、2、4、6、12 h后按照“2.2”项下方法检测,得出试验结果。见表1、表2、表3。

表1 配伍液的性状及pH值的变化

表2 配伍液的不溶性微粒及渗透压摩尔浓度的变化

续表2

表3 配伍液的吸光度变化
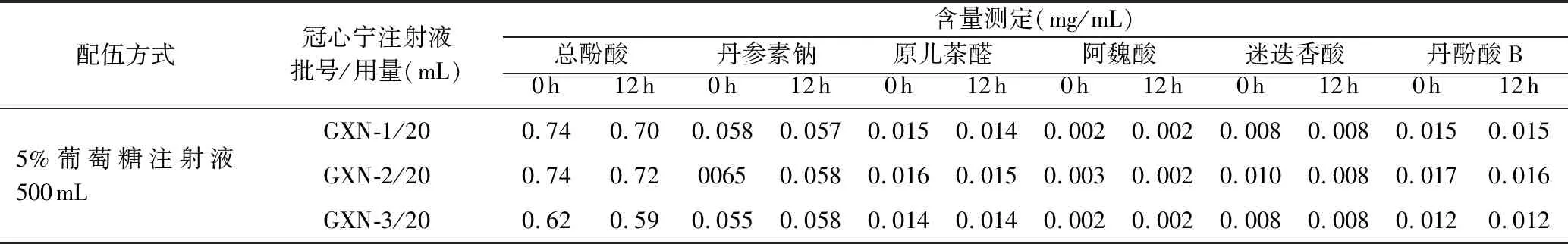
表4 配伍液的含量变化
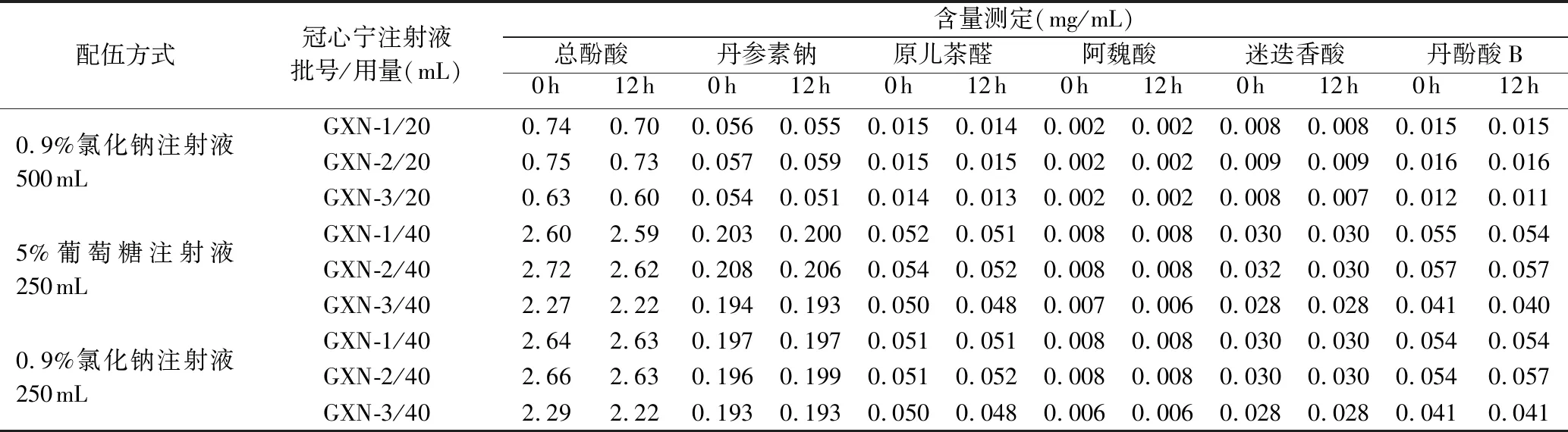
续表4
从以上3个表中的数据可知,将冠心宁注射液分别与5%葡萄糖注射液、0.9%氯化钠注射液配伍成两种浓度后,在超净台下室温连续放置12 h,配伍液未发生变色、产气、浑浊或沉淀的现象,配伍液始终呈微黄色、浅黄色的澄明液体;pH值、摩尔渗透压比稳定,12 h内几乎无变化。与5%葡萄糖注射液、0.9%氯化钠注射液配伍后,相同浓度的配伍液pH值、摩尔渗透压比稍有差异,这与所用的稀释剂不同有关。不溶性微粒数目主要取决于稀释剂中不溶性微粒的水平,放置过程中配伍液不溶性微粒数目无显著变化。配伍液在200~600nm波长范围内扫描,发现在(283±2)nm处有最大吸收,且在12 h内吸收度值稳定。本研究还测定了配伍液中有效成分的含量,放置12 h后总酚酸、丹参素钠、原儿茶醛、阿魏酸、迷迭香酸、丹酚酸B含量相对稳定。本次研究表明冠心宁注射液与5%葡萄糖注射液、0.9%氯化钠注射液配伍稳定。
4 讨论
不溶性微粒可引起肉芽肿、肺水肿、静脉炎、变态反应、热原样反应、血栓、组织坏死、肿瘤样反应等,还可能沉积在肝、脾与骨髓中对人体造成危害。因此不溶性微粒成为配伍稳定性研究的重点监测项目。在本研究中发现配伍液的不溶性微粒测定时容易受微小气泡“假粒”的干扰,尤其是配伍混合初期容易出现不溶性微粒偏多的结果。参考文献中[9]的方法超声、真空脱气,均可有效排除“假粒”,提高测定结果的准确性。
由于各种药物的药理作用不同,临床上常常联合用药以达到良好的治疗效果,但又因药物的理化性质不同,配伍后可能出现变色、产气、浑浊甚至沉淀。目前文献中已经明确的与冠心宁注射液有配伍禁忌、不适宜配伍的药物有甘草酸二胺注射液[10]、盐酸罂粟碱注射液[11]、喹诺酮类药物[12-13]乳酸环丙沙星[14-15]、盐酸左氧氟沙星[16-17]、氟罗沙星[18]、甲磺酸加替沙星[19]、甲磺酸培氟沙星。临床医护人员需清楚地了解存在配伍禁忌、不适宜配伍的药物,科学配伍,从根源上降低不良反应的发生率;此外制剂生产企业还应根据目前发现的配伍禁忌信息及时修订说明书中用药注意事项等安全性信息,以指导临床配伍。
