毛头鬼伞漆酶基因的预测及其生物信息学分析
2021-04-22牛鑫冯九海席亚丽宋利茹梁倩倩单华佳陈艳霞柯善文柴倩囡魏生龙
牛鑫 冯九海 席亚丽 宋利茹 梁倩倩 单华佳 陈艳霞 柯善文 柴倩囡 魏生龙


摘要:毛头鬼伞培养液具有较强的漆酶活性,漆酶在基质中木质素的降解和子实体的发育中发挥着重要作用。目前,人们已经完成毛头鬼伞基因组的测序,且数据已经释放至公共数据库中,但并未注释。为了掌握毛头鬼伞中漆酶的基因数量及其特征,基于已报道的毛头鬼伞漆酶蛋白的氨基酸序列,通过同源预测的方法从其基因组上预测获得21个漆酶基因,并采用ProtParam、SignalP 5.0、Sompa、TMHMM 2.0、SWISS-MODEL和WoLF PSORT等生物信息学工具对其中20个相应漆酶蛋白进行预测,分析其基本理化特性、信号肽、二级结构、跨膜结构、三级结构和亚细胞定位等。研究结果可为毛头鬼伞漆酶基因的克隆及分子作用机制等研究提供参考。
关键词:毛头鬼伞;基因预测;生物信息学;序列分析;三维结构
中图分类号: S188文献标志码: A
文章编号:1002-1302(2021)05-0067-08
漆酶(laccase,E.C.1.10.3.2)也称对苯二酚氧化还原酶,能对酚类物质进行单电子氧化,利用氧作为最终的电子受体,生成水作为唯一副产品。漆酶主要参与生物合成、木质素降解、形态发生及色素的生物合成等过程[1]。漆酶广泛存在于植物[2]、真菌[3]、细菌[4]和昆虫[5]中,真菌漆酶参与黑色素的产生、子实体的形成及植物发病机制[11]等生理过程。白腐真菌中的担子菌以其对木质素、纤维素和半纤维素的高效分解及转化为二氧化碳的能力而闻名[12],而且白腐真菌产生的漆酶具有较高的电势,比细菌或植物来源的漆酶有更高的氧化还原能力[13]。因此,关于担子菌中真菌漆酶的研究较广泛,目前已有100种以上的真菌漆酶被分离纯化[14]。大多数木腐型真菌都能产生至少1种漆酶同工酶,漆酶是土壤中降解木质素的主要酶类[15]。漆酶仅需分子氧催化的特性使得它们作为一种生态友好、多功能的生物催化剂被广泛应用于外源化合物的转化或固定中。
毛头鬼伞(Coprinus comatus)俗称“鸡腿菇”,根据最新分类系统,其属于担子菌纲(Basidiomycetes)伞菌目(Agaricales)蘑菇科(Agaricaceae)鬼伞属(Coprinus)。毛头鬼伞是一种食药两用菌,素有菌中“新秀”的美誉,具有较高的商业潜力。毛头鬼伞具有很强的产漆酶能力[19],目前已有4种漆酶蛋白被分离鉴定与克隆,但是关于毛头鬼伞漆酶基因的研究较少。Kim等通过离子交换色谱和制备凝胶电泳分离纯化得到毛头鬼伞分泌到培养基中的一种漆酶,其分子量为67 ku[22]。Bao等从毛头鬼伞中克隆了2个新的漆酶基因,其氨基酸序列具有66.12%的同源性[21]。Zhao等采用离子交换层析法、快速蛋白液相色谱法和快速凝胶层析法从毛头鬼伞发酵菌丝体中分离纯化了1种分子量为64 ku的漆酶,其N端氨基酸序列为AIGPVADLKV,是一种抗致病蛋白,能有效抑制肿瘤细胞株HepG2、MCF7的增殖,并能抑制人类免疫缺陷病毒1型(human immunodeficiency virus 1,简称HIV-1)逆转录酶活性[23]。近期,研究者完成了毛头鬼伞基因组的测序,且基因组数据已释放至美国生物技术信息中心(National Center for Biotechnology Information,简称NCBI)[24]。本研究基于此基因组数据对毛头鬼伞基因组上所有的漆酶基因进行了预测,并对相应漆酶蛋白进行了生物信息学分析。
1 材料与方法
1.1 毛头鬼伞漆酶基因的预测
以已报道的毛头鬼伞漆酶的蛋白序列(登录号为CDJ79885.1)对毛头鬼伞组装基因组数据库ASM331602v1(登录号为GCA_003316025.1)进行tblastn比对,设置期望值(E值)小于10-3,分别将比对得到的核酸片段往5′、3′端延伸2 000 bp,将相应序列以fasta格式文件复制、粘贴至Augustus基因预测工具(http://bioinf.uni-greifswald.de/augustus/submission. php)上进行在线分析,物种选择真菌中的双色蜡蘑(Laccaria bicolor),然后用默认参数运行Augustus。若有多个预测结果,则选择第1个,通过对其相应蛋白序列进行blastP比对验证,将与漆酶蛋白具有较高相似度的结果确定为毛头鬼伞漆酶基因。
1.2 毛头鬼伞漆酶蛋白的生物信息学分析工具
分别使用瑞士生物信息学研究所的专业蛋白质分析系统(ExPASy)中的ProtParam、SignalP-5.0、TMHMM 2.0、Sompa和SWISS-MODEL等工具对毛头鬼伞漆酶的基本理化性质、蛋白信号肽及其剪切位点、亚细胞定位、蛋白跨膜结构、蛋白質二级结构以及三级结构等进行预测分析(表1)。用WoLF PSORT分析毛头鬼伞漆酶的亚细胞定位,用MEME进行基序分析,用MEGA7软件中的Clustal W对毛头鬼伞漆酶蛋白氨基酸序列进行多序列比对,采用最大似然 (maximum likelihood,简称ML)法建树,选择自举法(bootstrap method)检验系统发生情况,自举重复次数设为1 000次。
2 结果与分析
2.1 毛头鬼伞漆酶基因的预测
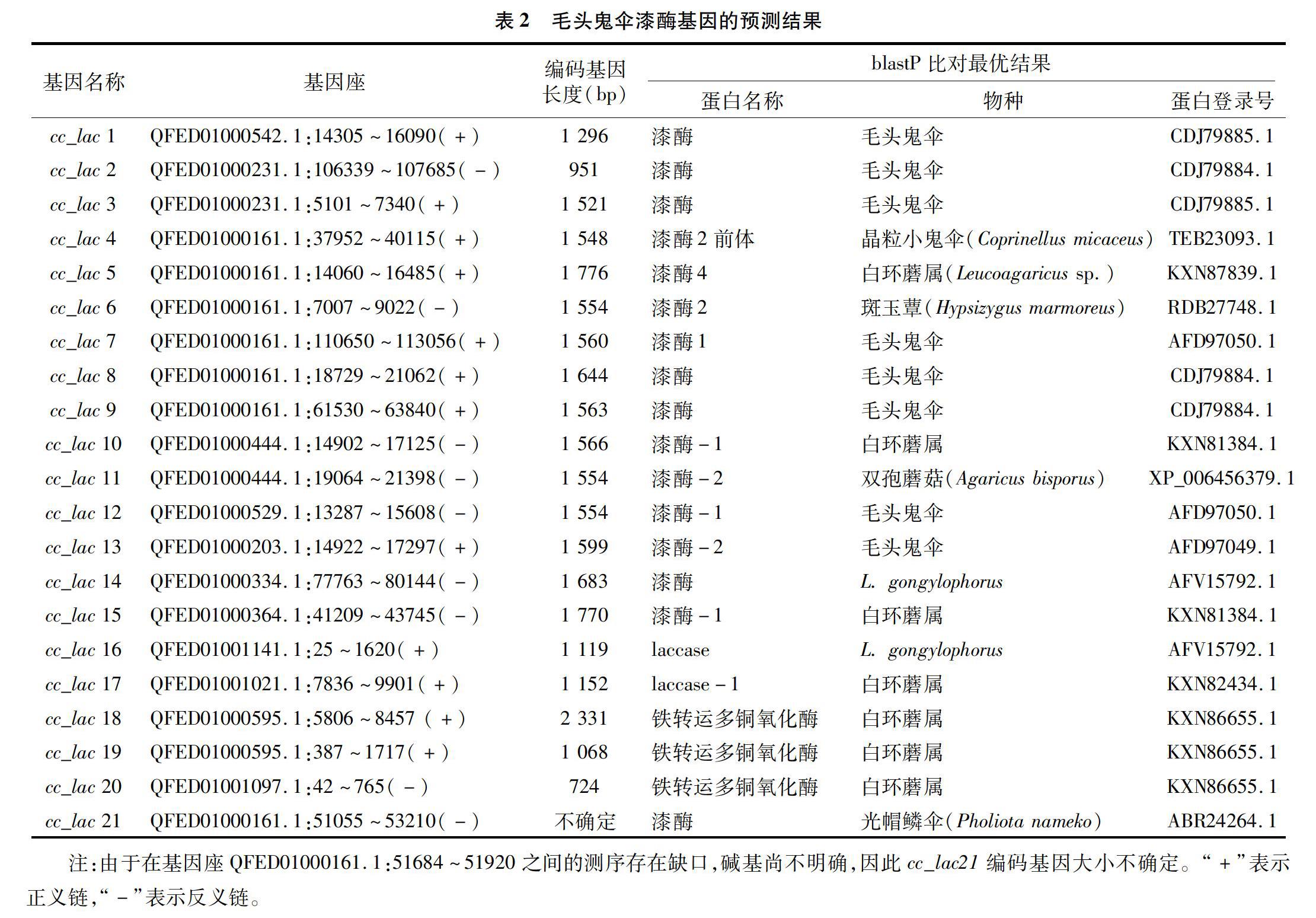
由表2可知,毛头鬼伞基因组上含有21个可能的漆酶基因,分布在12个基因座上,经blastP比对验证发现,其中18个为漆酶基因,而cc_lac18、cc_lac19和cc_lac20等3个基因则为铁转运多铜氧化酶(类漆酶)基因。在QFED01000161.1基因座上有7个漆酶基因。cc_lac3、cc_lac8、cc_lac12和cc_lac13基因与已报道的毛头鬼伞漆酶基因基本一致,分别对应NCBI蛋白数据库中登录号为CDJ79885.1、CDJ79884.1、AFD97050.1和AFD97049.1的漆酶基因。cc_lac21因参考基因组序列QFED01000161.1:51684~51920之间存在缺口,其蛋白序列不能确定。此外,cc_lac16因其5′端测序不完整,因此在相应预测蛋白N端有部分缺失。cc_lac 18基因的编码序列最长,为2 331 bp;cc_lac20基因的编码序列最短,仅为724 bp。
2.2 毛头鬼伞漆酶蛋白的生物信息学分析
2.2.1 毛头鬼伞漆酶的基本理化性质 对表2中Cc_lac 1到Cc_lac 20等20个(类)漆酶蛋白的理化性质进行分析。由表3可以看出,这些漆酶的理论分子量为20~86 ku,其中Cc_Lac 20的分子量最小,仅为20.8 ku,Cc_Lac 18的分子量最大,为 85.9 ku;大部分毛头鬼伞漆酶的等电点(pI)为5~6,Cc_Lac 1、Cc_Lac 18的pI大于7,Cc_Lac 18的pI最高,为9.17;Cc_Lac 11、Cc_Lac 12、Cc_Lac 20的pI小于5,Cc_Lac 12的pI最低,为4.58。Cc_Lac 2、Cc_Lac 5、Cc_Lac 11、Cc_Lac 13、Cc_Lac 15、Cc_Lac 17和Cc_Lac 18的不稳定指数大于40,为不稳定蛋白,其余均为稳定蛋白。这些漆酶的脂肪族指数大多在80~90之间,Cc_Lac 2的值最高,为95.57。
2.2.2 毛头鬼伞漆酶的信号肽、亚细胞定位、二级结构及跨膜结构分析 由表4可以看出,除Cc_Lac 1、Cc_Lac 7、Cc_Lac 14、Cc_Lac 15、Cc_Lac 17和Cc_Lac 18不含信号肽外,其余漆酶均含有信号肽。采用WoLF PSORT进行亚细胞定位预测,结果表明,Cc_Lac 1、Cc_Lac 2为胞质蛋白,Cc_Lac 18位于线粒体上,Cc_Lac 16因N端序列缺失而不能确定其亚细胞定位,其余漆酶均为胞外蛋白。毛头鬼伞漆酶含有5.8%~29.3%α-螺旋、17%~32%延伸链、5%~9%β-转角、44%~56%以上的无规则卷曲。Cc_Lac 1 的α-螺旋占比最低(5.8%),Cc_Lac 18 的α-螺旋占比最高(29.3%),Cc_Lac 18的延伸链占比最低(17.27%),Cc_Lac 1的延伸链占比最高(32.02%);Cc_Lac 19的β-转角占比最低(5.35%),Cc_Lac 18的β-转角占比最高(902%);Cc_Lac 20的无规则卷曲占比最低(4444%),Cc_Lac 7的无规则卷曲占比最高(5607%)。使用Sompa对蛋白质进行二级结构预测的结果表明,仅Cc_Lac 5、Cc_Lac 8、Cc_Lac 12、Cc_Lac 13和Cc_Lac 18含有1个跨膜区域。
2.2.3 毛头鬼伞漆酶蛋白的多序列比对分析 去除序列长度差异较大和相似度低的序列(Cc_Lac 1、Cc_Lac 2及Cc_Lac 16~Cc_Lac 20),对剩余毛头鬼伞漆酶序列采用Clustal W进行多序列比对(图1),可以看出,这些毛头鬼伞漆酶具有较高的相似度,包含完整的漆酶保守结构域,至少含有81个保守氨基酸残基,其中包含可能参与肽链间二硫桥形成的4个半胱氨酸残基,还包括4个参与Cu2+结合的“H-W/S/L/C-H”组氨酸保守位点,此外还具有PDGF、PGPLI、QCPI、QYCDGLRG、DWYH、LING、GKRYRFR、NYWIR、ILRY、RRDV、TDNPGPW等11个保守区域。
2.2.4 毛头鬼伞漆酶蛋白三级结构预测 使用Swiss-Model对毛头鬼伞漆酶蛋白进行同源建模。由图2可以看出,所有毛头鬼伞漆酶均为单体,其中Cc_Lac 13含有4个Cu2+配体,Cc_Lac 4、Cc_Lac 10均含有3个Cu2+配体和1个氧分子配体,Cc_Lac 6含有3个Cu2+配体、1个N-乙酰葡萄糖胺配体,Cc_Lac 3、Cc_Lac 5、Cc_Lac 8、Cc_Lac 9、Cc_Lac 11、Cc_Lac 12、Cc_Lac 15含有3个Cu2+配体,Cc_Lac 1含有2个Cu2+配体,Cc_Lac 7仅含有1个Cu2+配体,Cc_Lac 18仅含有1个Cu+配体,Cc_Lac 2、Cc_Lac 14、Cc_Lac 16、Cc_Lac 17、Cc_Lac 19和Cc_Lac 20的预测结构中不含有配体。此外,Cc_Lac 3、Cc_Lac 6、Cc_Lac 8、Cc_Lac 9、Cc_Lac 13和Cc_Lac 14的三维结构较为相似,Cc_Lac 2、Cc_Lac 4和Cc_Lac 5的三维结构以及Cc_Lac 11与Cc_Lac 15、Cc_Lac 13与Cc_Lac 14的三维结构也较为相似,结构较为相似的还有Cc_Lac 19与Cc_Lac 20,其他毛头鬼伞漆酶的三維结构差异较大。
2.2.5 毛头鬼伞漆酶蛋白序列的基序分析和进化分析 使用MEME工具对毛头鬼伞漆酶蛋白序列进行基序(motif)查找,设置查找数为3,其余参数为默认值。如图3-A所示,Cc_Lac 1、Cc_Lac 2 和Cc_Lac 18不含有基序,Cc_Lac 16仅含有motif 2这1个基序,而Cc_Lac 9、Cc_Lac 14含有motif 1、motif 2
这2个基序,Cc_Lac 20含有motif 1、motif 3这2个基序,其他漆酶均含有motif 1、motif 2、motif 3这3个基序。
利用MEGA7构建的毛头鬼伞漆酶系统发育树(图3-B),可以看出,Cc_Lac 17、Cc_Lac 18及Cc_Lac 19、Cc_Lac 20与其他漆酶的相似度较低,大体可以分为7组,其中Cc_Lac 1、Cc_Lac 2、Cc_Lac 3、Cc_Lac 5、Cc_Lac 8、Cc_Lac 9为第1组,Cc_Lac 4、Cc_Lac 6、Cc_Lac 7、Cc_Lac 12和Cc_Lac 13为第2组,Cc_Lac 10、Cc_Lac 11、Cc_Lac 15为第3组,Cc_Lac 14、Cc_Lac 16为第4组,Cc_Lac 19、Cc_Lac 20为第5组,Cc_Lac 17、Cc_Lac 18各自为1组。
采用极大似然法和基于JTT矩阵模型推测毛头鬼伞漆酶蛋白序列的演化历史,显示了具有最高对数似然值(-15 105.09)的树,相关类群聚集在一起的树的百分比显示在树枝旁边。将邻联和BioNJ算法应用于JTT模型估计的两两距离矩阵,自动获得启发式搜索的初始树,然后选择对数似然值较高的拓扑。树按比例绘制,分枝长度以每个位置替换的数量来衡量。
3 讨论与结论
本研究采用已报道的毛头鬼伞漆酶蛋白的氨基酸序列,通过同源预测tblastn毛头鬼伞基因,结合基因预测工具Augustus及blastP对比验证的方法,从而挖掘到21个毛头鬼伞的漆酶基因。尽管目前已经有越来越多的基因組数据释放至公共数据库,但是绝大部分基因组数据仅仅是1个“草图”结果,缺少注释信息。因此,如何从海量基因组数据中挖掘感兴趣的基因信息使得生物信息学方法愈加重要。通过生物信息学方法可以较为准确地预测基因组上功能基因、转录因子等信息元件。毛头鬼伞MG80基因组的大小为30.6 Mbp,为轮廓测序,基因组上存在很多缺口,组装质量较差,其重叠群(contig) N50仅为17 206 bp[24],而灰盖拟鬼伞(Coprinopsis cinerea)作为模式真菌,其基因组为代表性基因组,测序质量高,属于重叠群组装,实现了染色体测序水平[25],其contig N50为 3 468 139 bp,明显大于毛头鬼伞。因此,在本研究预测结果中,由于 Cc_Lac 21序列中间有大量不确定的碱基信息,不能确定其氨基酸序列,因而不能进行预测。此外,由于 Cc_Lac 16的5′端存在缺口,因此其部分N端序列缺失,不能准确预测其是否有信号肽及其剪切位点。由此可见,测序质量较高,即scaffold N50或者contig N50大的基因组通过生物信息学能得到更为准确完整的预测信息。将N端氨基酸序列与本研究的预测结果进行比对可知,Zhao等分离纯化到的抗致病性漆酶蛋白[23]对应本研究预测的Cc_Lac 12。Bao等从毛头鬼伞中克隆了2个漆酶基因lac1和lac2[21],经通常比对分析可知,其对应本研究中Cc_Lac 12和Cc_Lac 13的编码基因。本研究中毛头鬼伞漆酶基因的预测结果有多个,选取第1个数据用于本研究的分析,Augustus中Cc_Lac 13的第2个预测结果与该Lac2的结果一致,第1个预测结果在N端多出了9个氨基酸(—MGESHPLAT—)。通过比对发现,本研究中预测得到的Cc_Lac 7与数据库中毛头鬼伞类漆酶(部分序列)(登录号为ABS10994.1)高度匹配,仅有1个氨基酸的差异,本研究中预测得到的Cc_lac 13则与数据库中毛头鬼伞类漆酶(部分序列)(登录号为ABS10993.1)一致。
绝大多数白腐担子菌的漆酶都是分泌到胞外的,本研究中毛头鬼伞有6个漆酶不带有信号肽,通过分析可知,已报道分离纯化的毛头鬼伞漆酶均为稳定性蛋白,稳定性蛋白不易降解,方便分离纯化操作。尽管本研究未进行糖基化预测,但是真菌漆酶大多经过糖基化修饰[14],Zhao等分离得到的抗致病漆酶蛋白分子量为64 ku[23],然而本研究预测其分子量仅为55 ku。由此可以推测,Cc_Lac 7含有糖基化修饰。毛头鬼伞漆酶的二级结构以无规则卷曲为主,其无规则卷曲结构的比例大多在50%以上,玉米大斑病菌漆酶Stlac2的二级结构也以无规则卷曲为主[26]。Kameshwar等对白腐菌、褐腐菌和软腐真菌漆酶的理化、结构和功能特性进行了广泛的生物信息学比较和分析,发现软腐菌漆酶较褐腐菌漆酶和白腐菌漆酶有更高比例的无规卷曲结构,说明其结构的变异程度也较高[27]。大多数漆酶由500个左右氨基酸组成,具有3杯蛋白状结构域,活性中心含有4个铜原子,在底物催化过程中起着转移电子的作用[14]。只有真菌能够产生2个结构域和3个结构域的漆酶,真核生物中大多数漆酶是由多个基因编码的,这是因为需要大量基因产物或特定同工酶的催化亚功能化[1]。尽管真菌、细菌漆酶具有低氨基酸序列同源性,但是它们的分子结构相似,其活性位点的整体几何结构高度保守。细菌漆酶有3个顺序排列的杯蛋白状结构域,铜配体依次为4个保守基序(HXHG、HXH、HXXHXH和HCHXXXHXXXXM/L/F)。本研究获得的漆酶基因是按照双色蜡蘑的基因剪接方式预测的,虽然准确的基因信息仍需通过试验验证获得,但是本研究可以简化克隆基因的步骤,省去简并引物设计、复杂的染色体步移和巢式PCR等步骤,可参考预测基因序列直接设计特异性引物来获得目的基因。
致谢:感谢昆明理工大学相关工作者对毛头鬼伞M80基因组数据的公开。
参考文献:
[1]Janusz G,Pawlik A,S'widerska-Burek U,et al. Laccase properties,physiological functions,and evolution. International Journal of Molecular Sciences,2020,21(3):966.
[2]Liu M,Dong H,Wang M,et al. Evolutionary divergence of function and expression of laccase genes in plants. Journal of Genetics,2020,99:23.
[3]Yesilada O,Birhanli E,Geckil H. Bioremediation and decolorization of textile dyes by white rot fungi and laccase enzymes//Prasad R. Mycoremediation and environmental sustainability: fungal biology. Cham:Springer,2018:121-153.
[4]Asina F,Brzonova I,Voeller K,et al. Biodegradation of lignin by fungi,bacteria and laccases. Bioresour Technology,2016,220:414-424.
[5]Asano T,Seto Y,Hashimoto K,et al. Mini-review an insect-specific system for terrestrialization:laccase-mediated cuticle formation. Insect Biochemistry and Molecular Biology,2019,108:61-70.
[6]Lǚ Z,Kang X,Xiang Z,et al. Laccase gene Sh-lacis involved in the growth and melanin biosynthesis of Scleromitrula shiraiana. Phytopathology,2017,107(3):353-361.
[7]潘 越,馮志勇,陈 辉,等. 食用菌黑色素代谢的研究进展. 生物学杂志,2014,31(1):68-70,74.
[8]Yan L,Xu R,Bian Y,et al. Expression profile of laccase gene family in white-rot basidiomycete Lentinula edodesunder different environmental stresses. Genes,2019,10(12):1045.
[9]茅文俊,李 燕,周陈力,等. 草菇漆酶基因在子实体形成过程中的表达分析. 食用菌学报,2016,23(1):1-6.
[10]Zhang J,Chen H,Chen M,et al. Cloning and functional analysis of a laccase gene during fruiting body formation in Hypsizygus marmoreus. Microbiological Research,2015,179:54-63.
[11]Liu N,Cao Z Y,Cao K K,et al. Identification of laccase-like multicopper oxidases from the pathogenic fungus Setosphaeria turcicaand their expression pattern during growth and infection. European Journal of Plant Pathology,2019,153(4):1149-1163.
[12]Baldrian P. Fungal laccases-occurrence and properties. FEMS Microbiology Reviews,2006,30(2):215-242.
[13]Patel N,Shahane S,Shivam S,et al. Mode of action,properties,production,and application of laccase:a review. Recent Patents on Biotechnology,2019,13(1):19-32.
[14]Rivera-Hoyos C M,Morales-lvarez E D,Poutou-Piales R A,et al. Fungal laccases. Fungal Biology Reviews,2013,27(3/4):67-82.
[15]Torres-Farradá G,Manzano L A M,Rineau F,et al. Diversity of ligninolytic enzymes and their genes in strains of the genus Ganoderma:applicable for biodegradation of xenobiotic compounds?. Frontiers in Microbiology,2017,8:898.
[16]Mate D M,Alcalde M. Laccase:a multi‐purpose biocatalyst at the forefront of biotechnology. Microbial Biotechnology,2017,10(6):1457-1467.
[17]Kirk P M,Cannon P F,Minter D W,et al. Ainsworth & Bisbys dictionary of the fungi. Wallingford UK:CABI,2008:169.
[18]周茂新,文华安. 中国鬼伞属的研究现状//中国菌物学会.第八届海峡两岸菌物学学术研讨会论文集,2007:10-14.
[19]Jiang M,Ten Z,Ding S. Decolorization of synthetic dyes by crude and purified laccases from Coprinus comatusgrown under different cultures:the role of major isoenzyme in dyes decolorization. Applied Biochemistry and Biotechnology,2013,169(2):660-672.
[20]Gu C,Zheng F,Long L,et al. Engineering the expression and characterization of two novel laccase isoenzymes from Coprinus comatusin Pichia pastorisby fusing an additional ten amino acids tag at N-terminus. PLoS One,2014,9(4):e93912.
[21]Bao S,Teng Z,Ding S. Heterologous expression and characterization of a novel laccase isoenzyme with dyes decolorization potential from Coprinus comatus. Molecular Biology Reports,2013,40(2):1927-1936.
[22]Kim S Y,Choi J Y,Choi H T. Decolorization of dyes by a purified laccase from Coprinus comatus. Korean Journal of Microbiology,2017,53(2):79-82.
[23]Zhao S,Rong C B,Kong C,et al. A novel laccase with potent antiproliferative and HIV-1 reverse transcriptase inhibitory activities from mycelia of mushroom Coprinus comatus. Journal of Biomedicine and Biotechnology,2014,2014(5):417461.
[24]Li H,Wu S,Ma X,et al. The genome sequences of 90 mushrooms. Scientific Reports,2018,8(1):9982.
[25]Stajich J E,Wilke S K,Ahrén D,et al. Insights into evolution of multicellular fungi from the assembled chromosomes of the mushroom Coprinopsis cinerea (Coprinus cinereus). Proceedings of the National Academy of Sciences of the United States of America,2010,107(26):11889-11894.
[26]孟 川,賈 慧,曹可可,等. 玉米大斑病菌漆酶基因的克隆与生物信息学分析. 河北农业大学学报,2013,36(5):12-18.
[27]Kameshwar A K S,Barber R,Qin W. Comparative modeling and molecular docking analysis of white,brown and soft rot fungal laccases using lignin model compounds for understanding the structural and functional properties of laccases. Journal of Molecular Graphics and Modelling,2018,79:15-26.
[28]Chandra R,Chowdhary P. Properties of bacterial laccases and their application in bioremediation of industrial wastes. Environ Sci Process Impacts,2015,17(2):326-342.
[29]Dwivedi U N,Singh P,Pandey V P,et al. Structure-function relationship among bacterial,fungal and plant laccases. Journal of Molecular Catalysis B Enzymatic,2011,68(2):117-128.
[30]Ihssen J,Reiss R,Luchsinger R,et al. Biochemical properties and yields of diverse bacterial laccase-like multicopper oxidases expressed in Escherichia coli. Scientific Reports,2015,5:10465.
[31]Reiss R,Ihssen J,Richter M,et al. Laccase versus laccase-like multi-copper oxidase:a comparative study of similar enzymes with diverse substrate spectra. PLoS One,2013,8(6):e65633.
