植物根系表型信息获取技术研究进展
2021-04-22吴茜张伟欣张玲玲孙传亮刘乃森岳延滨曹静梁万杰葛道阔唐普传李百明曹宏鑫张文宇
吴茜 张伟欣 张玲玲 孙传亮 刘乃森 岳延滨 曹静 梁万杰 葛道阔 唐普传 李百明 曹宏鑫 张文宇


摘要:人口数量增长和全球气候变化加剧了粮食安全供给压力,育种学家亟需培育高产、高效作物品种以满足日益增长的粮食消费需求。基于根性状的品种培育改良可有效提高作物水分、养分利用率,但根系表型观测的困难性极大地限制了育种进程。随着自动化控制、成像和传感器以及图像解译技术的发展,高通量根表型信息系统性收集已成为可能。本文综述了一系列适用于室内或田间的非破坏性或破坏性根系二维或三维结构测定技术;系统阐述了主流的根表型参数提取图像分析技术和软件;探讨了基于根表型平台的根性状筛选应用于新品种培育的成功案例,并对高通量根表型平台的进一步研发进行了展望。
关键词:根系表型;高通量;图像采集;图像处理;根性状;作物改良
中图分类号:S126 文献标志码: A
文章编号:1002-1302(2021)05-0031-07
由于人口数量增长和消费结构升级,全球农作物消费需求快速增加。与此同时,耕地面积减少、水资源匮乏、全球气候变化和极端天气频发进一步增加了粮食安全供给的压力。依靠“大水大肥”的农田管理办法片面重视作物产量,忽视资源利用效率,造成了土壤质量下降、面源污染和温室效应等生态环境问题[1]。为保证农业绿色可持续发展,同时满足未来粮食需求,育种学家需从根源上突破,培育水分、养分高效吸收的作物品种。根系作为直接接触土壤资源的重要器官,其结构和功能对作物吸收土壤水分、养分具有重要影响[2]。良好的根系构型能最大化作物对土壤养分资源的捕获效率,从而有效提高作物产量[3]。因此,学者们提出第二次绿色革命,即基于根性状进行作物培育改良,以提高作物产量和养分资源利用率。
根系表型观测是实现优势根性状筛选和培育的基础。然而,土壤不透明性和结构复杂性导致根系观测十分困难。根表型信息的系统性收集已成为基于根性状的遗传育种研究和植物科学研究的主要限制因素之一[3]。研发高通量根表型平台,通过现代化信息采集分析手段提高根表型信息获取效率和精度,对高效筛选优势根性状、加速作物育种研究和栽培生理学研究具有重要意义。本文旨在通过介绍根表型信息高效采集、根性状参数定量提取等近年来国内综述较少的根表型测定技术,概述国际上主流根表型平台的最新研究进展,结合相关领域最新发展趋势,探讨在实验室或田间揭示植物“隐藏的另一半”的新技术、新方法及其挑战和机遇,并展望高通量根表型信息系统性收集平台的发展前景。
1 根表型信息获取技术
植物表型是理解基因型与环境互作的关键。在可控环境下规模化地筛选优质基因型和表现型,挖掘不同环境条件下作物表型性状及与之关联的遗传信息,进而揭示基因-表型-环境互作机理,是作物育种研究取得突破的重要途径[3]。建立表型与遗传信息的关系或应用表型信息优化基于基因组选择的预测模型,均需要大量精准而全面的表型和基因型信息。因此,基因-环境-表型互作机理研究需借助以大数据为核心的现代化信息技术。随着测序效率提升以及测序成本降低,作物基因组数据不断增长和完善。然而,表型信息获取仍以人工为主,尤其根表型观测仍十分困难,需破坏性测定,工作量大,且数据重复性差。
近年来,根表型研究获得了国际上越来越多研究学者和学术机构的关注。随着数据采集工具、传感器及数字图像处理和分析技术的发展,现代智能科学技术手段已逐步应用于根表型研究领域。目前,学者们已研发出一系列适用于实验室条件下的、非土壤介质或土壤介质的、非破坏性根系二维或三维结构测定技术,以及适用于田间的、破坏性或非破坏性的根系二维或三维结构测定技术。
1.1 室内二维根系表型测定技术
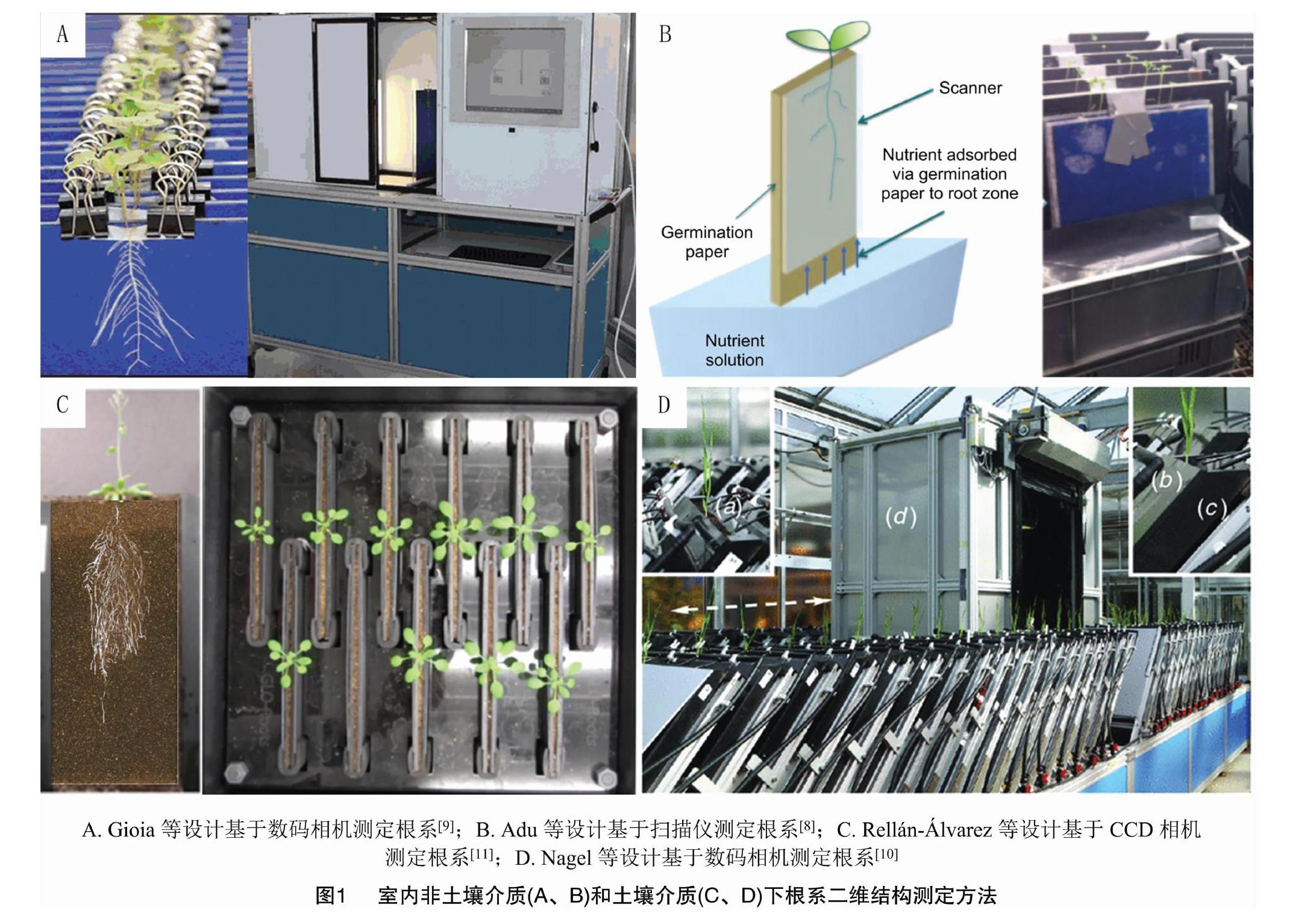
由于土壤的遮蔽性,获取非土壤介质下的根表型信息是许多学者开展根系研究的重要途径之一。有学者采用非穿透性低成本成像传感器(如可视相机和平板扫描仪等)在室内对根盒(发芽纸与透明玻璃板组成的栽培容器)、生长袋或透明人工生长培养基中的根系进行实时成像,以获取根系动态生长信息(图1-A、图1-B)。该类方法操作便捷、通量易拓展,但仅能观测苗期较小的植株根系,且非土壤介质及二维生长空间对根系构型影响较大。
采用非穿透性成像传感器获取土壤介质下微根窗根系图像也是目前国际上较为流行的根系表型测定方法(图1-C、图1-D)。该类方法可高通量、自动化地对根系进行成像,但该方法构建成本较高,有限的二维生长空间导致根系生长轨迹发生改变,此外,土壤颗粒的遮蔽导致成像捕获的根系结构不完整。基于热红外成像和断根修复算法的根系表型测定方法可实现根系图像信息的增强和修复[13],在一定程度上解决土壤遮挡时根系图像信息不全的问题。
尽管室内非土壤或土壤介质二维根系表型观测技术存在一定的局限性,但由于其适合纳入高通量根系表型平台而被广泛应用,该类系统已成功应用于大豆[14]、玉米[15]、小麦[16]、油菜[9]、棉花[12]等多种作物根系性状的筛选。
1.2 室内三维根系表型测定技术
自然生长的根系结构具有许多难以在二维空间中量化的特征,如谷类作物种子根的排列(通常为不对称分布)以及玉米节根的轮次、数量和角度等。为了给植株根系提供自由生长空间并保持其空间生长位置,许多学者采用琼脂和冷凝胶作为生长介质,采用立体视觉法或激光成像法对透明介质下的根系进行三维成像(图2-A)。此类方法可重建根系三维结构,已被成功地用于揭示水稻等作物三维根系结构特征的潜在遗传基础;但琼脂无法补充养分、水分,且本身特性容易造成根系缺氧,且该方法仅能测定苗期根系;此外,非土壤介质下根系生长发育状况也与自然土壤环境下存在较大差异。
目前,已报道的采用非破坏性方法获取土壤中根系三维结构的方法包括微X射线断层扫描法(X-ray CT)、核磁共振成像法(MRI)和正电子发射断层扫描(PET)[26]等(图2-B、图2-C)。X-ray CT可以基于不同的X射线衰减实现根系三维结构可视化,已被应用于水稻根系对生长介质特异性响应,拟南芥、玉米和水稻侧根模式,白杨与云杉种间互作以及草原落叶松根系量化等研究。MRI使用射频波和强磁场刺激原子并生成三维结构,该类技术已经被应用于玉米、大豆、甜菜和大麦根系的三维成像。PET扫描显示短半衰期放射性示踪剂的分布,如植物代谢过程中使用的碳同位素,该方法对示踪剂具有很高的灵敏度,但分辨率较低(仅为1.4 mm)。以上方法最初均为医学应用而开发的层析成像技术,仪器设备成本高昂,由于低分辨率以及復杂的根系三维重建,仅能获取有限根系结构信息;此外,还存在栽培容器小(仅能测定直径小于8 cm土柱中的苗期根系)、通量低、耗时长且设备不可移动等缺点。由于操作局限和费用昂贵,这些技术在推广应用上受到很大限制。
1.3 田间根系表型测定技术
田间根系表型观测大多通过破坏性取样实现,最经典的根钻法得到了最广泛的应用。Wasson等通过应用UV光照和荧光光谱技术改进了根钻法,增强了土壤和根系图像对比度,同时实现了自动图像采集及根钻分离[27]。Shovleomics法是目前田间根系测定较为流行的方法(图3-A)[28],该方法使用铁锹获取小范围土体内的根系,清洗后通过自动化成像和图像处理实现根系表型测定[29];该方法操作便捷高效,但仅能获取根基部相对简单的根性状(如根系轮廓、投影密度和面积等)。三维数字化技术已被成功应用于田间原位精确测定根系空间伸展轨迹(图3-B),该方法能精确描述根系三维空间结构,但费时费力,难以实现高通量测定且无法捕获侧根形态结构信息。
田间根系表型观测的非破坏性方法主要包括根室法和微根管法。根室法通过对地窖内透明玻璃窗进行成像来捕获田间根表型信息;微根管法通过扫描紧贴玻璃管生长的根系来捕获局部根表型信息;但这2种方法仅能获取局部区域根表型信息,且观测设备构建和布置成本较高。近年来,研究根系和土壤剖面的非侵入性地球物理技术也得到了发展。电阻层析成像(ERT)被用来分析直径较大的根系(如树木根系)[35],但在作物根表型领域应用有限。地面穿透雷达技术(GPR)是另一种与电磁干扰相似吞吐量的地球物理技术,它利用高频无线电波探测物体,适用于探测和量化粗壮根系(如树木根系),然而,在探测直径小于 2 mm 的树根时分辨率不够,无法应用于形态较小、直径较细的作物根系测定。
2 根表型参数提取技术
基于获取的根系图像提取根系形态、性状等定量化信息是高通量根表型信息系统性收集的另一个关键[6]。近年来,国内外研究人员开发了一系列自动化及半自动化的根系图像处理和根系特征提取软件。
2.1 二维根系图像处理软件
国际上已有根系图像分析软件大多适用于二维根系结构特征参数的提取(表1),包括GIA Root、Root Reader 2D、SmartRoot、WinRhizo和EZ-Rhizo等。不同根系图像分析软件都有其特定的适用范围,提取的根系特征参数也存在一定差异。目前可提取的二维根系特征参数主要分为两大类:一类是基于根系整体的全局特征性状,包括总根面积、总根长、根凸包面积、根深和根宽等信息;另一类是基于拓扑连接的根系详细特征性状,包括主根和各级侧根的长度、个数、直径和角度等信息。对于有明显交叉和重叠的复杂根系或者背景对比度低的根系图像,在提取根系特征性状时需要加入大量的手动处理,尤其对于详细根特征性状的提取。
2.2 三维根系图像处理软件
国际上已有的根系三维结构分析软件较少(表1),主要包括RooTrak、iRoCS Toolbox和RootReader3D 。RooTrak能够基于X-ray断层扫描土柱半自动化地分割根系和周围的土壤,实现根系三维重建,但该软件不具备提取根系三维结构参数的功能[22]。iRoCS Toolbox能够在实现根系三维重建的基础上进一步自动化或半自动化提取根系直径和体积等简单根系表型参数[44]。RootReader3D能自动化提取根系深度、宽度、总长度、总表面积、总体积、凸包体积和根尖数目等根系表型参数,但这些表型参数大多是基于根系整体的全局根系结构特征参数,对基于拓扑连接的详细根系三维结构参数,如主根和单条侧根长度、直径、分枝位置、分枝角度和个数等,尚未能实现定量化提取和分析[18]。
3 基于根表型平台的育种改良
根系结构性状是育种人员进行作物改良以提高作物产量的主要研究对象之一。尽管对根系的观测研究存在极大挑战,基于根表型观测筛选根性状已被成功引入新品种的培育研究中[45]。研究学者通过各式根表型观测方法对环境胁迫下有助于保持作物生产力的根系结构特性进行了研究和筛选。已有学者通过根盒法[46]和田间根钻挖掘法[47]发现,小麦根系生长得深且广有利于捕获深层土壤水;通过根盒法和田间铁锹挖掘法发现,减少冠根数目有利于提高禾本科植物抗旱能力;通过发芽袋培养法发现,根系生长较浅的植株对磷有较多的吸收[50]。此外,已有学者通过花篮盆栽法研究发现,具有较倾斜根角度(根系与土壤表面夹角较大)的水稻更耐旱;并进一步明确了DRO1基因调控根系生长的深度和角度,通过将深根特征性状引入浅根品种,提高和改善了水稻的抗旱能力,证明了对根系结构的控制和改良可有效提高作物抗旱能力[51]。然而,目前基于根性状的培育改良研究进展十分缓慢,根性状的筛选仍是一个非常耗时的工作。研究学者需继续研发适用于不同培育目标的系统、规模化的高通量根表型平台,从而加速对根性状的筛选以及对根功能的认识,深入了解根性状如何与整个植物的抗逆策略相关联从而提高作物生产力,最终成功地确定作物改良的关键根系性状。
4 结论与展望
本文综述了近年来植物根表型平台研究的最新进展,成像和传感器以及图像解译技术的进步加速了高通量根表型平台的发展。室内二维根系表型平台发展最为迅速,尽管在生长空间和观测时期上存在一定的局限性,但因其通量易拓展、适合开展高通量自动化根表型分析而被广泛应用于作物育种研究和植物生理学研究;室内三维根系结构无损成像技术也取得了重要进展,该技术在未来面临的新挑战是如何将其纳入自动化表型平台,使其通量可与二维根系表型系统相媲美,以便进行大规模的定量遗传研究;田间根系表型测定技术目前发展较为缓慢,其主要限制因素仍为土壤的不透明性和田间生长环境的复杂性,未来该领域的技术研发仍面临巨大的挑战和机遇。
基于二维或三维成像的高通量根表型平台获取的图像数量庞大,导致后期的图像处理工作量繁重,需要人工干预的图像处理软件极大地阻碍了根表型信息获取的速度。根表型信息提取所需的时间依赖于根系复杂程度以及待提取的目标根特征参数。由于许多根特征参数之间具有高度的自相关性,相比获取大量详细的根特征参数,确定关键根特征参数对量化分析不同品种根系性能的差异有更为重要的作用。因此,为平衡根特征参数提取与自动化根系成像的通量和效率,可根据研究目标选择适合的根特征参数提取软件和提取方法,着重提取对于品种筛选关键的根性状。此外,深度机器學习正成为许多计算机视觉问题的标准技术,该技术在植物科学领域中的应用大部分集中于植物地上部。在未来需要研究人员与计算机科学家积极合作,将诸如深度学习等创新方法整合到根表型信息提取分析中,以提高根表型参数提取效率和精度[52]。
高通量根表型平台的研发应以支持植物生理学以及作物育种研究为目标。有研究学者提出研发一套通用的根表型平台,但在实际应用中,具有普适性的通用根表型平台极难建立,其原因在于不同育种目标都需要差异化的根表型观测技术,因此,研究学者们仍鼓励继续研发适用于不同研究目标的新的根表型平台。未来期望通过研发高通量自动化根表型平台,结合图像解译技术高效获取高通量根表型定量数据,并与大规模平行测序技术结合,通过表型组学和基因组学联合分析,挖掘控制理想根表型性状的基因组,以此指导作物育种。这种多学科方法将为基于根性状的作物改良提供重要支持,对满足未来气候变化挑战下作物高产稳产的迫切需要具有重要意义。
参考文献:
[1]朱兆良,金继运.保障我国粮食安全的肥料问题. 植物营养与肥料学报,2013,19(2):259-273.
[2]Lynch J P. Root architecture and plant productivity. Plant Physiology,1995,109(1):7-13.
[3]Fiorani F,Schurr U. Future scenarios for plant phenotyping. Annual Review of Plant Biology,2013,64:267-291.
[4]de Dorlodot S,Forster B,Pagès L,et al. Root system architecture:opportunities and constraints for genetic improvement of crops. Trends in Plant Science,2007,12(10):474-481.
[5]Lynch J P,Brown K M. New roots for agriculture:exploiting the root phenome. Philosophical Transactions of the Royal Society of London. Series B,Biological Sciences,2012,367(1595):1598-1604.
[6]Kuijken R C P,van Eeuwijk F V,Marcelis L F M,et al. Root phenotyping:from component trait in the lab to breeding. Journal of Experimental Botany,2015,66(18):5389-5401.
[7]潘映紅. 论植物表型组和植物表型组学的概念与范畴. 作物学报,2015,41(2):175-186.
[8]Adu M O,Chatot A,Wiesel L,et al. A scanner system for high-resolution quantification of variation in root growth dynamics of Brassica rapa genotypes. Journal of Experimental Botany,2014,65(8):2039-2048.
[9]Gioia T,Galinski A,Lenz H,et al. GrowScreen-PaGe,a non-invasive,high-throughput phenotyping system based on germination paper to quantify crop phenotypic diversity and plasticity of root traits under varying nutrient supply. Functional Plant Biology,2016,44(1):76-93.
[10]Nagel K A,Putz A,Gilmer F,et al. GROWSCREEN-Rhizo is a novel phenotyping robot enabling simultaneous measurements of root and shoot growth for plants grown in soil-filled rhizotrons. Functional Plant Biology,2012,39(11):891-904.
[11]Rellán-lvarez R,Lobet G,Lindner H,et al. GLO-Roots:an imaging platform enabling multidimensional characterization of soil-grown root systems. eLife,2015,4:e07597.
[12]Wu J,Wu Q,Pagès L,et al. RhizoChamber-Monitor:a robotic platform and software enabling characterization of root growth. Plant Methods,2018,14(1):44.
[13]卢 伟,韩 钊,蹇兴亮,等. 基于热红外成像和断根修复算法的玉米根系表型检测方法. 光谱学与光谱分析,2020,40(9):2845-2850.
[14]Bonser A M,Lynch J,Snapp S. Effect of phosphorus deficiency on growth angle of basal roots in Phaseolus vulgaris. The New Phytologist,1996,132(2):281-288.
[15]Hund A,Trachsel S,Stamp P. Growth of axile and lateral Roots of maize:I development of a phenotying platform. Plant and Soil,2009,325(1):335-349.
[16]Atkinson J A,Wingen L U,Griffiths M,et al. Phenotyping pipeline reveals major seedling root growth QTL in hexaploid wheat. Journal of Experimental Botany,2015,66(8):2283-2292.
[17]Iyer-Pascuzzi A S,Symonova O,Mileyko Y,et al. Imaging and analysis platform for automatic phenotyping and trait ranking of plant root systems. Plant Physiology,2010,152(3):1148-1157.
[18]Clark R T,Maccurdy R B,Jung J K,et al. Three-dimensional root phenotyping with a novel imaging and software platform. Plant Physiology,2011,156(2):455-465.
[19]Topp C N,Iyer-Pascuzzi A S,Anderson J T,et al. 3D phenotyping and quantitative trait locus mapping identify core regions of the rice genome controlling root architecture. Proceedings of the National Academy of Sciences of the United States of America,2013,110(18):E1695-E1704.
[20]朱同林,方素琴,李志垣,等. 基于圖像重建的根系三维构型定量分析及其在大豆磷吸收研究中的应用. 科学通报,2006,51(16):1885-1893.
[21]Flavel R J,Guppy C N,Tighe M,et al. Non-destructive quantification of cereal Roots in soil using high-resolution X-ray tomography. Journal of Experimental Botany,2012,63(7):2503-2511.
[22]Mairhofer S,Zappala S,Tracy S R,et al. RooTrak:automated recovery of three-dimensional plant root architecture in soil from x-ray microcomputed tomography images using visual tracking. Plant Physiology,2012,158(2):561-569.
[23]罗锡文,周学成,严小龙,等. 基于XCT技术的植物根系原位形态可视化研究. 农业机械学报,2004,35(2):104-106,133.
[24]张建锋,吴 迪,龚向阳,等. 基于核磁共振成像技术的作物根系无损检测. 农业工程学报,2012,28(8):181-185.
[25]Rascher U,Blossfeld S,Fiorani F,et al. Non-invasive approaches for phenotyping of enhanced performance traits in bean. Functional Plant Biology,2011,38(12):968-983.
[26]Moradi A B,Carminati A,Vetterlein D,et al. Three-dimensional visualization and quantification of water content in the rhizosphere. The New Phytologist,2011,192(3):653-663.
[27]Wasson A,Bischof L,Zwart A,et al. A portable fluorescence spectroscopy imaging system for automated root phenotyping in soil cores in the field. Journal of Experimental Botany,2016,67(4):1033-1043.
[28]Trachsel S,Kaeppler S M,Brown K M,et al. Shovelomics:high throughput phenotyping of maize (Zea maysL.) root architecture in the field. Plant and Soil,2011,341(1):75-87.
[29]Bucksch A,Burridge J,York L M,et al. Image-based high-throughput field phenotyping of crop roots. Plant Physiology,2014,166(2):470-486.
[30]Wu J,Pagès L,Wu Q,et al. Three-dimensional architecture of axile roots of field-grown maize. Plant and Soil,2015,387(1):363-377.
[31]陈信信,丁启朔,李毅念,等. 南方稻麦轮作系统下小麦根系的三维分形特征. 中国农业科学,2017,50(3):451-460.
[32]Liedgens M,Richner W. Minirhizotron observations of the spatial distribution of the maize root system. Agronomy Journal,2001,93(5):1097-1104.
[33]史建伟,于水强,于立忠,等. 微根管在细根研究中的应用. 應用生态学报,2006,17(4):715-719.
[34]廖荣伟,刘晶淼,安顺清,等. 基于微根管技术的玉米根系生长监测. 农业工程学报,2010,26(10):156-161.
[35]Amato M,Basso B,Celano G,et al. In situ detection of tree root distribution and biomass by multi-electrode resistivity imaging. Tree Physiology,2008,28(10):1441-1448.
[36]Zenone T,Morelli G,Teobaldelli M,et al. Preliminary use of ground-penetrating radar and electrical resistivity tomography to study tree Roots in pine forests and poplar plantations. Functional Plant Biology,2008,35(10):1047-1058.
[37]郭庆华,刘 瑾,陶胜利,等. 激光雷达在森林生态系统监测模拟中的应用现状与展望. 科学通报,2014,59(6):459-478.
[38]舒洪岚. 探地雷达在植物根系研究中的应用. 江西林业科技,2007(5):32-33.
[39]Arsenault J L,Poulcur S,Messier C,et al. WinRHIZO,a root-measuring system with a unique overlap correction method. HortScience,1995,30(4):906-907.
[40]Armengaud P,Zambaux K,Hills A,et al. EZ-Rhizo:integrated software for the fast and accurate measurement of root system architecture. The Plant Journal,2009,57(5):945-956.
[41]Lobet G,Pagès L,Draye X. A novel image-analysis toolbox enabling quantitative analysis of root system architecture. Plant Physiology,2011,157(1):29-39.
[42]Clark R T,Famoso A N,Zhao K Y,et al. High-throughput two-dimensional root system phenotyping platform facilitates genetic analysis of root growth and development. Plant,Cell & Environment,2013,36(2):454-466.
[43]Galkovskyi T,Mileyko Y,Bucksch A,et al. GiA Roots:software for the high throughput analysis of plant root system architecture. BMC Plant Biology,2012,12(1):116.
[44]Schmidt S,Bengough A G,Gregory P J,et al. Estimating root-soil contact from 3D X-ray microtomographs. European Journal of Soil Science,2012,63(6):776-786.
[45]Tracy S R,Nagel K A,Postma J A,et al. Crop improvement from phenotyping roots:highlights reveal expanding opportunities. Trends in Plant Science,2020,25(1):105-118.
[46]Hurd E A. Phenotype and drought tolerance in wheat. Agricultural Meteorology,1974,14(1):39-55.
[47]Wasson A P,Rebetzke G J,Kirkegaard J A,et al. Soil coring at multiple field environments can directly quantify variation in deep root traits to select wheat genotypes for breeding. Journal of Experimental Botany,2014,65(21):6231-6249.
[48]Sebastian J,Yee M C,Viana G W,et al. Grasses suppress shoot-borne roots to conserve water during drought. Proceedings of the National Academy of Sciences of the United States of America,2016,113(31):8861-8866.
[49]Lynch J P. Rightsizing root phenotypes for drought resistance. Journal of Experimental Botany,2018,69(13):3279-3292.
[50]Henry A,Chaves N F,Kleinman P J A,et al. Will nutrient-efficient genotypes mine the soil? Effects of genetic differences in root architecture in common bean (Phaseolus vulgarisL.) on soil phosphorus depletion in a low-input agro-ecosystem in Central America. Field Crops Research,2010,115(1):67-78.
[51]Uga Y,Sugimoto K,Ogawa S,et al. Control of root system architecture by DEEPER ROOTING 1 increases rice yield under drought conditions. Nature Genetics,2013,45(9):1097-1102.
[52]Atkinson J A,Pound M P,Bennett M J,et al. Uncovering the hidden half of plants using new advances in root phenotyping. Current Opinion in Biotechnology,2019,55:1-8.
