新型抗癫痫药物对新诊断青年男性癫痫患者性激素及性功能的影响研究
2021-04-22凌秀明龙海秦培英潘明明李星虹邓海英
凌秀明,龙海,秦培英,潘明明,李星虹,邓海英
癫痫是一种大脑神经元异常放电而引起短暂性中枢神经系统功能障碍的临床综合征。我国活动性癫痫患者较多,每年新发人数不断增加,已成为社会公共问题之一[1]。目前临床多采用抗癫痫药物(AEDs)进行对症治疗,但由于癫痫的病理生理机制较复杂,患者需长期服用AEDs,部分顽固性癫痫患者需大剂量服用AEDs,因AEDs的药代动力学复杂,其不良反应较多。既往临床多关注AEDs对肝肾功能的影响,随着人民群众健康意识的加强,研究者逐渐开始关注AEDs对生殖功能的影响[2-5]。但相关研究的结论存在较大争议。本研究旨在探讨新型AEDs对新诊断青年男性癫痫患者性激素及性功能的影响,以为有生育需求的男性癫痫患者在选择AEDs治疗时提供参考。
1 对象与方法
1.1 研究对象 回顾性选取2016—2019年钦州市第二人民医院神经内科收治的新诊断青年男性癫痫患者200例,均符合癫痫的诊断标准[6]。纳入标准:(1)首次确诊,既往未服用过AEDs;(2)年龄18~44岁;(3)有正常性伴侣者。排除标准:(1)近1个月内服用激素、可能影响性激素水平、抗焦虑抑郁类、改善性功能类药物者;(2)合并肝肾功能障碍者;(3)有先天性器官功能异常者;(4)合并其他神经系统疾病者。剔除标准:(1)未能配合完成相关检查者;(2)失访者:(3)对本研究药物过敏者:(4)中途更换治疗方案者;(5)中途自行停药者。本研究经钦州市第二人民医院伦理委员会审核批准,且患者和/或家属对本研究知情并均签署知情同意书。
1.2 治疗与分组 患者入院后完善相关检查后,基于其癫痫发作类型随机给予口服奥卡西平(武汉人福药业有限责任公司生产,国药准字H20040192)600~1 200 mg/d,拉莫三嗪(三金集团湖南三金制药有限责任公司生产,国药准字H20050596)100~200 mg/d,左乙拉西坦(浙江普洛康裕制药有限公司生产,国药准字H20193256)1 000~4 000 mg/d,托吡酯(西安杨森制药有限公司生产,国药准字H20020557)100~200 mg/d,均为单药治疗。将其中服用奥卡西平者分为A组,服用拉莫三嗪者分为B组,服用左乙拉西坦者分为C组,服用托吡酯者分为D组,各50例。
1.3 资料收集 (1)收集患者年龄、体质指数、婚姻状况、生育情况、治疗前6个月内癫痫发作次数。(2)分别于患者治疗前及治疗后6、12个月采集其清晨空腹静脉血,应用全自动化学发光免疫分析仪检测催乳素(PRL)、卵泡刺激素(FSH)、促黄体生成素(LH)、睾酮(T)、雌二醇(E2)水平。(3)分别采用国际勃起功能指数5(IIEF-5)[7]、早泄诊断工具(PEDT)[8]评估患者性功能,IIEF-5评分越高表明勃起功能越好,PEDT评分越高表明早泄现象越严重。
1.4 统计学方法 采用SPSS 24.0统计学软件进行数据处理。符合正态分布的计量资料以(±s)表示,多组间比较采用单因素方差分析,组间两两比较采用SNK-q检验,重复测量数据比较采用双因素重复测量方差分析;计数资料以相对数表示,组间比较采用χ2检验。以P<0.05为差异有统计学意义。
2 结果
2.1 一般情况 A组中脱落8例,其中失访4例、更换治疗方案2例、自行停药2例,最终纳入42例;B组中脱落7例,其中失访3例、自行停药2例、更换治疗方案1例、出现皮疹1例,最终纳入43例;C组中脱落4例,其中更换治疗方案2例、失访1例、自行停药1例,最终纳入46例;D组中脱落10例,其中更换治疗方案5例、失访2例、自行停药2例、出现皮疹1例,最终纳入40例。四组患者年龄、体质指数、婚姻状况、生育状况、治疗前6个月内癫痫发作次数比较,差异无统计学意义(P>0.05),见表1。
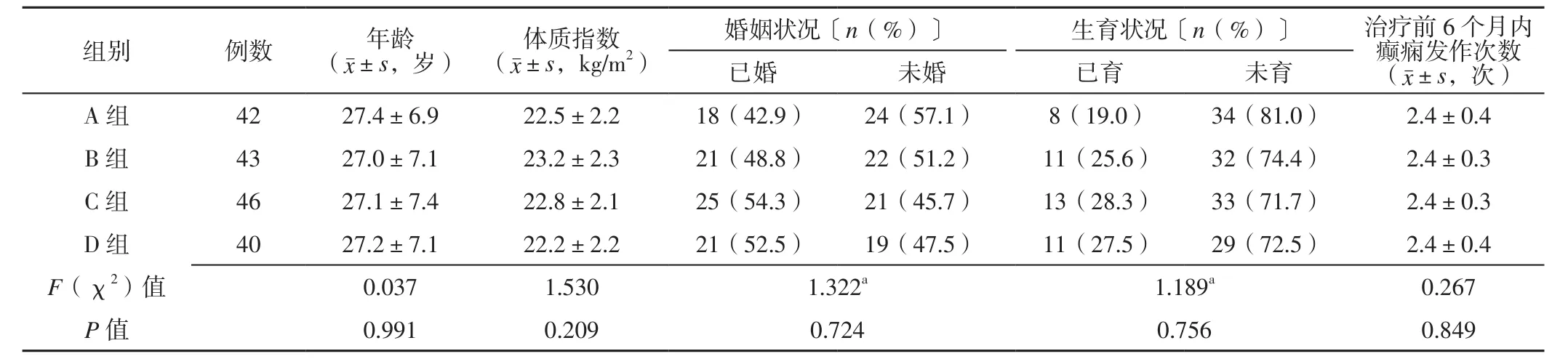
表1 四组患者临床资料比较Table 1 Comparison of clinical data in the four groups
2.2 四组患者治疗前及治疗后6、12个月性激素水平比较 时间与治疗方法在LH水平上存在交互作用(P<0.05),在PRL、FSH、T、E2水平上无交互作用(P>0.05);治疗方法在PRL、FSH、LH、T水平上主效应显著(P<0.05),在E2水平上主效应不显著(P>0.05);时间在PRL、FSH、LH水平上主效应显著(P<0.05),在T、E2水平上主效应不显著(P>0.05)。A组患者治疗后6、12个月FSH水平及治疗后12个月LH、T水平分别高于本组治疗前,治疗后12个月FSH水平高于本组治疗后6个月,差异有统计学意义(P<0.05);C组患者治疗后6、12个月T水平分别高于本组治疗前,治疗后12个月T水平高于本组治疗后6个月,差异有统计学意义(P<0.05);D组患者治疗后6、12个月PRL水平分别低于本组治疗前,LH水平分别高于本组治疗前,差异有统计学意义(P<0.05);D组患者治疗后12个月PRL水平低于本组治疗后6个月,LH水平高于本组治疗后6个月,差异有统计学意义(P<0.05).B、C、D组患者治疗后12个月FSH水平低于A组,差异有统计学意义(P<0.05);C组患者治疗后12个月T水平高于B组,差异有统计学意义(P<0.05);D组患者治疗后6、12个月PRL水平低于A、B、C组,LH水平高于A、B、C组,差异有统计学意义(P<0.05);D组患者治疗后12个月T水平低于A、C组,差异有统计学意义(P<0.05),见表2。
表2 四组患者治疗前及治疗后6、12个月性激素水平比较(±s)Table 2 Comparison of sex hormone level in the four groups before treatment and 6,12 months after treatment
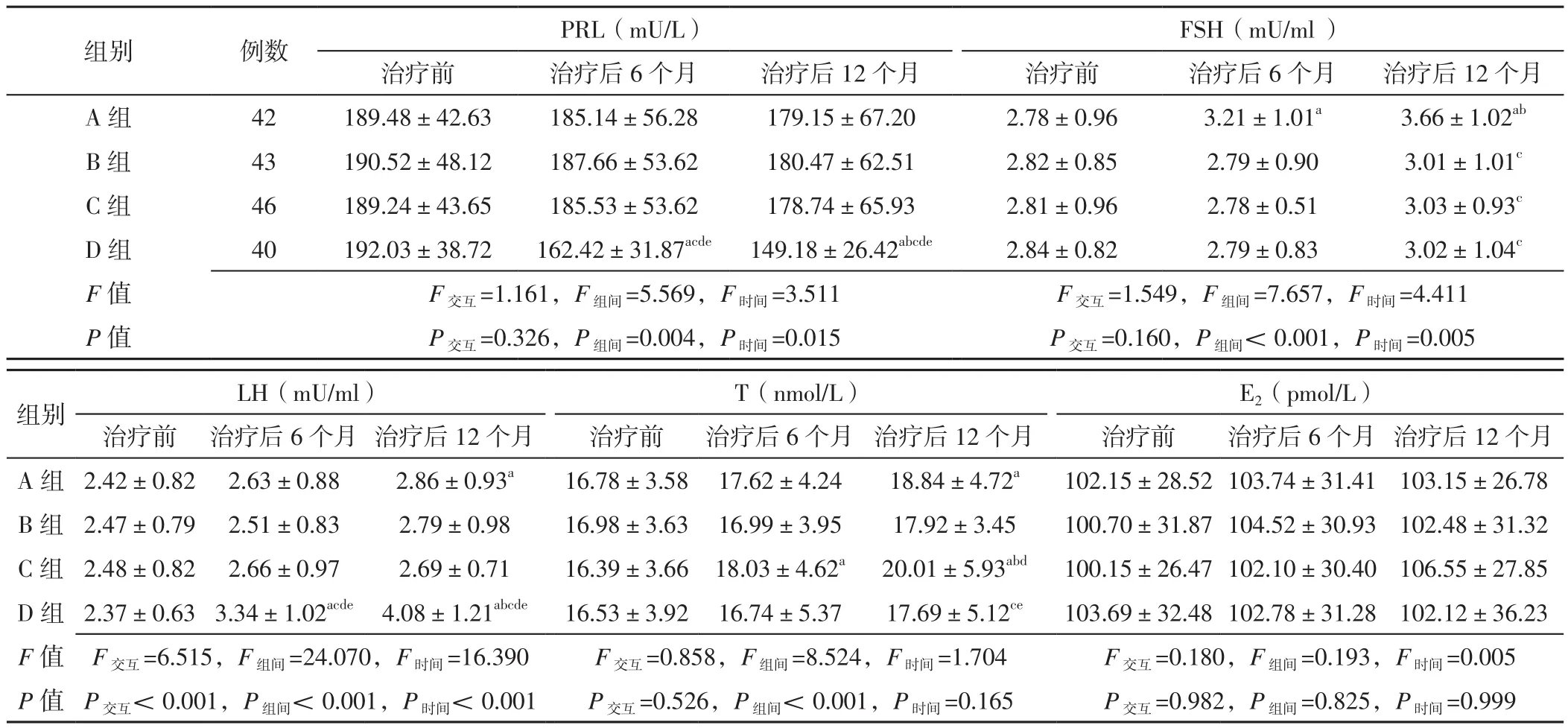
表2 四组患者治疗前及治疗后6、12个月性激素水平比较(±s)Table 2 Comparison of sex hormone level in the four groups before treatment and 6,12 months after treatment
注:与本组治疗前比较,aP<0.05;与本组治疗后6个月比较,bP<0.05;与A组比较,cP<0.05;与B组比较,dP<0.05;与C组比较,eP<0.05;PRL=催乳素,FSH=卵泡刺激素,LH=促黄体生成素,T=睾酮,E2=雌二醇
组别 例数 PRL(mU/L)FSH(mU/ml )治疗前 治疗后6个月 治疗后12个月 治疗前 治疗后6个月 治疗后12个月A 组 42 189.48±42.63 185.14±56.28 179.15±67.20 2.78±0.96 3.21±1.01a 3.66±1.02ab B 组 43 190.52±48.12 187.66±53.62 180.47±62.51 2.82±0.85 2.79±0.90 3.01±1.01c C 组 46 189.24±43.65 185.53±53.62 178.74±65.93 2.81±0.96 2.78±0.51 3.03±0.93c D 组 40 192.03±38.72 162.42±31.87acde 149.18±26.42abcde 2.84±0.82 2.79±0.83 3.02±1.04c F 值 F交互=1.161,F组间=5.569,F时间=3.511 F交互=1.549,F组间=7.657,F时间=4.411 P 值 P交互=0.326,P组间=0.004,P时间=0.015 P交互=0.160,P组间< 0.001,P时间=0.005组别 LH(mU/ml) T(nmol/L) E2(pmol/L)治疗前 治疗后6个月 治疗后12个月 治疗前 治疗后6个月 治疗后12个月 治疗前 治疗后6个月 治疗后12个月A 组 2.42±0.82 2.63±0.88 2.86±0.93a 16.78±3.58 17.62±4.24 18.84±4.72a 102.15±28.52 103.74±31.41 103.15±26.78 B 组 2.47±0.79 2.51±0.83 2.79±0.98 16.98±3.63 16.99±3.95 17.92±3.45 100.70±31.87 104.52±30.93 102.48±31.32 C 组 2.48±0.82 2.66±0.97 2.69±0.71 16.39±3.66 18.03±4.62a 20.01±5.93abd 100.15±26.47 102.10±30.40 106.55±27.85 D 组 2.37±0.63 3.34±1.02acde 4.08±1.21abcde 16.53±3.92 16.74±5.37 17.69±5.12ce 103.69±32.48 102.78±31.28 102.12±36.23 F值 F交互=6.515,F组间=24.070,F时间=16.390 F交互=0.858,F组间=8.524,F时间=1.704 F交互=0.180,F组间=0.193,F时间=0.005 P值 P交互<0.001,P组间<0.001,P时间<0.001 P交互=0.526,P组间< 0.001,P时间=0.165 P交互=0.982,P组间=0.825,P时间=0.999
2.3 四组患者治疗前及治疗后6、12个月IIEF-5评分、PEDT评分比较 时间与治疗方法在IIEF-5评分、PEDT评分上存在交互作用(P<0.05);治疗方法、时间在IIEF-5评分、PEDT评分上主效应均显著(P<0.05)。A、B组患者治疗后6、12个月IIEF-5评分分别高于本组治疗前,PEDT评分分别低于本组治疗前,差异有统计学意义(P<0.05);D组患者治疗后6、12个月IIEF-5评分分别低于本组治疗前,PEDT评分分别高于本组治疗前,差异有统计学意义(P<0.05);A、B组患者治疗后12个月IIEF-5评分分别高于本组治疗后6个月,PEDT评分分别低于本组治疗治疗后6个月,差异有统计学意义(P<0.05);D组患者治疗后12个月IIEF-5评分低于本组治疗后6个月,PEDT评分高于本组治疗后6个月,差异有统计学意义(P<0.05)。B、C、D组患者治疗后6、12个月IIEF-5评分低于A组,PEDT评分高于A组,差异有统计学意义(P<0.05)。C、D组患者治疗后6、12个月IIEF-5评分低于B组,PEDT评分高于B组,差异有统计学意义(P<0.05)。D组患者治疗后6、12个月IIEF-5评分低于C组,PEDT评分高于C组,差异有统计学意义(P<0.05),见表3。
表3 四组患者治疗前及治疗后6、12个月IIEF-5评分、PEDT评分比较(±s,分)Table 3 Comparison of scores of IIEF-5,PEDT in the four groups before treatment and 6,12 months after treatment
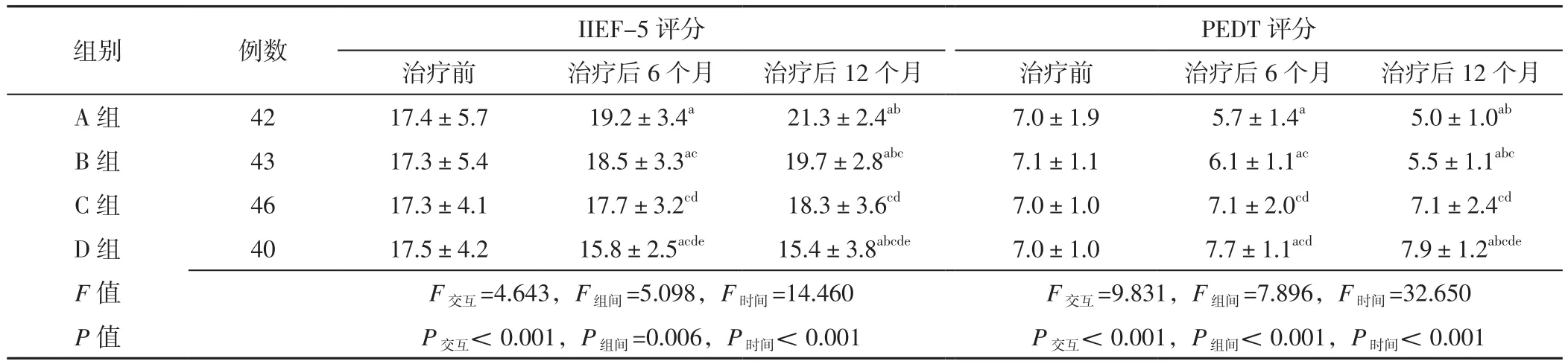
表3 四组患者治疗前及治疗后6、12个月IIEF-5评分、PEDT评分比较(±s,分)Table 3 Comparison of scores of IIEF-5,PEDT in the four groups before treatment and 6,12 months after treatment
注:与本组治疗前比较,aP<0.05;与本组治疗后6个月比较,bP<0.05;与A组比较,cP<0.05;与B组比较,dP<0.05;与C组比较,eP<0.05;IIEF-5=国际勃起功能指数5,PEDT=早泄诊断工具
PEDT评分治疗前 治疗后6个月 治疗后12个月 治疗前 治疗后6个月 治疗后12个月A 组 42 17.4±5.7 19.2±3.4a 21.3±2.4ab 7.0±1.9 5.7±1.4a 5.0±1.0ab B 组 43 17.3±5.4 18.5±3.3ac 19.7±2.8abc 7.1±1.1 6.1±1.1ac 5.5±1.1abc C 组 46 17.3±4.1 17.7±3.2cd 18.3±3.6cd 7.0±1.0 7.1±2.0cd 7.1±2.4cd D 组 40 17.5±4.2 15.8±2.5acde 15.4±3.8abcde 7.0±1.0 7.7±1.1acd 7.9±1.2abcde F 值 F交互=4.643,F组间=5.098,F时间=14.460 F交互=9.831,F组间=7.896,F时间=32.650 P 值 P交互<0.001,P组间=0.006,P时间<0.001 P交互<0.001,P组间< 0.001,P时间< 0.001组别 例数 IIEF-5评分
3 讨论
男性癫痫患病率高于女性,且更易出现生殖内分泌系统障碍[9]。男性癫痫患者性功能障碍发生率高于30%,性功能减退风险是健康人群的5倍,生育率低于健康人群的30%,这与疾病本身、患者的心理生理状况、抗癫痫治疗手段等诸多因素有关[10]。目前,临床针对癫痫仍以药物治疗为主,AEDs包括肝酶诱导型AEDs、肝酶抑制型AEDs、新型AEDs等。肝酶诱导型AEDs需要诱导肝P450酶系统,促进性激素结合球蛋白,促使T向E2转化,降低T水平,通过负反馈调节来影响下丘脑-垂体-性腺轴功能,进而影响性激素水平及生殖功能[11]。肝酶抑制型AEDs也被证实可通过影响促性腺激素释放激素的免疫调节系统而影响LH和FSH等性激素水平,进而影响患者的生殖功能[12-13]。以奥卡西平、拉莫三嗪、左乙拉西坦、托吡酯为代表的新型AEDs已逐渐应用于临床,其除可导致肝肾功能损伤等不良反应外,长期服用新型AEDs是否会影响生殖功能成为男性癫痫患者及其家属关注的重点问题,尤其是有生育需求者。
奥卡西平可通过抑制电压依赖性的钠离子通道、增加细胞钾离子通道传导性来调节高电位进而激活钙离子通道。有研究表明,奥卡西平作用于下丘脑促性腺激素释放激素(GnRH)神经元时可激发下丘脑释放促性腺激素释放激素,从而促进垂体分泌并释放大量的FSH、LH,LH水平升高可促使睾丸合成大量T,提高人体的兴奋性,从而改善性功能[14]。本研究结果显示,A组患者治疗后6、12个月FSH水平及治疗后12个月LH、T水平分别高于本组治疗前,治疗后12个月FSH水平高于本组治疗后6个月,治疗后12个月IIEF-5评分分别高于本组治疗前及治疗后6个月,PEDT评分分别低于本组治疗前及治疗后6个月,与LUEF等[15]研究结果一致,可见奥卡西平可有效改善新诊断青年男性癫痫患者的性激素水平,进而改善性功能。
本研究结果显示,B组患者治疗前及治疗后6、12个月性激素水平比较差异无统计学意义,但B组患者治疗后12个月IIEF-5评分分别高于本组治疗前及治疗后6个月,PEDT评分分别低于本组治疗前及治疗后6个月。拉莫三嗪可通过选择性阻断神经元钠离子通道,抑制突触前膜兴奋递质(丙氨酸氨基转移酶、天冬氨酸氨基转移酶)释放,减少大脑异常放电,进而控制癫痫发作,还可稳定情绪[16],这可能是本研究B组患者治疗后性激素水平无明显改变而性功能改善的原因。
左乙拉西坦是一种吡咯烷酮类衍生物AEDS,可通过与脑内突触囊泡蛋白2A结合而抑制痫性放电及高电压激活的钙离子通道,下调γ-氨基丁酸(GABA)受体。本研究结果显示,C组患者治疗后6、12个月T水平分别高于本组治疗前,治疗后12个月T水平高于本组治疗后6个月,但C组患者治疗前与治疗后6、12个月IIEF-5评分、PEDT评分间比较无统计学差异,表明左乙拉西坦可影响新诊断青年男性癫痫患者T水平,但其对性功能的影响不大。有研究发现,长期服用左乙拉西坦可影响T水平,但对其他性激素影响不大[17],本研究结果与之一致。另有研究表明,长期服用左乙拉西坦可影响甲状腺激素水平,诱发甲状腺功能亢进,使患者出现焦虑、脾气暴躁、兴奋、易激动等情绪,进而影响性功能[18]。但本研究未监测新诊断青年男性癫痫患者甲状腺激素水平,且样本量较小,后续还需扩大样本量,同时监测甲状腺激素水平以获得更准确的结果。
托吡酯是一种氨基磺酸酯取代的单糖,可阻断钠离子通道,在GABA受体非苯二氮卓位点上增加γ-GABA活性,通过下丘脑-垂体-性腺轴而影响垂体和性腺的生理功能,进而参与激素的分泌调节。GABA是垂体分泌LH的促进因子,同时是PRL分泌的抑制因子,而托吡酯可通过增加GABA活性而导致PRL水平下降、LH水平升高,PRL水平下降又可通过负反馈机制促进下丘脑对GnRH的分泌,导致FSH、LH水平升高,进而增加人体兴奋性,改善性功能[13]。其次,AEDs改善癫痫症状后,患者心理精神状态及性激素水平也会相应改善。本研究结果显示,D组患者治疗后6、12个月PRL水平分别低于本组治疗前,LH水平分别高于本组治疗前;D组患者治疗后12个月PRL水平低于本组治疗后6个月,LH水平高于本组治疗后6个月;D组患者治疗后12个月IIEF-5评分分别低于本组治疗前及治疗后6个月,PEDT评分分别高于本组治疗前及治疗后6个月,与刘津毓等[19]研究结果一致,分析原因可能与托吡酯的药理作用有关:一方面,托吡酯可通过抑制碳酸酐酶活性而干扰血管活性肠肽和一氧化氮生成,降低海绵体充血量,进而影响性功能[20];另一方面,托吡酯可拮抗α-氨基-3-羟基-5-甲基-4-异恶唑丙酸(AMPA)受体拮抗位点,降低神经元兴奋性,进而导致性功能障碍[21]。
本研究结果还显示,B、C、D组患者治疗后12个月FSH水平低于A组,C组患者治疗后12个月T水平高于B组,D组患者治疗后6、12个月PRL水平低于A、B、C组,LH水平高于A、B、C组;D组患者治疗后12个月T水平低于A、C组。B、C、D组患者治疗后6、12个月IIEF-5评分低于A组,PEDT评分高于A组;C、D组患者治疗后6、12个月IIEF-5评分低于B组,PEDT评分高于B组;D组患者治疗后6、12个月IIEF-5评分低于C组,PEDT评分高于C组。提示对有生育需求的青年男性癫痫患者可优先考虑采用奥卡西平治疗。
综上所述,针对新诊断青年男性癫痫患者,奥卡西平可升高其FSH、LH、T水平,进而改善性功能;拉莫三嗪对其性激素可能无影响,但对性功能有一定改善作用;左乙拉西坦可升高其T水平,但对性功能可能无影响;托吡酯可降低其PRL水平、升高其LH水平,可能会引起性功能下降或性功能障碍。因此,建议有生育需求的青年男性癫痫患者优先考虑采用奥卡西平治疗。但本研究仅随访了12个月,且样本量较小,结论可能存在偏倚,后续需扩大样本量、延长随访时间来进一步明确新型AEDs对青年男性癫痫患者性激素及性功能的影响。
作者贡献:凌秀明进行文章的构思与设计,撰写论文,进行论文的修订,负责文章的质量控制及审校,并对文章整体负责、监督管理;凌秀明、龙海、秦培英、潘明明、李星虹、邓海英进行研究的实施与可行性分析,数据收集、整理、分析;凌秀明、龙海进行结果分析与解释。
本文无利益冲突。
