晚期糖基化终末产物抑制大鼠外周血单个核细胞及成骨细胞增殖的作用机制
2021-04-22洪天配王浩杰高展翼
李 峥,王 霄△,洪天配,王浩杰,高展翼,万 蒙
(北京大学第三医院 1.口腔科,2.内分泌科,北京 100191)
糖尿病和牙周病在全球范围内均属于与生活方式相关的慢性疾病[1],一系列流行病学研究以及在此基础上进行的Meta分析均支持糖尿病可影响牙周组织健康的结论[2-4],其比较经典的病因学解释如下[5]:(1)伴随着血糖水平的升高,口腔内唾液和龈沟液葡萄糖水平也相应增加,牙周袋内菌斑生物膜可受此影响,导致位于袋底的厌氧菌群过度活跃生长,从而诱导和加剧局部牙周组织的炎症反应;(2)高血糖状况下,晚期糖基化终末产物(advanced glycation end products,AGEs)合成增加,或者直接影响正常蛋白质功能,或者与不同细胞膜表面AGEs受体(receptor for AGEs,RAGE)结合,级联表达各种细胞因子和生长因子,从而介导包括牙周组织在内的结缔组织降解的发生;(3)糖尿病患者牙周组织和龈沟液内基质金属蛋白酶表达的增加,会加重牙周组织破坏程度并降低组织修复能力。上述致病机制可与龈下菌斑生物膜生态系改变以及糖尿病相关性肥胖和血脂异常所导致的脂肪细胞因子分泌增加发挥协同作用[6],最终导致牙周组织代谢平衡丧失,表现为牙周组织破坏增加、组织修复功能损伤,即造成进展期的牙周组织炎症。牙周炎病理表现涉及牙周软硬组织丧失,包括结缔组织胶原纤维降解以及牙槽骨吸收与改建,与机体的免疫反应以及骨调节机制紧密相关。AGEs作为糖尿病特征性表达,在高血糖引发的病理生理过程中处于核心地位。
本研究以高血糖状况下特征性的AGEs/RAGE作用轴为出发点,设计体外细胞实验,检测AGEs对体外分离培养的大鼠下颌成骨细胞(osteoblasts,OB)以及大鼠外周血单个核细胞(peripheral blood mononuclear cells,PBMCs)增殖的影响,探索AGEs/RAGE作用轴中核因子κB(nuclear factor-kappa B,NF-κB)、磷脂酰肌醇3-激酶(phosphatidylinositol 3-kinase,PI3K)/蛋白激酶B(protein kinase B,PKB/Akt)及丝裂原活化蛋白激酶(mitogen-activated protein kinase,MAPK)信号通路的作用机制。
1 材料与方法
1.1 试剂与材料
DMEM细胞培养基、胎牛血清、胰蛋白酶、Ⅰ型胶原酶、青霉素、链霉素、Trizol均购自赛默飞世尔科技(中国)有限公司,逆转录及qR-TPCR试剂购自天根生物科技有限公司。总蛋白及核蛋白提取试剂盒购自碧云天生物技术有限公司,BCA蛋白定量试剂盒购自凯基生物技术有限公司,酶联免疫吸附测定(enzyme linked immunosorbent assay,ELISA)试剂盒购自北京中山金桥生物技术有限公司。实验所涉及的一抗、二抗均购自美国Abcam公司。
1.2 AGEs试剂的配制
取牛血清白蛋白(bovine serum albumin,BSA,50 g/L)2.5 g、D-葡萄糖(500 mmol/L)4.045 g、青霉素(100 IU/mL)0.003 g、链霉素(100 IU/mL)0.005 g、苯甲基磺酰氟(1.5 mmol/L)0.013 g、乙二胺四乙酸二钠(0.5 mmol/L)0.009 g,使用磷酸盐缓冲液[phosphate buffered saline(PBS), 0.2 mmol/L,pH 7.4]充分溶解后定容至50 mL,经0.22 μm滤膜过滤除菌后置于无菌试管中。在同一条件下配制不含D-葡萄糖的BSA溶液作为对照。将无菌试管中配置完成的AGEs/BSA溶液封口后,置于37 ℃恒温培养箱内避光孵育90 d获取棕色产物。孵育结束后经PBS透析48 h,以除去未与BSA结合的D-葡萄糖,再经0.22 μm滤膜过滤除菌,-20 ℃冰箱保存备用。根据AGEs特有的荧光特性(370 nm波长的激发光可激发产生440 nm发射波长的荧光),采用FLX-800型荧光分光光度计测定荧光值,鉴定AGEs/BSA和对照物。
1.3 PBMCs 的体外培养
1.3.1PBMCs的原代培养 按照单个核细胞分离试剂盒的步骤进行操作。取大鼠新鲜全血2 mL,乙二胺四乙酸(ethylene diamine tetraacetic acid,EDTA)抗凝,PBS等体积稀释,室温差速离心25 min后出现明显分层,将第二层与第三层小心吸取至15 mL新的无菌离心管中,加入10 mL洗涤液,颠倒混匀,再次离心10 min,弃上清。5 mL洗涤液重悬细胞后重复离心,弃上清,用细胞培养基重悬,计数。每个培养瓶中约106个/mL细胞进行培养,4 h后换新的培养基,此时的贴壁细胞即为单个核细胞。
1.3.2PBMCs后续实验的分组培养 将细胞传代至第3代作为实验用细胞,接种于96孔板中。实验分为3组,具体如下:第1组为0.25 g/L AGEs作用组;第2组为AGEs+NF-κB通路阻断剂(Bay117082)组,先用阻断剂处理细胞0.5 h,再用0.25 g/L AGEs处理;第3组为空白对照。4 h后采用ELISA方法测定肿瘤坏死因子α(tumor necrosis factor α,TNF-α)、白细胞介素-1β(interleukin-1β,IL-1β)表达,Western blot测定NF-κB p65磷酸化水平。
1.4 OB的体外培养
1.4.1OB的原代培养 无菌条件下取出3周龄SD大鼠的下颌骨,置入冷PBS中,尽量剔除附着的结缔组织。用PBS清洗3次,置入盛有DMEM培养基的培养皿中,剪成0.5 mm×0.5 mm的小块,约30块,加入0.25%(质量分数)胰蛋白酶5 mL,置入孵箱中消化。20 min后血清终止消化,弃上清液,加入1.0 g/L Ⅰ型胶原酶10 mL,置于孵箱中再次消化。90 min后,1 000 r/min离心10 min,去上清,用PBS洗涤细胞2次,200目滤网过滤去除碎骨片。使用含10%(体积分数)的胎牛血清、100 U/mL青霉素、100 mg/L链霉素的DMEM培养基重悬细胞,吹打均匀后,接种至多个25 cm2的培养瓶,放于37 ℃、5%(体积分数)CO2的恒温培养箱,培养48 h后换液,以后隔日换液,待细胞长至80%融合时进行传代培养,培养至第3代用于后续实验。
1.4.2OB后续实验的分组培养 待OB状态良好时,分3组处理细胞,第1组用AGEs刺激细胞,分别在培养30 min、12 h、1 d、3 d、5 d时收集细胞;第2组在AGEs刺激前加入JNK抑制剂(SP600125),分别在培养24 h和48 h时收集细胞;第3组在AGEs刺激前加入p38 MAPK抑制剂(SB203580),分别在培养24 h和48 h时收集细胞。其中AGEs的刺激浓度均为0.25 g/L,均设置空白对照组。将每次收集的细胞分为两份,一份进行qRT-PCR实验,在mRNA水平检测NF-κB p65、IκB、p38、JNK的表达变化;另一份进行Western blot蛋白电泳实验,在蛋白水平检测NF-κB p65、IκB、p38、JNK磷酸化以及非磷酸化的表达变化。
1.5 钙化结节(茜素红法)染色
尽量弃去OB培养瓶中的上清液,PBS清洗2次,70%(体积分数)乙醇固定60 min后用蒸馏水小心清洗3次。在培养瓶中加入1 mL配制好的0.1%(质量分数)茜红素(pH 8.3)进行细胞染色,将其放入37 ℃的细胞培养箱中孵育,30 min后取出细胞,再次用蒸馏水清洗,在显微镜下进行钙化结节观察并照相。
1.6 碱性磷酸酶染色
将OB接种到细胞爬片上,培养7 d后用95%(体积分数)乙醇固定15 min,用Gomori钙钴法进行碱性磷酸酶(alkaline phosphatase,ALP)染色:将固定好的盖玻片经蒸馏水漂洗后,入孵育液[3%(质量分数)β-甘油磷酸钠5 mL,2%(质量分数)巴比妥钠5 mL,2%(质量分数)硝酸钙10 mL,2%(质量分数)硫酸镁 5 mL,蒸馏水25 mL],37 ℃孵育2 h,清水冲洗数次,然后在2%(质量分数)硝酸钴中孵育1 min,冲洗,自然干燥,封固,倒置显微镜下观察拍照。
1.7 CCK-8
取第3代处于对数生长期的OB、PBMCs,按每孔5×105个细胞进行种植。AGEs设置5个浓度梯度,分别为2、1、0.5、0.25、0.125 g/L。相同条件设BSA对照组,每组均设4个重复,置于37 ℃、5%CO2培养箱中培养。分别在24、48、72 h进行CCK-8检测。酶标仪检测450 nm处光密度值,并计算IC50。
1.8 qRT-PCR
总RNA提取采用Trizol法,按照逆转录试剂盒说明书步骤将RNA逆转录为cDNA。qRT-PCR过程及相关程序参考说明书,相关引物序列见表1。采用2-ΔΔCt法进行目的基因相对定量分析。

表1 qRT-PCR引物序列Table 1 Primer sequences used for qRT-PCR
1.9 Western blot
蛋白的提取以及定量均按照试剂盒说明书进行。80 V恒压电泳30 min后,改为120 V恒压分离;300 mA恒流转膜1 h。5%(质量分数)脱脂牛奶室温封闭1.5 h。一抗、二抗均按照说明书推荐的最佳浓度进行稀释,一抗4 ℃孵育过夜,二抗放置摇床室温1 h,TBST缓冲液洗3遍后显色曝光,拍照分析。采用Tanon Gis软件测定胶片电泳条带灰度值,定量分析蛋白水平变化。
1.10 统计分析
2 结果
2.1 AGEs试剂鉴定
将AGEs原液(图1A)稀释到原来体积的1/100,采用荧光分光光度计。在激发波长370 nm处测定荧光强度,发射波长440 nm处出现最大吸收峰。结果显示,分析图谱吸收峰单一,AGEs的峰与对照组相比有明显差异,其中AGEs溶液的荧光强度为88.56 U/mg,对照BSA溶液的荧光强度为2.34 U/mg(图1B),符合AGEs自发荧光特征,表明本实验所用AGEs配制成功。
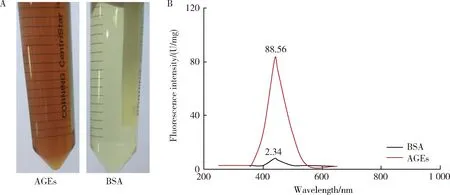
AGEs, advanced glycation end products; BSA, bovine serum albumin.图1 制备的AGEs溶液和对照BSA溶液(A)及其对应的荧光光谱(B)Figure 1 The prepared AGEs and BSA reagents (A),analysis of BSA and AGEs by fluorescence spectrophotometer (B)
2.2 PBMCs的体外培养及鉴定
体外培养原代及第3代PBMCs,显微镜下观察其形态呈典型贴壁细胞,细胞伸展,粘附牢固,呈规则圆形,生长状态良好,无明显增殖表现,符合PBMCs的特征(图2)。
2.3 OB体外培养及鉴定
体外培养原代及第3代OB,原代OB从骨板爬出生长,24 h细胞开始贴壁,48 h完全贴壁,细胞为单核,呈多角形或梭形,约1周后细胞融合成铺路石样(图3A、B)。对OB进行茜素红染色呈阳性,可见细胞内多个红染的钙化结节(图3C);ALP染色呈阳性,可见胞浆内ALP与显色剂结合后的棕黑色颗粒(图3D)。
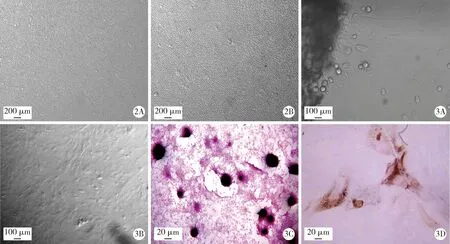
图2 光学显微镜下原代(A)及第3代(B)PBMCs的形态 图3 原代(A)及第3代(B)培养的成骨细胞OB及其茜素红染色(C)和ALP染色(D)Figure 2 The cultured PBMCs of the primary (A) and the third generation (B), observed by optical microscope Figure 3 The cultured OB of the primary (A) and the third generation (B) and the staining of alizarin red (C) and ALP (D)
2.4 AGEs对PBMCs、OB增殖活力的影响
不同浓度AGEs分别作用PBMCs和OB 48 h,光学显微镜下观察发现PBMCs、OB的细胞存活量及细胞状态随着AGEs作用浓度的增加而逐渐降低(图4A、B)。CCK-8检测发现PBMCs在培养24、48、72 h时, OB在培养48、72 h时细胞活力随AGEs作用浓度的增加而逐渐降低(图4C、D),与未处理对照组相比差异有统计学意义(P<0.001),该检测结果与光学显微镜下的变化趋势一致。重复测量的GLM分析表明,两种细胞的活力与AGEs的浓度、作用时间以及二者交互作用均显著相关(P<0.001),且当AGEs作用浓度超过0.5 g/L时两种细胞活力均随作用时间延长而显著下降(图4E、F)。这一结果提示,考虑到AGEs对细胞增殖的影响,应选择既能最大化刺激细胞,又不造成过半细胞杀伤的作用浓度值,因此,本研究选择AGEs的作用浓度为0.25 g/L,该浓度对PBMCs和OB均适宜。
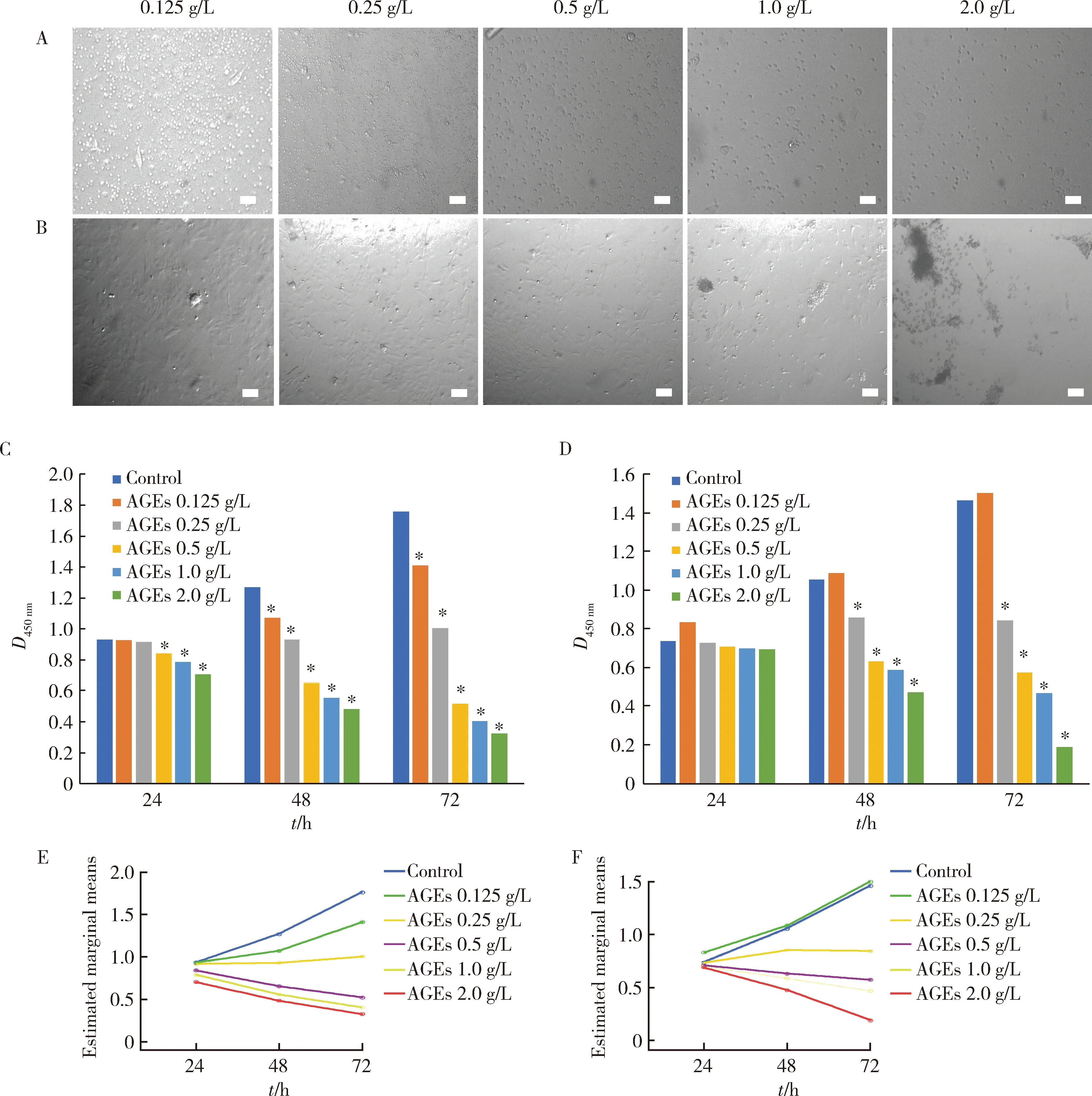
A, B, scale bar is 200 μm. *P<0.001, vs. control; AGEs, advanced glycation end products. E, PBMCs: Times, P=0.001; Concentrations, P<0.001; Time×Concentration, P<0.001 (GLM, F value: 14.1-1 851.4). F, OB: Times, P<0.001; Concentrations: P<0.001; Time×Concentration, P<0.001 (GLM, F: 64.4-373.1).图4 不同浓度AGEs干预48 h时,光学显微镜观察PBMCs(A)、OB(B)的细胞形态;CCK-8检测不同浓度AGEs作用24、48、72 h时对PBMCs(C)、OB(D)细胞活力的影响,及浓度与作用时间交互作用的相关性(E、F) Figure 4 The AGEs stimulated cell morphology of PBMCs (A) and OB (B) observed by optical microscope for 48 h; the effects of AGEs at different concentrations for 24, 48, 72 h on cell PBMCs (C) and OB (D) viability and the interaction (E, F) between different concentrations and action times by CCK-8 test
2.5 NF-κB信号通路在AGEs干预PBMCs后的作用机制
0.25 g/L AGEs作用于PBMCs,Western blot结果显示,与对照组相比,NF-κB p65的蛋白表达量显著增加(P<0.01,图5A)。同时,ELISA结果发现TNF-α、IL-1β含量均显著增加(P<0.01),当加入NF-κB信号通路阻断剂后,TNF-α、IL-1β水平均显著降低(P<0.01,图5B)。
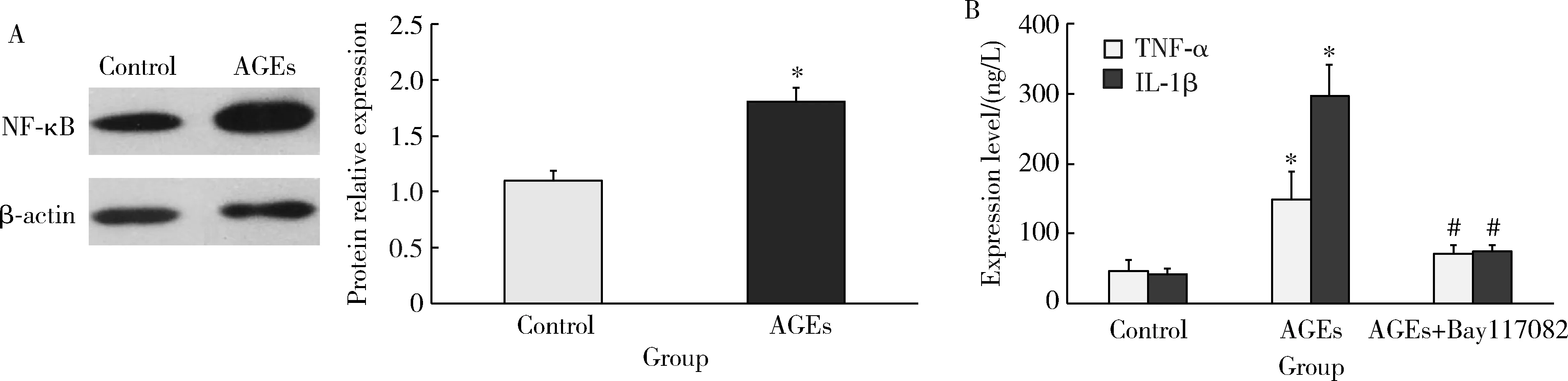
* P<0.01, vs. control; # P<0.01, vs. AGEs group. Bay117082, NF-κB signaling pathway inhibitor.图5 AGEs作用于PBMCs后,Western blot检测NF-κB p65的表达(A),ELISA检测TNF-α、IL-1β的含量变化(B)Figure 5 NF-κB p65 expression examined by Western blot (A) and TNF-α and IL-1β level examined by ELISA (B) after AGEs treatment with PBMCs
2.6 JNK/p38、NF-κB、PI3K/PKB信号通路在AGEs干预OB后的作用机制
第1组细胞处理后,分别检测NF-κB p65、IκB、p38、JNK、Akt蛋白水平和mRNA水平的表达变化。Western blot结果显示,随作用时间延长,AGEs可使OB中NF-κB p65、JNK、p38磷酸化和非磷酸化蛋白显著升高(P<0.05),而IκB磷酸化蛋白表达显著升高的同时还伴有非磷酸化蛋白表达下降(P<0.01),Akt磷酸化及非磷酸化蛋白未见明显变化(P>0.05,图6A~E)。随AGEs作用时间延长,NF-κB p65、JNK、p38 在mRNA水平的表达显著升高,IκB mRNA表达显著下降,尤其在AGEs作用120 h时,而Akt mRNA表达并无明显变化(P>0.05,图6F)。
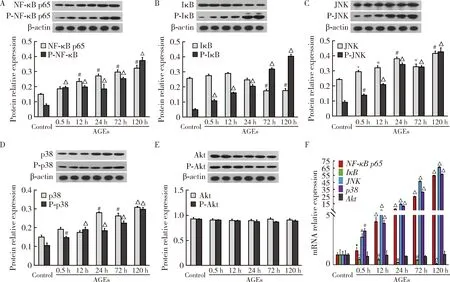
P-NF-κB p65, P-IκB, P-p38, P-JNK, P-Akt are the phosphorylation products of NF-κB p65, IκB, p38, JNK, Akt, respectively. *P<0.05, #P<0.01, △P<0.001, vs. control respectively.图6 AGEs作用于OB不同时间后,NF-κB、PI3K/PKB、MAPK信号通路相关基因的Western blot检测(A~E)和qRT-PCR检测(F)Figure 6 The related gene expression of NF-κB, PI3K/PKB, MAPK signaling pathways examined by Western blot (A-E) and qRT-PCR (F) after the AGEs stimulated OB
第2组、第3组细胞处理后,采用Western blot、qRT-PCR分别检测NF-κB p65、IκB、p38、JNK、Akt蛋白水平和mRNA水平的表达变化。Western blot结果显示,与只加入AGEs组相比,加入JNK抑制剂(图7A~E)、p38(图8A~E)抑制剂后,NF-κB p65、p38、JNK磷酸化和非磷酸化蛋白表达均显著降低,IκB磷酸化蛋白显著降低,而非磷酸化蛋白显著升高(P<0.05),Akt表达未见明显变化(P>0.05)。qRT-PCR结果显示,与只加入AGEs组相比,加入JNK通路阻断剂后的IκB表达显著升高(P<0.05),NF-κB p65、p38、JNK表达呈下降趋势,但差异不明显(P>0.05),Akt表达未见明显变化(P>0.05,图7F);加入p38信号通路阻断剂后,NF-κB p65、p38、JNK表达显著降低(P<0.05),IκB表达显著升高(P<0.05),Akt表达未见明显变化(P>0.05,图8F)。
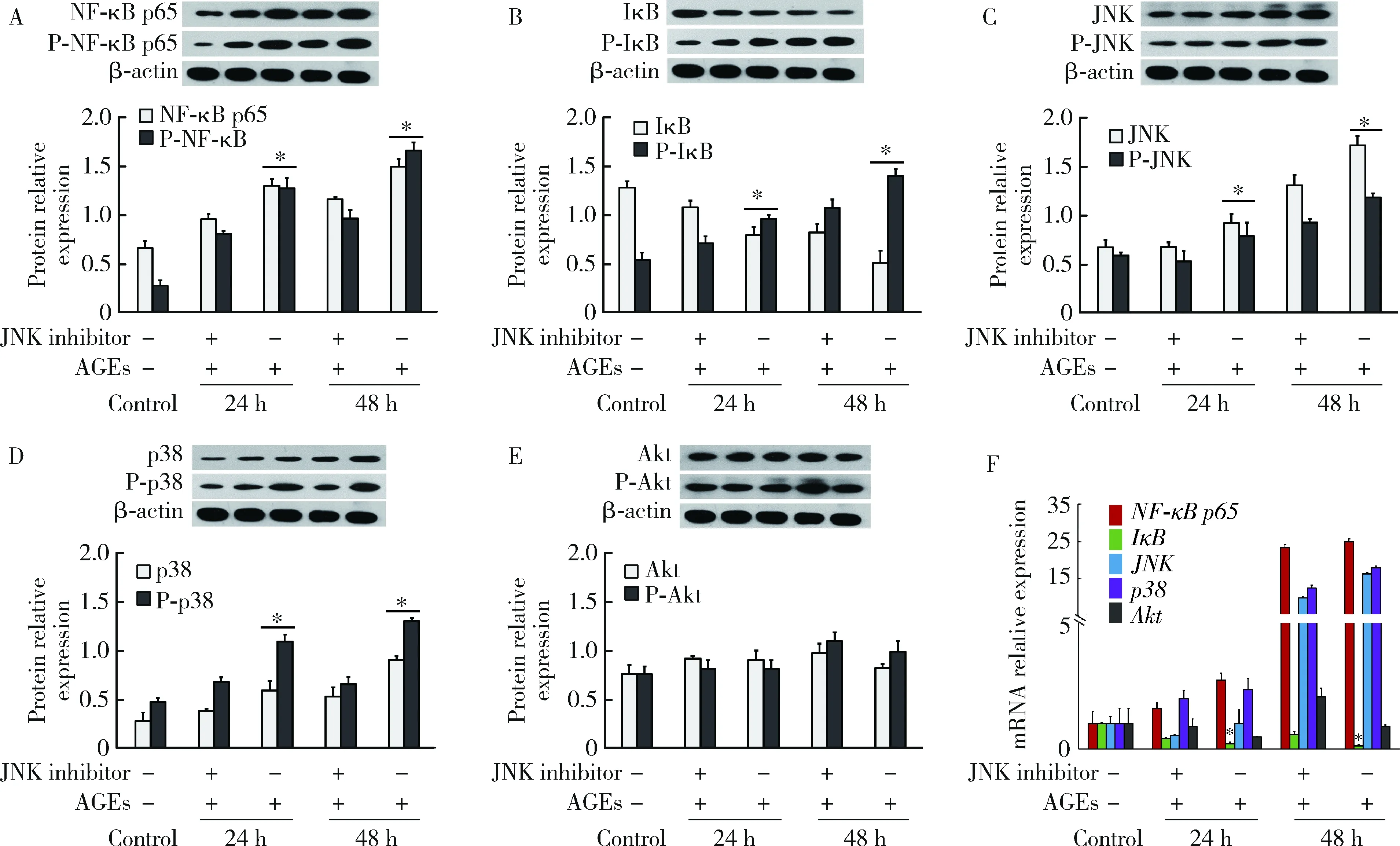
P-NF-κB p65, P-IκB, P-p38, P-JNK, P-Akt are the phosphorylation products of NF- κB p65, IκB, p38, JNK, Akt, respectively. *P<0.05, vs. JNK inhibitor at the same time.图7 加入JNK阻断剂后,AGEs对OB NF-κB、PI3K/PKB、MAPK信号通路相关基因的Western blot检测(A~E)和qRT-PCR检测(F)Figure 7 The related gene expression of NF-κB, PI3K/PKB, MAPK signaling pathways examined by Western blot (A-E) and qRT-PCR (F) after blocking by JNK inhibitor
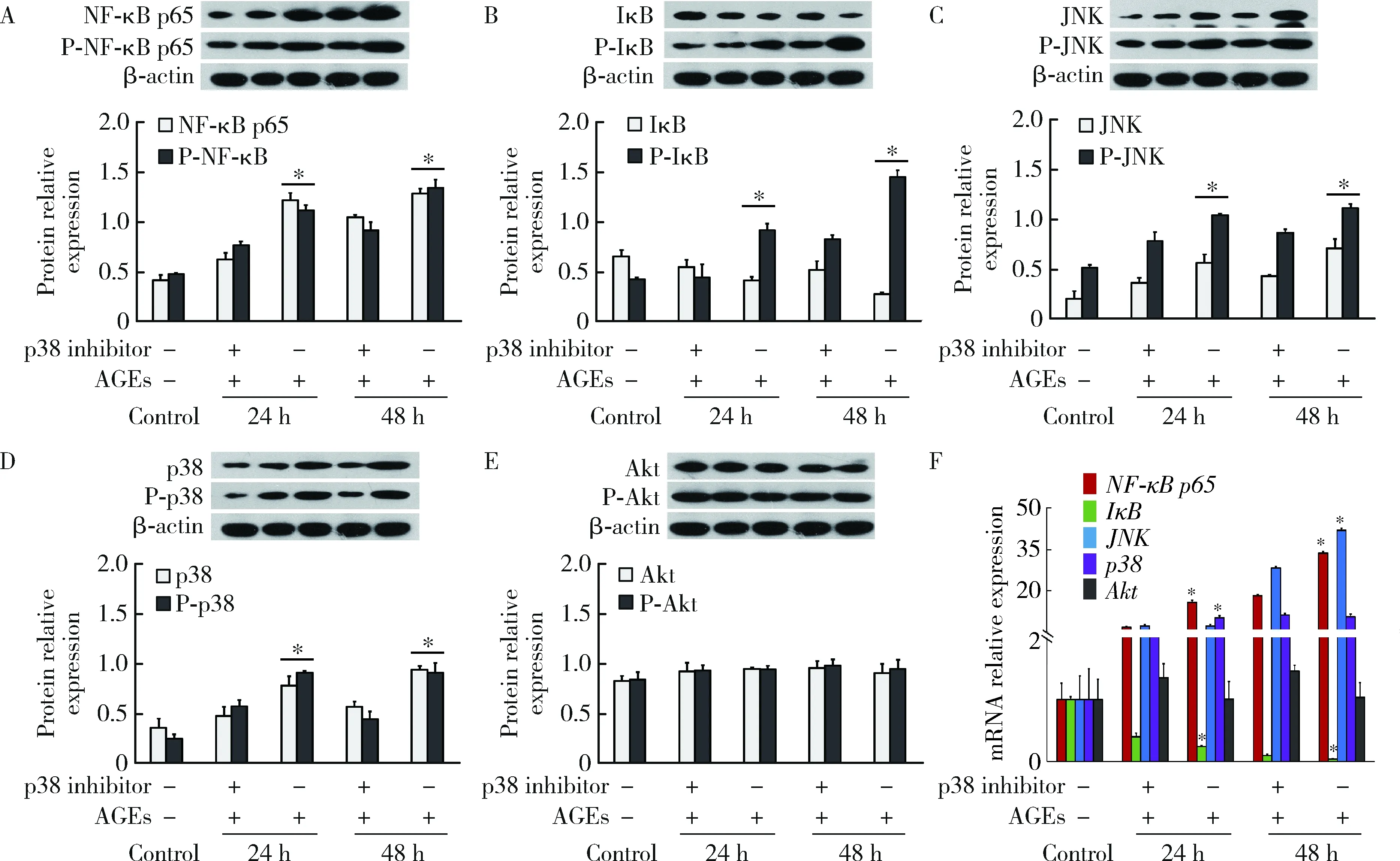
P-NF-κB p65, P-IκB, P-p38, P-JNK, P-Akt are the phosphorylation products of NF-κB p65, IκB, p38, JNK, Akt, respectively. *P<0.05, vs. p38 inhibitor at the same time.图8 加入p38阻断剂后,AGEs对OB NF-κB、PI3K/PKB、MAPK信号通路相关基因的Western blot检测(A~E)和qRT-PCR检测(F)Figure 8 The related gene expression of NF-κB, PI3K/PKB, MAPK signaling pathways examined by Western blot (A-E) and qRT-PCR (F) after blocking by p38 inhibitor
3 讨论
AGEs是通过非酶糖化反应途径,由还原性单糖的醛基或酮基与氨基酸、核酸或脂质等大分子中的氨基之间形成希夫(Schiff)键,再经缓慢而复杂的重排,最终形成的不可逆聚合物[7]。AGEs的作用机制复杂,包括由于糖基化修饰直接引起的蛋白质理化性质的改变,以及通过其受体及其他结合蛋白介导的发生在不同组织细胞的一系列间接病理变化[8]。RAGE是能与AGEs结合发挥其作用的重要受体分子之一,作为一种膜蛋白,其分为胞外域、跨膜区和胞内段,属于免疫球蛋白超家族成员[9]。RAGE在许多细胞表面都有表达,如单核细胞、巨噬细胞、内皮细胞、平滑肌细胞和成纤维细胞等,当细胞处于激活或应激状态时(高血糖、炎症),细胞RAGE表达显著增强。AGEs与RAGE作用后,能触发多种细胞信号转导途径,如NADPH氧化酶-活性氧通路、PKB/Akt通路、MAPK通路等,涉及细胞外信号调节酶ERK、p38、JNK等上游因子,进一步激活NF-κB级联发挥生物学作用[10]。另外,一些研究证实RAGE是一种类似于Toll样受体的模式识别受体,在炎症免疫性疾病中发挥重要作用[11],所以从免疫调节机制方面研究AGEs致病作用是一个崭新的课题。
本研究旨在检测糖尿病AGEs对PBMCs及OB增殖的影响,初步了解AGEs和RAGE相互作用在牙周免疫反应以及骨细胞代谢中的作用,并分析AGEs/RAGE作用轴中NF-κB信号通路及其上游PI3K/PKB、MAPK信号通路的作用机制。本研究证实,AGEs随作用浓度和时间的增加能够显著抑制PBMCs、OB的增殖。当AGEs作用浓度超过0.5 g/L时,细胞活力随作用时间增加而逐渐降低,这是本研究选取<0.5 g/L AGEs进行后续实验的依据。
我们首先关注了牙周炎症进展中处于一线防御地位的单核巨噬细胞在AGEs作用下的表现。AGEs与单核巨噬细胞的作用存在双重影响:一方面,单核巨噬细胞通过其细胞表面的RAGE,识别、内吞并降解清除AGEs;另一方面,AGEs可以诱导单核巨噬细胞的趋化性,当游离的单核巨噬细胞与组织中或血管壁上的AGEs结合后,可被激活,合成并释放血小板源生长因子、胰岛素样生长因子等生长因子以及IL-1、TNF-α等细胞因子,从而引起炎症反应并刺激细胞异常增殖[12]。本研究也部分证实了上述观点,即AGEs作用下,PBMCs中TNF-α、IL-1β分泌增加,同时伴有NF-κB表达增加,而在阻断NF-κB通路后,上述炎性细胞因子水平显著下降,证实了NF-κB信号通路参与AGEs致PBMCs加剧炎症反应的过程。未来还可进一步定位RAGE在单核细胞中的表达,并明确更多信号通路参与AGEs/RAGE轴作用的细胞内信号传导机制。
鉴于牙周炎症实质是牙槽骨的吸收,本研究接下来关注了AGEs对牙周OB以及骨髓基质细胞(结果另文发表)的影响,结果证实,0.25 g/L AGEs作用下,OB的NF-κB激活,其上游通路中JNK、p38磷酸化、非磷酸化蛋白表达增加,而Akt磷酸化及非磷酸化蛋白表达无差异,提示AGEs作用过程中JNK、p38参与调控,而与PI3K/PKB信号通路无关。另外,在这一过程中,IκB磷酸化蛋白增加验证了上述AGEs/RAGE介导的NF-κB激活机制[13]:AGEs刺激作用下,IκB发生磷酸化,NF-κB三聚体降解,释放NF-κB,级联发挥生物学作用。JNK和p38被称为“应激诱导”的MAPK,可被多种应激刺激激活,如脂多糖、炎症因子、渗透压改变、辐射等。JNK和p38可同时被JNK激酶1激活,这种交叉作用使两条通路在信号分子及生物学效应方面存在诸多相似性。本研究在OB的实验中也证实了上述观点,可以认为AGEs通过p38、JNK及下游NF-κB信号通路影响OB代谢。另外,鉴于p38信号通路阻断可使NF-κB p65表达显著减低,推断AGEs作用过程中p38信号通路相对JNK通路对OB的影响更为密切。再者,根据NF-κB、p38、JNK mRNA在阻断后表达明显降低,可以推断AGEs对OB的影响要弱于对具有干细胞分化潜能的骨髓基质细胞的作用(结果另文发表),这也为后续实验选择更为敏感的靶细胞提供了思路。PI3K/PKB信号作为RAGE下游的信号通路途径之一,是细胞内重要的信号转导途径,在细胞存活、凋亡中发挥重要作用[14]。本研究表明,AGEs干预OB后,Akt mRNA及蛋白水平表达并无明显规律性或显著性改变,提示AGEs并不通过PI3K/PKB通路影响OB中NF-κB的表达。
鉴于RAGE作为模式识别受体的一种新形式,会在炎症免疫应答中发挥重要作用,未来可进一步分析AGEs/RAGE轴对牙周炎症相关细胞的影响,着重研究不同靶细胞RAGE的分布及类型,通过使用可溶性RAGE、RAGE抗体或基因沉默等方法,结合信号通路分析,深入了解AGEs促进牙周组织炎症的作用及其机制,为疾病治疗及应用于临床提供思路。
