生物活性玻璃对人脐静脉血管内皮细胞增殖及成血管的作用
2021-04-22黄丽东宫玮玉董艳梅
黄丽东,宫玮玉,董艳梅
(北京大学口腔医学院·口腔医院,牙体牙髓科 国家口腔疾病临床医学研究中心 口腔数字化医疗技术和材料国家工程实验室 口腔数字医学北京市重点实验室, 北京 100081)
生物材料具有生物活性和生物降解性,能够刺激骨细胞产生应答反应,在诱导骨组织再生的同时被机体吸收,使缺损部位为新骨取代,因而作为植骨材料广泛应用于骨组织工程中[1-4]。然而,当用生物材料修复较大范围骨缺损时,常会出现新生组织的形成在外周区域多而中心区域缺乏的现象,究其原因主要是由于材料内部新生血管不足、中心部位缺血、组织无法获得持续的养分和氧气供给,使得新生组织无法形成或发生坏死[5]。在生物材料上植入血管内皮细胞、载荷促血管生长因子等方式可促进血管形成,但存在内皮细胞取材、培养和扩增周期长,生长因子在体内半衰期短等问题,无法达到理想的效果,因此,有必要寻找一种生物活性材料,具有良好的成骨作用,同时能够诱导血管内皮细胞向骨缺损区域和材料内部迁移,在骨缺损愈合过程中形成同步的再血管化。
生物活性玻璃具有良好的生物活性和骨诱导性,在临床应用中取得了较好的治疗效果[3, 6-9]。与羟基磷灰石、磷酸三钙等材料相比,生物活性玻璃具有骨诱导作用,能够刺激周围的间充质干细胞向成骨细胞分化,不仅支持新骨在骨-材料界面生长,还能诱导骨组织在材料内部、远离骨-材料界面的部位生长[10]。在成血管方面,生物活性玻璃及其离子溶出物能够促进成纤维细胞分泌血管内皮生长因子(vascular endothelial growth factor, VEGF)、碱性成纤维细胞生长因子(basic fibroblast growth factor, bFGF)等血管源性生长因子[11],诱导内皮细胞向骨缺损区域和材料内部迁移、增殖[12-13],形成脉管系统。体内研究[14-17]也表明,生物活性玻璃涂层复合材料具有促进血管生成的能力,但在一些研究中,生物活性玻璃未能表现出促进血管生成的作用,可能与材料的制备工艺、形貌结构及材料浓度等因素有关[18-20]。
随着制备工艺的改进与发展,生物活性玻璃的生物活性不断提高。溶胶-凝胶法制备的生物活性玻璃,颗粒形态和大小可控,比表面积增大,较第一代熔融法制备的45S5生物活性玻璃具有更高的生物活性[21]。以植酸为前驱体制备的生物活性玻璃(phytic acid derived bioactive P2O5-SiO2-CaO gel-glasses, PSC),是一种采用溶胶-凝胶法制备、具有我国自主知识产权的的新型生物活性玻璃,由中国科学院化学研究所制备[22]。植酸(分子式C6H18O24P6)是一种从植物种籽中提取的有机磷酸化合物,较传统的磷前驱体毒性小,且可使玻璃的制备过程不再需要400~600 ℃煅烧,提高了材料的生物相容性和生物活性。用PSC制备的可注射型复合骨水泥应用于兔股骨缺损修复,能够显著促进骨组织再生[23],显示PSC在骨组织修复领域具有较好的应用前景。然而,PSC在成血管方面是否具有良好的作用尚未得到证实,因此,本研究旨在观察PSC对人脐静脉血管内皮细胞(human umbilical vein endothelial cells, HUVECs)增殖、血管生长因子表达及体外成血管作用的影响,为PSC进一步应用于骨组织工程奠定基础。
1 材料与方法
1.1 材料与设备
主要试剂与材料:HUVECs购自美国ScienCell公司,达尔伯克氏改良伊格尔培养基(Dulbecco’s modified eagle medium, DMEM)、胎牛血清(fetal bovine serum, FBS)、青霉素/链霉素混合液、内皮细胞生长因子购自美国ScienCell公司,胰蛋白酶购自美国Gibco公司,甲基噻唑基四唑溶液[(4,5-dimethyl-thiazol-2-yl)2,5-diphenyltetrazolium bromide, MTT]购自美国Sigma公司,Trizol购自美国Invitrogen公司,FastStart Universal SYBR Green Master反转录试剂盒购自美国Roche公司,二甲基亚砜(dimethyl sulfoxide, DMSO)购自美国Ameresco公司,Matrigel基质胶购自美国BD公司,活细胞染色试剂盒购自美国Sigma公司,细胞培养皿等耗材购自美国Corning公司。
主要设备:酶标仪(ELX808)购自美国BioTek公司,实时定量PCR仪(StepOne Plus)购自美国ABI公司,倒置相差显微镜(Ts100)购自日本Nikon公司。
1.2 细胞培养
原代HUVECs培养于内皮细胞培养基(endothelial cell medium, ECM), 培养基成分(体积分数)为DMEM(93%)+FBS(5%)+内皮细胞生长因子(1%)+青霉素/链霉素(1%), 置于37 ℃、5%(体积分数)CO2恒温培养箱中培养。每2~3天换一次培养基,待细胞达80%~90%融合时消化传代,取5~7代细胞用于实验。
1.3 PSC浸提液的制备
PSC由中国科学院化学所邱东教授实验室制备[22],化学组成(质量分数)为P2O5(22.7%)、SiO2(48.2%)、CaO(29.1%),颗粒为无规则形态,平均粒径为(21±12) μm,比表面积为53.5 m2/g。
PSC浸提液的制备是将PSC粉末置于180 ℃恒温箱中高温干热灭菌4 h后,加入ECM,在37 ℃水平摇床中以100 r/m浸提24 h,用0.22 μm滤器过滤除菌,再加入5%FBS、1%内皮细胞生长因子和1%青霉素/链霉素制备成含有不同浓度(0.01、0.1、1和2 g/L)PSC浸提液的ECM[23]。
1.4 MTT检测HUVECs的增殖
用含有不同浓度(0、0.01、0.1、1和2 g/L)PSC浸提液的ECM培养HUVECs,采用MTT法比较其对HUVECs的增殖作用。细胞按密度3×103个/孔等量接种于96孔板中,每组5个复孔,37 ℃、5%CO2细胞孵育箱中孵育贴壁。24 h后,分别加入100 μL含不同浓度PSC浸提液的ECM,记为第0天,隔天换液。第1、3、5、7、10天,待测培养孔内加入180 μL新鲜ECM、20 μL 5 g/L MTT溶液,培养4 h后,每孔加入150 μL DMSO,置37 ℃摇床上振荡10 min至结晶物充分溶解。各孔溶液转移入新的96孔板,置于酶标仪内,以波长490 nm测定光密度值。实验重复3次,以培养时间为横坐标,平均光密度值为纵坐标绘制细胞增殖曲线。
1.5 实时反转录聚合酶链反应(real-time reverse transcription-polymerase chain reaction, real-time RT-PCR)检测HUVECs成血管基因VEGF、bFGF的表达
根据第1.4小节细胞增殖实验结果,选择最适于细胞生长的PSC浸提液浓度用于观察PSC对HUVECs分化的作用。采用real-time RT-PCR法检测血管生长因子VEGF、bFGF的基因表达情况。细胞分别按密度1×105、0.8×105、0.5×105个/孔接种于6孔板中,37 ℃、5%CO2细胞孵育箱中孵育贴壁。24 h后,按实验分组分别加入1 mL PSC浸提液或ECM,记为第0天,隔天换液。第2、4、7天用Trizol裂解细胞,提取总RNA。使用FastStart Universal SYBR Green Master反转录试剂盒,各组均用2.0 g总RNA在20 μL反应体系中进行反转录合成cDNA。目的基因为VEGF、bFGF,将管家基因GAPDH作为内参,引物序列见表1。Real-time RT-PCR为每管20 μL的扩增反应体系,95 ℃ 3 min预变性同时激活DNA聚合物,95 ℃变性3 s,60 ℃退火及延伸20 s,共40个循环。数据分析采用2-ΔΔCt法,实验重复3次。

表1 Real-time RT-PCR中成血管基因的引物序列Table 1 Primers of target genes for real-time RT-PCR
1.6 体外小管形成实验检测HUVECs的血管形成能力
根据第1.4小节细胞增殖实验结果,选择最适于细胞生长的PSC浸提液浓度,采用体外小管形成实验检测HUVECs形成血管的能力。将Matrigel基质胶4 ℃溶解,96孔板置于冰盒上,每孔加入50 μL基质胶。在37 ℃、5%CO2孵箱中放置30 min后,HUVECs分别重悬于PSC浸提液或ECM中,按每孔3 000个接种于基质胶上,避免产生气泡。第4、10小时使用活细胞染色试剂盒进行细胞染色,倒置相差显微镜下观察小管形成情况。每孔选取9个视野进行小管计数,应用Image J软件对小管数量进行统计学分析,实验重复3次。
1.7 统计学分析
采用SPSS 24.0软件进行统计学分析,采用单因素方差分析(ANOVA)分别对各组别细胞的增殖情况、血管生长因子基因表达情况、小管形成实验的成管数目进行总体分析,组间比较采用LSD检验,如果数据方差不齐则采用秩和检验(Kruskal-WallisHtest),P<0.05为差异具有统计学意义。
2 结果
2.1 PSC对HUVECs增殖的作用
用MTT法检测HUVECs在不同浓度PSC浸提液作用下的增殖情况(图1), 结果显示,含有0.1 g/L PSC浸提液组对细胞增殖的促进作用最为显著,其光密度值在第5、7天时高于ECM组,差异有统计学意义(P<0.001,P<0.001);含有1 g/L PSC浸提液组对细胞增殖也有一定的促进作用,光密度值在第5、7天高于ECM组,其中第5天的差异具有统计学意义(P<0.001), 但第7天时光密度值仍低于0.1 g/L组,差异有统计学意义(P=0.033);含有2 g/L PSC浸提液组对细胞的增殖呈现出一定的抑制作用,其第10天光密度值低于ECM组,差异有统计学意义(P=0.001); 0.01 g/L组在各时间点与ECM组的差异无统计学意义。

ECM, endothelial cell medium; PSC, phytic acid derived bioactive P2O5-SiO2-CaO gel-glasses; HUVECs, human umbilical vein endothelial cells. *P<0.05, 0.1g/L vs. ECM; #P<0.05, 1 g/L vs. ECM; & P<0.05, 2 g/L vs. ECM.图1 PSC对HUVECs增殖的作用Figure 1 Effect of PSC on HUVECs proliferation
2.2 PSC对HUVECs成血管基因VEGF、bFGF表达的作用
根据第2.1小节实验结果,选择含0.1 g/L PSC浸提液对HUVECs进行培养,采用real-time RT-PCR法检测HUVECs成血管基因VEGF、bFGF的表达情况,结果显示第4天时,PSC组VEGF、bFGF的基因表达量分别是ECM组的 1.59倍(P=0.011)和1.45倍(P=0.020);第7天时,PSC组VEGF、bFGF的基因表达量分别是ECM组的 1.98倍(P=0.021)和1.37倍(P=0.018), 与ECM组之间的差异具有统计学意义(图2)。
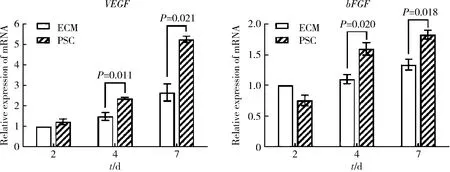
ECM, endothelial cell medium; PSC, phytic acid derived bioactive P2O5-SiO2-CaO gel-glasses; VEGF, vascular endothelial growth factor; bFGF, basic fibroblast growth factor; HUVECs, human umbilical vein endothelial cells.图2 PSC对HUVECs成血管基因VEGF、bFGF表达的作用Figure 2 Effect of PSC on the mRNA expression of VEGF and bFGF
2.3 PSC对HUVECs体外形成小管能力的作用
选择含0.1 g/L PSC浸提液的ECM对HUVECs进行培养,用体外小管形成实验检测PSC对HUVECs血管形成能力的作用。结果显示第4小时PSC组、ECM组均以细胞堆叠及出芽形成分支结构为主,完整的小管数量较少(图3A、B)。镜下计数及Image J软件分析显示,PSC组的小管数目(12.33±2.18)多于ECM组(10.33±3.82),但两组间差异无统计学意义(图3C)。在第10小时,PSC组、ECM组均形成了大量小管结构,PSC组的小管结构相对完整且分布密集,而ECM组仍见到一些未连成管的分支结构(图3D、E), 计数结果显示PSC组的小管数目(29.63±2.29)显著高于ECM组(20.13±2.36), 差异具有统计学意义(P=0.033,图3F)。
3 讨论
血管再生在创伤愈合、组织修复再生中具有重要意义,伴行的血管可以为细胞及新生组织提供氧气和营养物质,清除代谢产物,同时发挥引导和蓄积细胞、生长因子等作用,为骨代谢提供关键信号[24]。在组织工程化骨内,周围来源的组织营养液弥散范围仅1 mm,因此血管生成不足将导致新生组织无法获得持续的养分和氧气供给,新生组织周围微环境和生化信号改变,非正常细胞募集,最终导致生物材料与机体的融合替代失败,无法实现组织的新生和长期维持[5]。

ECM, endothelial cell medium; PSC, phytic acid derived bioactive P2O5-SiO2-CaO gel-glasses; HUVECs, human umbilical vein endothelial cells. A, HUVECs tubule formation of PSC group on the 4th hour; B, HUVECs tubule formation of ECM group on the 4th hour; C, the number of tubules on 4th hour; D, HUVECs tubule formation of PSC group on the 10th hour; E, HUVECs tubule formation of ECM group on the 10th hour; F, the number of tubules on 10th hour.图3 PSC对HUVECs形成小管的作用Figure 3 Effect of PSC on HUVECs tubule formation
在骨组织工程中应用具有良好成骨、成血管作用的生物材料,在骨组织愈合的同时形成相伴行的血管,有利于解决新生组织营养供给不足的问题,从而更好地实现骨缺损修复。回顾以往研究[11-17],生物活性玻璃能够促进血管生长因子基因表达与蛋白合成,刺激血管内皮细胞增殖,进而促进小管结构形成与成熟。Day等[11]在含有45S5生物活性玻璃的培养基里培养成纤维细胞,发现低浓度(0.01%~0.2%)生物活性玻璃能够促进成纤维细胞增殖,0.01%生物活性玻璃能够显著促进成纤维细胞分泌VEGF。Mao等[25]用58S、80S生物活性玻璃溶出物培养HUVECs,发现能够激活VEGF、bFGF及其受体基因,促进VEGF、bFGF蛋白合成,进而刺激HUVECs增殖,加速细胞迁移,发挥促进血管形成的作用。但也有研究发现,生物活性玻璃未能表现出促进血管形成的作用[18-20],传统45S5生物活性玻璃在体液中溶解后释放大量阳离子,导致溶液pH值明显升高,随浓度变化可达8.8~9.0[26],高碱性环境不利于血管内皮细胞增殖,影响其形成血管的作用[27]。此外,Leu等[28]用含有45S5生物活性玻璃(0.6、1.2、6和12 mg)涂层的胶原海绵材料培养内皮细胞,发现1.2 mg组能够显著促进细胞增殖、VEGF基因表达及血管形成,0.6和6 mg组对细胞增殖和基因表达的促进作用弱于1.2 mg组,而12 mg组则对细胞增殖、基因表达产生抑制作用,提示生物活性玻璃对细胞的生物刺激作用具有浓度依赖性,选择适宜浓度的生物活性玻璃也是实现血管再生的关键因素之一。

本研究中,0.1、1 g/L PSC浸提液对HUVECs增殖具有促进作用,其中以0.1 g/L增殖促进作用最为显著,较低浓度0.01 g/L对HUVECs的增殖无明显促进作用,而较高浓度2 g/L的浓度对HUVECs的增殖具有抑制作用。生物活性玻璃对细胞的增殖、分化等行为的调控具有浓度依赖性,且Si、Ca离子的浓度对细胞的增殖、分化等产生重要影响。Shie等[31]研究发现,适宜浓度(4 mmol/L)的Si离子通过刺激细胞进入细胞周期S、G2期促进细胞增殖,而较高浓度(6 mmol/L)的Si离子会导致细胞增殖显著下降。Maeno等[32]则发现2~8 mmol/L Ca离子有利于成骨细胞增殖、分化及矿化,浓度高于10 mmol/L的Ca离子则具有成骨细胞毒性。由此可见,生物活性玻璃释放的离子浓度与其生物刺激作用呈现一种“双向”关系,其离子浓度在适宜范围内发挥正向生物刺激作用,而当离子浓度过低或过高时,细胞的活性将受到抑制。本研究中,0.1 g/L PSC浸提液最适于HUVECs增殖,可能与其释放适宜浓度的Si、Ca等离子有关;而2 g/L PSC浸提液可能释放过高浓度的Si、Ca离子,对细胞的生理活动产生抑制作用,因此,筛选适宜的生物活性玻璃浓度有利于细胞更好的生长,对观察其生物学作用具有重要意义。
本研究显示,0.1 g/L PSC浸提液在第4、7天能够显著上调HUVECs内VEGF、bFGF的基因水平;在小管形成实验第10小时,即血管形成中期,PSC组小管的成熟度及密度显著优于ECM组。上述结果提示PSC具有良好的促血管形成作用,这与以往许多生物活性玻璃成血管的研究结果一致[11-17]。同时,研究表明生物活性玻璃释放Si离子在其促血管化过程中发挥关键作用[33-34]。生物材料释放高浓度的Si离子能够显著上调VEGF、bFGF等促血管生成因子及其受体表达,刺激血管内皮细胞合成血管源性一氧化氮合酶,增加一氧化氮表达,而一氧化氮作为调节因子及VEGFR-2反应的下游介质,进一步调节血管细胞迁移与血管形成[33-34]。此外,Si主要分布于骨组织中的钙化活跃区,通过在组织修复早期诱导血管化及骨基质矿化,加速骨组织再生[35]。本课题组在前期研究中,将PSC、45S5生物活性玻璃溶于DMEM浸提24 h配制成0.1 g/L浸提液,采用离子体发射光谱法检测Si、Ca、P离子释放情况,发现PSC、45S5生物活性玻璃能够显著升高溶液中Si浓度[DMEM中Si (0.70±0.23)×10-3g/L],且PSC释放的Si、P离子浓度[Si (19.43±0.33)×10-3g/L,P (31.59±3.76)×10-3g/L]显著高于45S5生物活性玻璃[Si (13.96±0.65)×10-3g/L,P (27.78±2.66)×10-3g/L][26],因此,PSC对HUVECs增殖及血管形成有良好的促进作用,与其释放较高的Si离子密切相关。除此之外,PSC磷含量的增加使其在溶解过程中具有更窄的pH值变化范围,由此可以避免形成高碱环境影响细胞的活性,更有利于促进血管再生。
综上所述,PSC能够促进HUVECs增殖、VEGF和bFGF基因表达以及血管形成。PSC的上述作用具有浓度依赖性,因此为发挥最大的生物学效应,在制备成临床应用材料时选取适宜的材料配比至关重要。
