不同羽色鸽种MC1R 基因的扩增与序列分析
2021-04-21汤青萍穆春宇杨明军夏爱萍付胜勇常玲玲
张 蕊 ,汤青萍,穆春宇,杨明军,夏爱萍,付胜勇,常玲玲,卜 柱*
(1.江苏省家禽科学研究所,江苏扬州 225125;2.河南天成鸽业有限公司,河南舞钢 462513)
羽色是禽类重要的外貌特征,可用于品种纯度的评价以及个体的雌雄鉴别,也可用于标记品种特征,辅助保护禽类遗传资源并指导育种。禽类羽色是由多基因控制的性状,其遗传机制复杂,基因间存在显隐性、互作、上位等关系,至今已发现多个基因座与色素形成有关,包括多种酶、结构蛋白、转录因子等[1],其中一个重要的基因座是扩展位点E(Extension),该基因座影响真黑素和褐黑素的相对分布,其对应的编码基因为黑素皮质素受体1(Melanocortin-1 Receptor,MC1R)基因[2]。MC1R 为7 跨膜结构G 蛋白耦联受体,在黑色素细胞中起着重要作用,可以调控真黑素(包括棕色素和黑色素)的生成。MC1R基因只有1 个外显子,其多态性会引起氨基酸组成改变,使MC1R 的构象和功能发生改变,继而影响相应的调控因子,导致色素沉积表现为偏黑、偏褐或者偏白,最终造成羽色的差异[3]。
太湖鸽(暂定名)原产地为江苏省中南部,中心产区为环太湖地区。太湖鸽体型中等,全身大面积为白色,头顶一点黑色(或棕色),尾羽黑色(或棕色)盖过肛门,黑(棕)白两色之间界限整齐,大部分为凤头,少量平头,部分个体存在多趾性状,其毛色、凤头外观奇特,具有典型的特征。目前对于鸡、鸭、鹌鹑等禽类的羽色及其对应的基因座已有广泛而深入的研究,而鸽子羽色遗传机制研究还处于起步阶段。本实验以太湖鸽为实验组,以乌鸽(全身黑羽)和白卡奴鸽(全身白羽)为对照组,对其MC1R基因进行PCR 扩增,检测不同羽色鸽种MC1R基因的差异,为太湖鸽遗传资源的保护和品种选育奠定基础。
1 材料与方法
1.1 实验动物 实验所用太湖鸽、乌鸽和白卡奴鸽均来自江苏威特凯鸽业有限公司。如图1 所示,太湖鸽全身大部分白羽,仅头顶和尾部为黑羽或棕羽,乌鸽为全身黑羽,黑色深浅程度存在差异,白卡奴鸽为全身白羽,没有其他颜色羽毛,采集3 个品种鸽血样各10 个,肝素钠抗凝,使用DNA 提取试剂盒进行血液基因组DNA提取,具体操作步骤参照试剂盒说明书。
1.2 引物设计 根据NCBI 上鸽MC1R基因(登录号:XM_013367785.2)的序列信息,使用Primer 3 软件(http://bioinfo.ut.ee/primer3-0.4.0/primer3/)在线设计1 对引物,引物信息:F:5'-GTGCCCTGGAGCTGAG GT-3',R:5'-CCATTATCGGTGTCCCACTG-3',由英潍捷基(上海)贸易有限公司合成。

图1 乌鸽、白卡奴鸽和太湖鸽(黑、棕)
1.3 PCR 扩 增 PCR 扩增总 体系为25 μL:12.5 μL 2×Taq PCR premix(天根生物有限公司),上下游引物(10 μmol/L)各0.5 μL,9.5 μL ddH2O,2 μL 模板DNA。PCR 反应程序:94 ℃预变性4 min;94 ℃变性30 s,59℃退火30 s,72℃延伸1 min,35 个循环;72℃终延伸8 min;10℃保存。PCR 产物经由1%琼脂糖凝胶电泳检测后,将相同鸽种的不同个体进行混样,送英潍捷基(上海)贸易有限公司进行测序。
1.4 序列分析 利用在线BLAST 软件进行序列同源性分析,用DNAMAN 预测该基因的开放阅读框(Open Reading Frame,ORF),利用EXPASY 网站相关软件分析蛋白质结构域、分子量、等电点、跨膜区域等;使用Jalview 软件进行相关氨基酸序列比对;使用MEGA 5.1 软件进行进化树构建;使用SignaIP 4.1 在线预测信号肽;使用HNN 在线预测其氨基酸二级结构;使用SWISS-MODEL 在线预测其蛋白3D 结构。
2 结果
2.1 鸽MC1R基因的PCR 扩增结果 由于MC1R基因仅有1 个外显子,本研究设计1 对涵盖整个外显子的引物进行PCR 扩增,扩增片段长度为988 bp,分别以太湖鸽、白卡奴鸽和乌鸽血液基因组DNA 为模板,经PCR 扩增获得与预期大小一致的目的片段及少许杂带(图2),送生物公司经切胶回收后测序,得单一峰图结果。
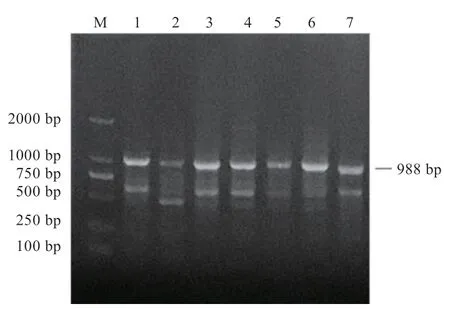
图2 鸽MC1R 基因PCR 产物电泳结果
2.2 鸽MC1R基因同源性分析 对测序结果进行分析,获得942 bp 鸽MC1R基因完整编码区(Coding Sequence,CDS),共编码313 个氨基酸,分子量为35 659.63,等电点为8.78。进行序列比对分析发现,该序列与鸡、珠鸡、日本鹌鹑等同源性均达到90% 以上。根据本实验获得的太湖鸽(Taihu Pigeon)、白卡奴鸽(Carnean Pigeon)和乌鸽(Wu Pigeon)序列,利用MEGA 软件使用Neighbour-joining 法将本实验所得序列与GenBank上发表的鸡(Gallus gallus)、日本鹌鹑(Coturnix japonica)、火鸡(Meleagris gallopavo)、珠鸡(Numida meleagris)、绿头鸭(Anas platyrhynchos)、天鹅(Cygnus cygnus)、人(Homo sapiens)、猪(Sus scrofa)、鼠(Mus musculus)、水牛(Bubalus bubalis)等物种的MC1R基因mRNA 序列进行聚类分析,结果显示本实验获得的3 个鸽种单独聚为一类,最后与绿头鸭、鸡、火鸡等其他鸟类汇聚为一支,而人、猪、鼠等哺乳动物最后汇聚为一支(图3),这些结果均表明所得序列确实是鸽的MC1R基因。
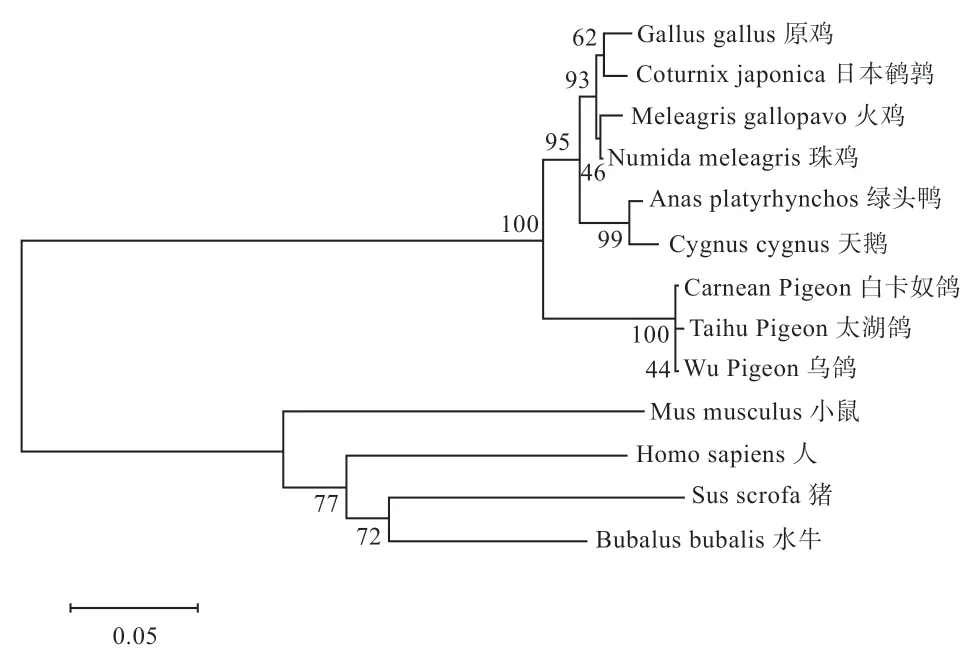
图3 基于MC1R 基因氨基酸序列的系统发生树
2.3 太湖鸽MC1R 蛋白质序列的结构分析 利用生物信息学在线软件分析发现MC1R 蛋白存在7 个跨膜区域(图4);该蛋白为非分泌蛋白,定位于细胞膜上的概率最高;预测其蛋白3D 结构见图5,进一步验证了该蛋白预测的跨膜结构。
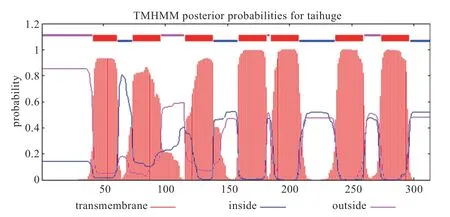
图4 太湖鸽MC1R 蛋白的跨膜区域分析
2.4MC1R基因序列及氨基酸二级结构差异分析 测序结果发现(图6),白卡奴鸽与乌鸽的MC1R基因编码区核酸序列基本一致,且黑羽和棕羽太湖鸽的MC1R基因序列没有差异,而太湖鸽与另外2 个鸽种分别于279 bp(A>G)(图6-a)和520 bp(G>A)处存在碱基差异(图6),其中A279G 为同义突变,G520A 造成了氨基酸(Ser174Gly)的改变。太湖鸽与另外2 个鸽种仅在第174 氨基酸处存在差异,鸽子MC1R基因与其他鸟类MC1R基因编码区的序列长度存在差异,于第227氨基酸处缺失1 个氨基酸,于第26~31 氨基酸处存在连续氨基酸差异(图7)。相较于乌鸽和白卡奴鸽,太湖鸽MC1R 蛋白的α螺旋结构多一个氨基酸,而延长链结构少一个氨基酸(图8)。可见,这3 种鸽MC1R基因序列的部分碱基差异,造成对应氨基酸的差异,从而导致了氨基酸序列二级结构的不同。
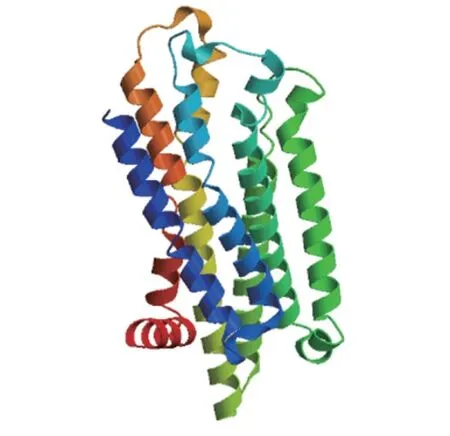
图5 太湖鸽MC1R 蛋白3D 结构模型
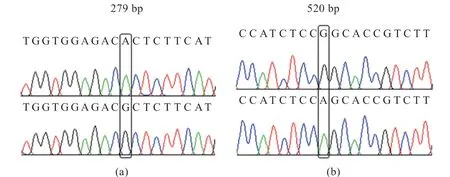
图6 MC1R 基因突变位点
3 讨 论
禽类羽色的差异主要是由黑色素的种类和分布不同造成的,黑色素主要有真黑素(Eumelanin)和褐黑素(Pheomelanin),是酪氨酸的衍生物,而真黑素和褐黑素的比例变化则主要由MC1R 及其拮抗剂刺鼠蛋白调控[4]。一般情况下,内源性的α-促黑色素细胞激素(α-melanocyte Stimulating Hormone,α-MSH)结合MC1R 可以增加真黑素的生成,刺鼠信号蛋白(Agouti Signaling Protein,ASIP)与MC1R 结合则会抑制真黑素的生成,增加褐黑素(包括红色素和黄色素)的产生[5]。MC1R 是G 蛋白耦联受体家族中最小的受体,不同物种间存在着氨基酸序列长度的差异,如鸭为284 个氨基酸[6]、鸡为314 个氨基酸[7]、鹌鹑为314 个氨基酸[8]、犬为317 个氨基酸[9]等。本实验扩增获得的3 种鸽子MC1R基因编码区均为942 bp,共编码313 个氨基酸,BLAST 比对结果显示该序列与鸟类MC1R基因同源性较高,经进化树分析发现该序列与鸟类MC1R基因聚为一类,经跨膜区域分析可知该蛋白存在7 个跨膜结构,符合7 跨膜G 蛋白耦联受体特征,以上结果均表明所得序列为鸽子MC1R基因。由于棕色和黑色均属于真黑素,因而本实验获得的棕色羽和黑色羽太湖鸽的MC1R基因编码区没有差异。
α-MSH 和促肾上腺皮质激素分别是MC1R 的2 个配体,两者与黑色素细胞膜上的MC1R 结合后,会改变G 蛋白耦联受体的结构,激活膜上的腺苷酸环化酶系统,催化三磷酸腺苷(ATP)生成环磷酸腺苷(cAMP),进一步激活酪氨酸激酶,活化细胞内的酪氨酸酶,催化酪氨酸生成多巴同时多巴还能进一步被酪氨酸酶氧化为多巴醌,促使黑色或棕色真黑素合成[10-12]。当黑色素细胞中酪氨酸酶含量或活性较高时,会生成真黑色素,反之则生成褐色素。而ASIP 作为内源性拮抗剂可以竞争性地与MC1R 结合,并阻止cAMP 的形成,抑制酪氨酸酶活性,进而抑制真黑素产生。若ASIP 表达低则真黑素与褐黑素比例升高,羽色产生黑化变异,若ASIP 表达高,则羽色产生白化变异[13]。MC1R基因上的突变不仅可以改变黑色素生成相关基因的表达,还可以改变MC1R上游相关基因的表达,继而形成羽色差异。本实验发现,太湖鸽与乌鸽及白卡奴鸽于G520A 造成了氨基酸(Ser174Gly)的改变,太湖鸽在该位点为GG 纯合型,而乌鸽和白卡奴鸽在该位点为AA 纯合型,此结果与任嘉[14]在黑、白色羽鸽子上检测的结果一致,太湖鸽MC1R基因在此位点上的突变可能造成了相关基因表达的变化,继而造成羽毛色素沉积的差异。MC1R基因编码区的突变所造成的羽色差异可能因物种不同而存在差异,Zhan 等[15]研究发现矛隼MC1R基因编码区的1 个单碱基突变造成了黑、白羽色差异,但其白化或黑化性状可能还有其他位点的参与;而Bourgeois 等[16]则发现马斯绣眼鸟MC1R基因上的突变未造成黑化差异。本实验中黑色羽和白色羽鸽子的MC1R基因编码区没有差异,推测可能造成这2 种羽色差异的并不是来源于MC1R基因编码区的突变,而是MC1R基因调控区或者其他基因上的突变造成[17]。
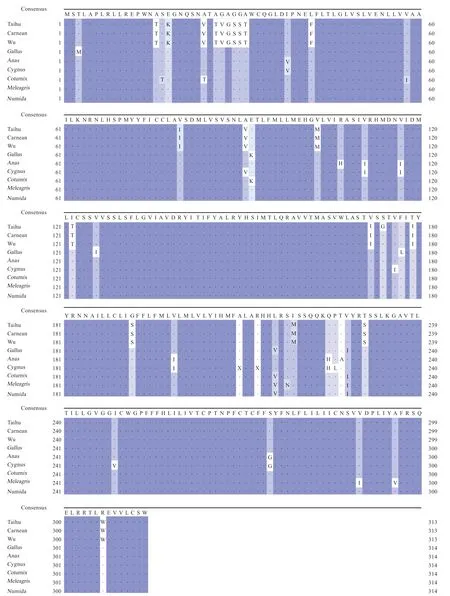
图7 各物种MC1R 氨基酸序列比对图
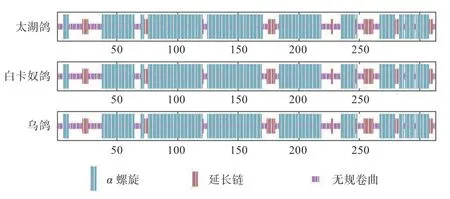
图8 太湖鸽、白卡奴鸽和乌鸽MC1R 氨基酸序列二级结构预测示意图
动物的羽毛色素沉积模式主要由色素生成细胞(生黑色素细胞)的差异性分布以及黑色素合成通路调控,Gluckman 等[18]通过对日本鹌鹑(腹部白色而背部为有色羽)胚胎不同部位的毛囊组织进行羽色相关基因的表达分析发现,ASIP 转录本只在日本鹌鹑白色腹部毛囊组织中高表达而背侧没有,对MC1R 起活化作用的促黑素细胞皮质素原则在所有毛囊组织中高表达,这些结果表明鹌鹑腹部白羽的表型可能由MC1R 被抑制造成,而背部有色羽的形成可能需要MC1R 激活真黑素生成。Zhang 等[19]对不同羽色日本鹌鹑的MC1R基因和ASIP基因表达量进行检测后发现,日本鹌鹑的黑羽性状可能是由MC1R基因表达的上调或者ASIP的下调造成的。本实验中太湖鸽头顶和尾羽黑色而其他部位羽毛白色可能与ASIP的差异性表达有关,但有待于下一步验证。
4 结 论
本实验获得太湖鸽、乌鸽和白卡奴鸽MC1R基因完整CDS 序列,乌鸽与白卡奴鸽的MC1R基因CDS区不存在碱基差异,而太湖鸽与另外2 种鸽子MC1R基因存在碱基差异且造成氨基酸的改变,推测与太湖鸽的特殊羽色形成有关。
