高镍锂离子电池三元材料NCM电解质的应用
2021-04-20张文林刘雪娇马青查杨双丞张永康李春利
张文林,刘雪娇,马青查,杨双丞,张永康,李春利
(河北工业大学化工学院,化工节能过程集成与资源利用国家地方联合工程实验室,天津300310)
锂离子电池(LIBs)作为优异的能量转换、储存系统,在便携式电子设备、混合动力汽车等新能源领域有广泛的应用[1-4]。但随着现代科学技术的不断发展,对锂离子电池能量密度和安全性能上的要求也逐渐提高[5-6]。正极材料和电解质是锂离子电池不可或缺的一部分,对于提高电池能量密度和安全性、降低使用成本有直接影响。近年来,高镍三元正极材料LiNi0.5Co0.2Mn0.3O2(NCM523)、LiNi0.6Co0.2Mn0.2O2(NCM622) 、 LiNi0.8Co0.1Mn0.1O2(NCM811)等以高容量、低成本和安全环保的特性引起了人们的关注,并被认为是最有应用前景的正极材料[7-10]。然而,与高镍三元材料相匹配的电解质研究很少被关注。因此,理论筛选并总结展望符合高镍三元材料电池特性的电解质,对于锂离子电池的发展具有重要意义。
电解质的类型多种多样,应用在高镍三元锂离子电池中表现的性能也各有不同。电池总能量的输出以及安全稳定状态的表现都取决于电解质的选择[11]。本文介绍了电解质的一般组成及其重要成分的独特特性,分析了不同类型电解质在高镍三元材料(主要为NCM523、NCM622、NCM811材料)电池中的性能特点,并综述了几种对电解质进行量化计算的有效方法,最后对离子液体基混合电解质在高镍三元材料中的发展进行了展望。
1 电解质的一般组成
电解质是正负极间起传导作用的离子导体,对电池性能有重要影响[12]。锂离子电池电解质一般由锂盐和溶剂两部分构成,有时为了满足人们对电解质特定的需求(如导电性、阻燃性或降黏性等),会在其中加入一些功能性添加剂,从而提高电解质的利用率[13-16]。
溶剂占电解质的80%以上,是电解质的重要组分。一般来说,良好的溶剂需要符合稳定、廉价、安全无毒的要求。此外,与锂盐相对较高的溶解性是溶剂的强制性特征[11]。目前,具备以上特征的溶剂有几种类型,包括有机溶剂、水溶剂、离子液体和聚合物等,由此也产生了不同类型的电解质,如图1 所示。有机溶剂电解质研究最为广泛,具有成本低、离子电导率高[17]、流动性好等优点。常用的有机溶剂包括碳酸甲乙酯(EMC)、碳酸乙烯酯(EC)、碳酸二甲酯(DMC)和碳酸二乙酯(DEC)等。水溶剂具有较高的电导率,且价格低廉、安全环保[18],但较窄的电化学窗口和低稳定性严重阻碍了水电解质的发展[19-20]。离子液体(ILs)是一种由阴、阳离子组成的室温熔融盐,其较高的稳定性、阻燃性,较低的蒸气压和宽电化学窗口等优良特性被越来越多的学者认可,因此离子液体电解质也被认为是最有前途的电解质[21]。常见离子液体包括咪唑类、吡咯类、哌啶类等,其阴阳离子结构如图2 所示。聚合物因其优异稳定性和较好的柔韧性被广泛应用于固体电解质中。常见的聚合物包括聚氧化乙烯(PEO)、聚偏氟乙烯(PVDF)、 聚 氯 乙 烯(PVC)、 聚 丙 烯 腈(PAN)等。
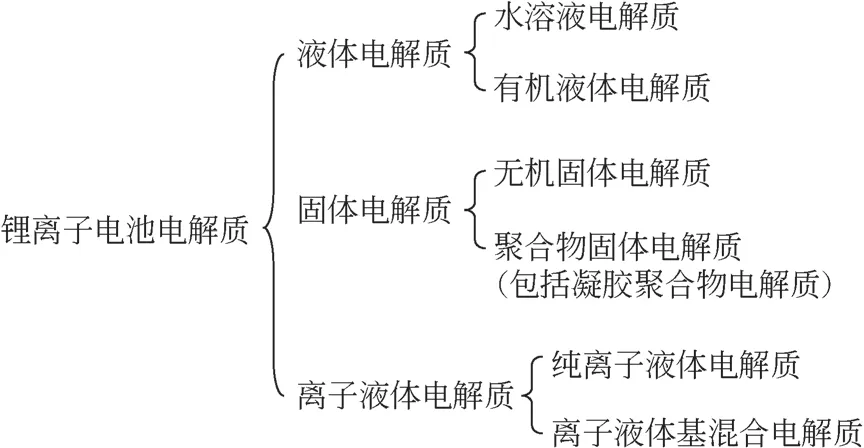
图1 电解质的分类


图2 常见离子液体阴阳离子结构
添加剂一般用来弥补电池的缺点,改善电解质的电化学性能(如成膜性、电导率等)[25],具有针对性、用量小、见效快的优点。常用的添加剂有碳酸乙烯酯(VC)、丙烷砜(PS)、琥珀腈(SN)等。
电解质是锂离子电池的“血液”,为锂离子电池获得高能量、高电压等优点提供保证。而锂盐、溶剂及添加剂作为电解质的重要组分,达到规定的要求是发挥电解质作用的前提。表1对上述各组成部分的特性及要求进行了总结。
2 高镍三元材料(NCM)电池电解质
目前,与高镍NCM523、NCM622、NCM811材料相匹配的电解质主要包括有机液态电解质、固态以及离子液体基电解质。每一类型电解质应用在高镍三元材料电池中利弊共存。因此,总结并寻找一种最优的电解质是高镍三元材料NCM 电池的研究重点之一。
2.1 有机液体电解质
一般来说,传统有机液体电解质(以LiPF6为主盐、碳酸酯作为主溶剂)不能应用在高镍材料NCM 电池中。这是因为,高镍材料NCM 电池的充电电压在4.3V 以上,而传统有机电解质的操作电压在4.2V 以下,电压达到4.3V 时电解质中的碳酸酯溶剂会发生氧化分解[26-27],严重影响电极表面固体电解质界面(SEI)膜的形成,甚至会造成电池瘫痪。很多研究者选择合适的替代溶剂或添加剂来解决这一问题。

表1 电解质的一般组成及其特征
Heng等[28]将氟醚(TTE)添加剂引入到传统有机液体电解质(1.0mol/L LiPF6/EC+EMC)中,并应用于石墨/NCM523全电池,明显改善了电极与电解质界面间的不稳定性,抑制了电解质溶剂的氧化分解,提高了Li+的迁移数量和循环倍率性能。当氟醚质量分数达到3%时,0.05C下的首次放电容量为366.9mA·h/g,库仑效率达到91%,循环200圈后的容量几乎没有衰减。此外,当电池放电倍率为50C时,含有氟醚添加剂的电解质电池容量远远高于传统电解质电池,且容量保持率能达到90.5%。图3(a)~(d)对比了两种电解质电池循环前及循环200圈后电极的扫描电镜(SEM)图,图3(e)~(f)为相应循环后的电极横切面图。研究发现,两种电池循环前的电极表面形貌差异不大,结构都较为完整。循环后二者差异明显,带有传统有机电解质的电池电极表面结构破坏严重,晶体大小不一,而含有TTE 添加剂的电池NCM523 电极表面结构完整,大小均匀,形成了致密的SEI 膜,保证了上述稳定的充放电循环。同时,从横切面图像中也可以看出,传统有机电解质电极NCM523 颗粒上有一层厚膜,且颗粒密集堆积,电极内的大部分孔隙被堵塞。相反,在TTE 添加剂存在下,电极表面的SEI 膜较薄且均匀,整体形貌平滑而干净,这意味着TTE 添加剂促使了SEI 膜的稳定存在。Zhang 等[29]将琥珀腈(SN)与氟代碳酸乙烯酯(FEC)共溶作为溶剂与LiBF4混合形成了有机液体电解质系统。应用在Li/NCM523 电池中,0.5C下循环100 圈后的容量保持率为73.6%,而传统电解质的保持率只有35.5%。这表明电极表面形成了稳定而致密的SEI 膜,该钝化膜有效地防止了电极与电解质间的副反应,促进了电池可逆有效的循环[30]。Han 等[31]考察了成膜添加剂1,4-二腈丁烷(ADN) 加入到传统有机电解质(1.0mol/L LiPF6/EC+EMC)中的电化学性能。电解质稳定性线性扫描伏安(LSV)测试表明,ADN 的添加提高了电解质的氧化电位,保证了电池的稳定循环。
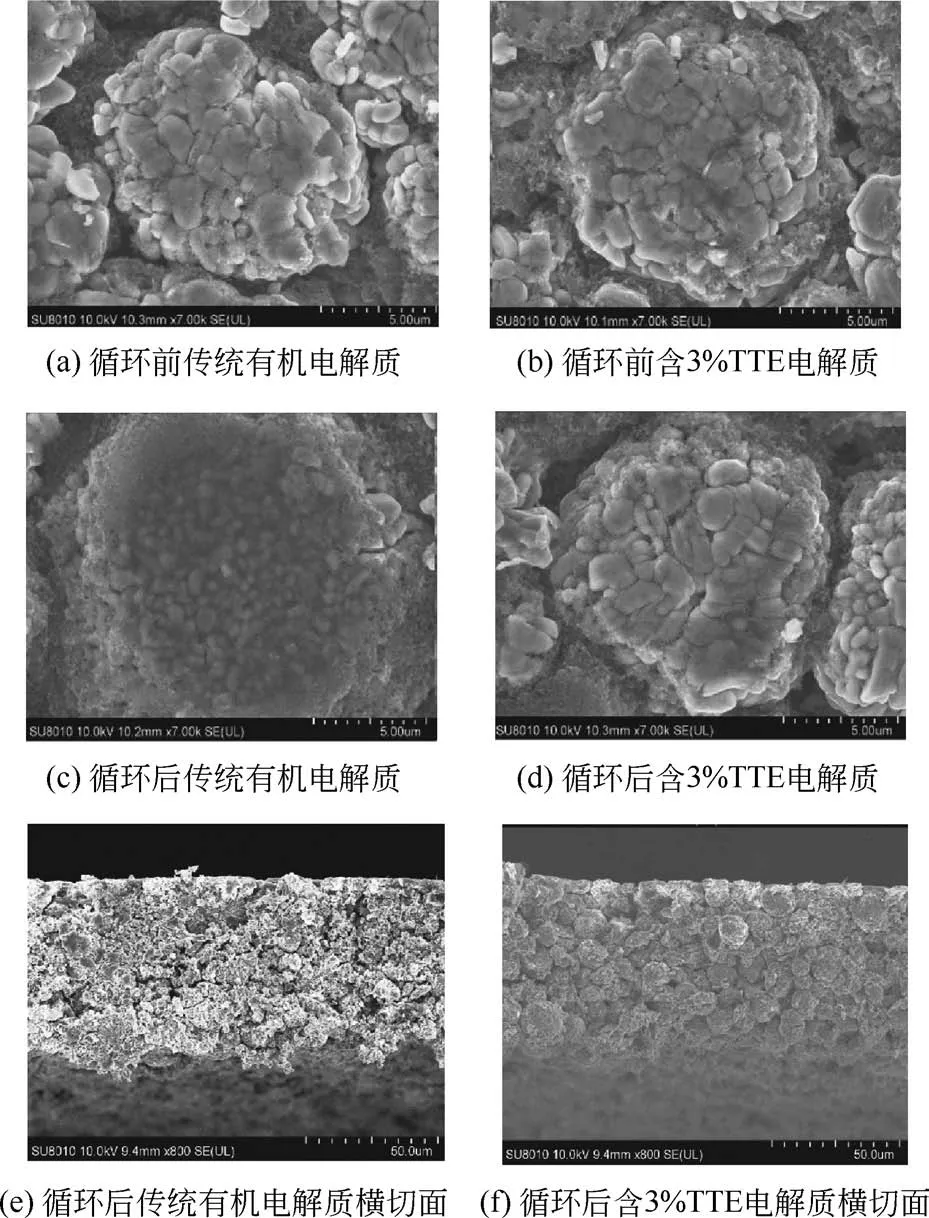
图3 传统有机电解质与含有3%TTE电解质电池循环前后的NCM523电极SEM图[28]

图4 传统有机电解质和含TIB电解质电池循环后的电极TEM图[32]
Qin 等[32]将有机成膜添加剂硼酸三异丙酯(TIB)引入到传统电解质中,提高了NCM622 电极的电化学稳定性。图4 为传统有机电解质和含1.0% TIB 电解质电池循环后的电极透射电镜(TEM)图,可以清楚地看到电极表面形成了SEI膜。并且对比两种电解质电极的表面膜可以发现,传统有机电解质电极SEI 膜形成不均匀,厚度约为80nm,而含TIB 电解质NCM622 电极表面涂覆了一层约25nm 的均匀薄膜。这说明TIB 添加剂能有效地抑制电解质溶剂分解,并在阴极上氧化形成相对稳定的保护膜,提高NCM622 电极的循环稳定性。Liu 等[33]考察了碳酸氟乙烯(FEC)电解质添加剂对高压NCM622 电极的界面稳定性影响。图5(a)、(b)为带有传统有机电解质电池和含10%FEC 的电解质电池交流阻抗(EIS)谱图。从图中发现,两种电解质电池充放电循环前的电阻差异很小,而循环100 圈后含10% FEC 电解质电池的界面阻抗为198Ω,传统有机电解质的界面电阻在不断增加,这表明FEC 添加剂能减少不可逆容量损失,有效地改善电极表面状态,提高电池的电化学性能。图6 为两种电解质电极循环前及循环后的X射线光电子能谱(XPS)图,通过XPS图分析可知,循环后电极表面形成了SEI 膜,并能推断出SEI 膜的化学成分。分别对比循环前后两种电解质的C 1s 峰、O 1s 峰、F 1s 峰及P 2p 峰发现,FEC添加剂参与了SEI膜的形成,并成功地阻止了电极表面金属离子的溶解和电解质的氧化分解。此外,该课题组[34]还考察了FEC 添加剂对Li/NCM622 电池倍率性能的影响。5C下,含有5%FEC 的电解质在NCM622 电池中的放电比容量为71.3mA·h/g,而不含FEC 的传统有机电解质在相同倍率下的放电比容量仅为12.6mA·h/g。FEC 不仅可以保护电极增强界面稳定性,还可以提高电池循环稳定性和倍率性能。

图5 传统有机电解质及含10%FEC电解质的电池循环前和循环100圈后的EIS谱图[33]
Prakasha等[35]研究了六氟磷酸乙酯(EVFP)作为传统有机电解质的添加剂在石墨/NCM811电池中的性能。在EVFP 质量分数为0.2% 时,石墨/NCM811电池的循环稳定性明显增强,0.2C下循环100圈后容量保持在初始放电容量的81.6%。此外,EIS 阻抗谱表明,EVFP 添加剂通过稳定固体电解质界面而减缓了阻抗的增长。这种改善的循环性能可能是添加剂先于电解质溶剂分解,最终体现在电极表面形成钝化层。Lan等[36]将锂盐LiBF4作为电解质添加剂引入到1.0mol/L LiPF6/EC+EMC 中,有效地抑制了碳酸酯溶剂的氧化并提高了NCM811电极的界面稳定性。
此外,离子液体也可作为添加剂发挥其特殊功能,提高电池的电化学性能。Wang等[7]将1-乙基-3-甲基咪唑四氟硼酸盐(EMI-BF4)离子液体引入到有机电解质(1.0mol/L LiPF6/EC+EMC)中,显著地提高了电解质的电化学窗口,并能在低温的石墨/LiNi0.5Co0.2Mn0.3O2全电池中稳定运行。其中,-10℃下含有1%EMI-BF4电解质在NCM523电池中循环150 圈的容量保持率达到近90%。通过EIS 交流阻抗测试发现,混合电解质在循环过程中形成了更薄、更均匀的SEI膜,这与表现较高放电比容量的结果相对应。

图6 传统有机电解质和含FEC电解质电极循环前后的XPS图[33]
使用添加剂或替代溶剂可以有效控制NCM 电极表面性质,使其形成均匀致密的SEI膜,并提高电解质的阳极稳定性。目前,氟代物、锂盐、腈类等添加剂[37]应用较多,且对于锂离子电池电化学性能的提高最经济有效。
2.2 固体电解质
有机液体电解质虽然循环性好、电导率高,但高挥发和可燃的特性使得电池存在很大的安全隐患[38-40]。此外,NCM材料随着Ni含量的提高,易造成结构的严重不稳定,影响电池循环。而固体电解质以低成本、高安全性的优势,被认为是替代有机液体电解质、提高电池稳定性的最佳候选之一[41-42]。一般来说,固体电解质包括固体聚合物电解质和无机固体电解质,应用在高镍材料NCM 电池上的多为固体聚合物电解质。
Wu 等[43]研究了一种由咪唑修饰二氧化硅纳米粒子(Z-SiO2)的复合高分子聚合物电解质,并应用到阴极为NCM523 的锂离子电池中。如图7 所示,电解质的主要形成过程为:首先采用蒸馏沉淀聚合法制备Z-SiO2纳米粒子;其次将Z-SiO2掺杂到聚偏氟乙烯-六氟丙烯(PVDF-HFP)中;最后将掺杂的材料包覆在聚乙烯(PE)基板上并浸入浇铸溶液中制得。在0.5C下的循环,复合聚合物电解质电池的首次放电容量为169mA·h/g,100 圈后维持在138mA·h/g,容量保持率为81.9%,而常规PE 电解质的首次放电容量为160mA·h/g,循环100 圈后降为94mA·h/g,容量保持率仅为40.8%。此外,图8 评估了上述复合聚合物电解质[PVDF-HFP-(Z-SiO2)/PE]的热稳定性和电化学稳定性,并与常规PE 基固体电解质对比。结果表明,该复合电解质具有较高的热分解温度(362℃)和阳极稳定性(4.75V),是一种有实际应用潜力的安全型电解质。
Liu 等[44]结合无机填料和离子液体增塑剂,制备了具有核壳结构的纳米纤维膜(PHP@PHL),并将该膜与碳酸酯类电解质结合,最终得到了一种无机-有机共改性的凝胶聚合物电解质。如图9所示,应用在NCM622 半电池中,PHP@PHL 聚合物电解质显示出了高倍率(3C和5C)下较优的长期稳定循环,这也证明了该电解质能有效地稳定电极结构,提高与电极的相容性,从而加强了电池的电化学性能。Park等[45]通过硫醇(PETMP)-烯基点击化学反应合成了一种安全高导电的准固态电解质(QSEs),如图10所示,所得到的QSEs是独立的柔性薄膜且合成中没有溶剂泄漏。该电解质抛弃了传统合成凝胶聚合物电解质使用大量有机溶剂的方法,利用聚己内酯可以溶解锂盐和Li+的导电特性,合成了聚己内酯三丙烯酸酯(PCL-Ac),并将其用作交联剂与少量有机溶剂DMC 混合形成化学交联聚合物电解质。应用于Li/NCM622电池中,表现出了良好的循环稳定性和热稳定性。
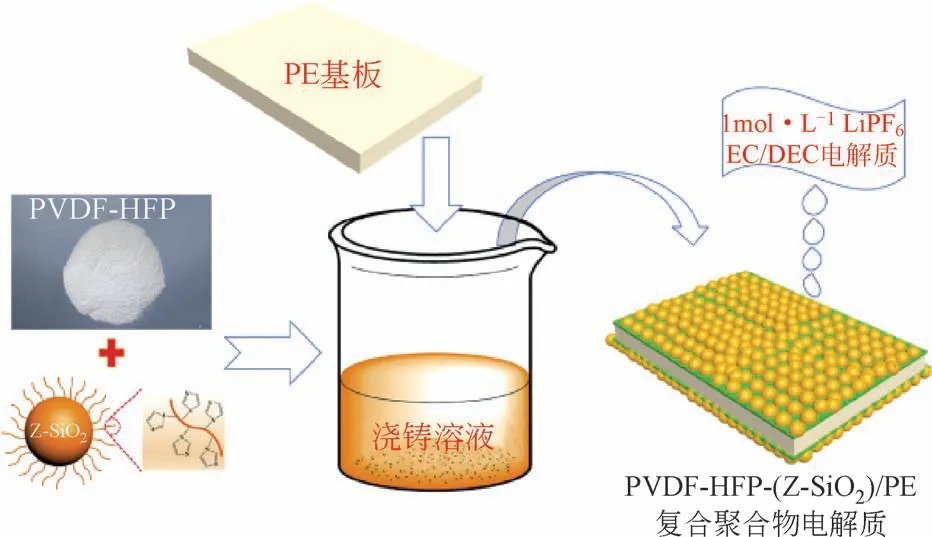
图7 PVDF-HFP-(Z-SiO2)/PE复合高分子聚合物电解质的制备过程[43]

图8 复合聚合物电解质的热稳定性和电化学稳定性[43]
Han等[46]研究了一种带有ILs的有序介孔SiO2骨架(MCM-41)基固体电解质(Li-IL@MCM-41)。电解质中的锂盐用来平衡Li+迁移数、Pyr14TFSI 作为离子导电客体,MCM-41 作为纳米孔支架。与NCM811 正极材料相匹配时,室温0.1C下循环100圈,放电容量为163mA·h/g,展现了很好的循环性能。此外,相比于液态电解质,固体电解质的一大优势是抑制锂枝晶的生长。Zhao等[47]合成了一种柔性阴离子固定化陶瓷复合聚合物电解质(PLL),并观察了该电解质与传统液态电解质(1.0mol/L LiPF6/EC+DEC)在Li/NCM523 电池循环后的阳极SEM 图像,如图11 所示。显然,锂枝晶在液体电解质中生长和积累,形成一个非常不均匀的表面,一旦其不断生长并到达阴极,就会发生短路。相反,PLL固体电解质没有锂枝晶现象发生,因其有足够的刚性,有助于平滑锂沉积,构建安全的电池。
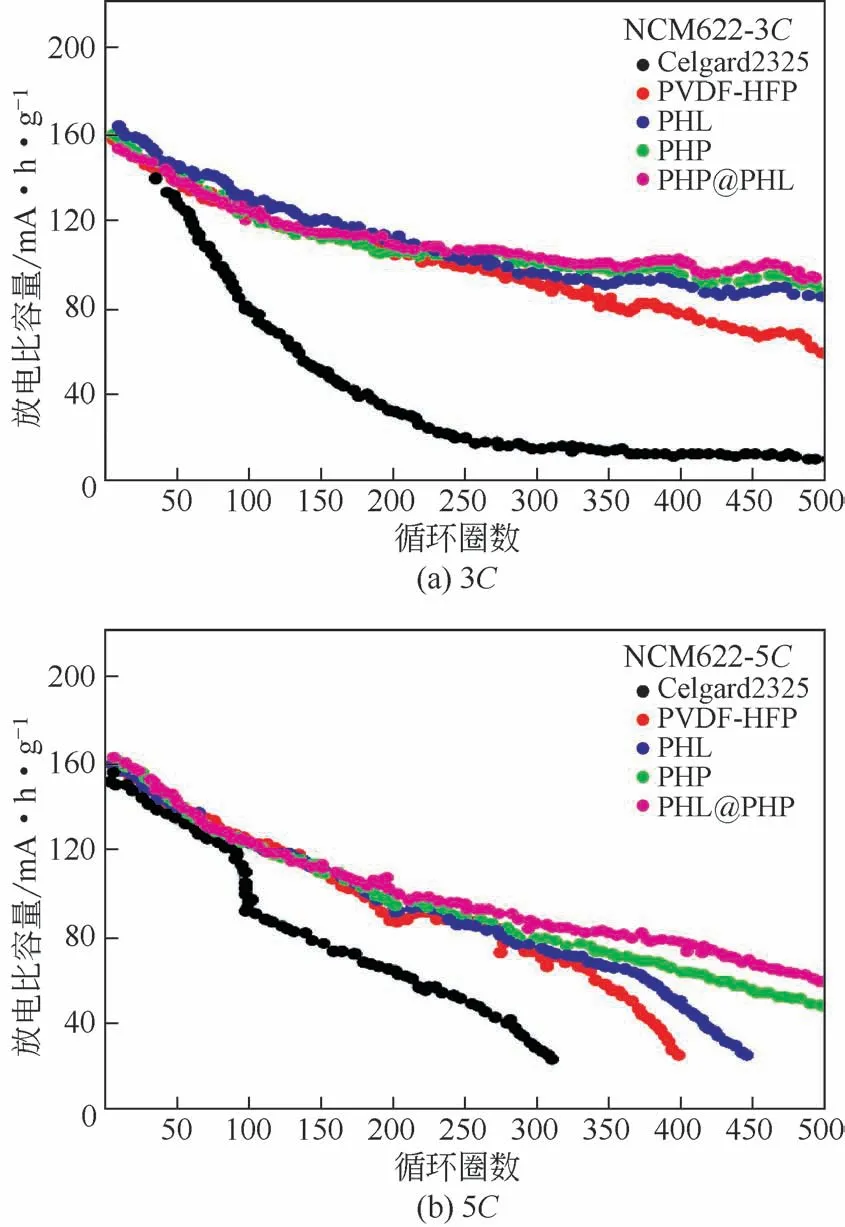
图9 聚合物电解质在3C和5C下的长期循环稳定性[44]
优异的机械稳定性使固体电解质在稳定电极结构,提高电池安全性上发挥了巨大作用,但低离子电导率、较窄的电化学窗口等不良特性一直是人们需要克服的难题,固体电解质的应用也因此受到局限。
2.3 离子液体基电解质
离子液体基电解质是提高NCM 电极稳定性、替代传统有机电解质的另一最佳候选品[48]。此外,离子液体基电解质还能够弥补固体电解质的不足,其较宽的电化学窗口和较高电导率不仅可以满足高镍NCM 电池的高工作电压,还可以保持较高的放电比容量。

图10 通过点击化学反应在PETMP和PCL-Ac之间合成QSE的原理[45]
Hoffknecht 等[49]考察了阳离子为N-甲基-N-丁基吡咯烷(Pyr14+),阴离子分别为三氟甲磺酰氰酰胺(TFSAM-)、二氰胺(DCA-)、双三氟甲磺酰亚胺(TFSI-)等纯离子液体电解质在NCM523电极中的应用。Pyr14TFSAM离子液体电解质表现出了较高的阳极稳定性和循环性能,40℃下,Pyr14TFSAM离子液体电解质在石墨/NCM523 电池中循环30 圈后的库仑效率达90.5%,而Pyr14DCA离子液体电解质仅为73.4%。此外,通过差示量热(DSC)分析发现,Pyr14TFSAM 没有结晶,这表明该离子液体电解质可能具有低温条件下的应用潜力。Heist等[50]将离子液体N-甲基-N-丙基吡咯烷双氟磺酰亚胺(Pyr13FSI)用于NCM811 正极材料电池中,考察了半电池的循环性能,并与传统有机电解质(1.0mol/L LiPF6/EC+DEC)作对比。如图12 所示,0.2C下Pyr13FSI 电解质循环150 圈后的容量保持率为95%,而传统电解质的保持率仅为73%。当提高到1C时,循环150 圈后的Pyr13FSI 电解质能达到98%的容量保持率,远高于相同条件下传统电解质的值。离子液体电解质加强了电池的循环稳定性,降低了活性物质的金属溶解[51]。

图11 PLL电解质和传统液态电解质循环后的阳极SEM图[47]

图12 PYR13FSI电解质与传统有机电解质的循环性能[50]
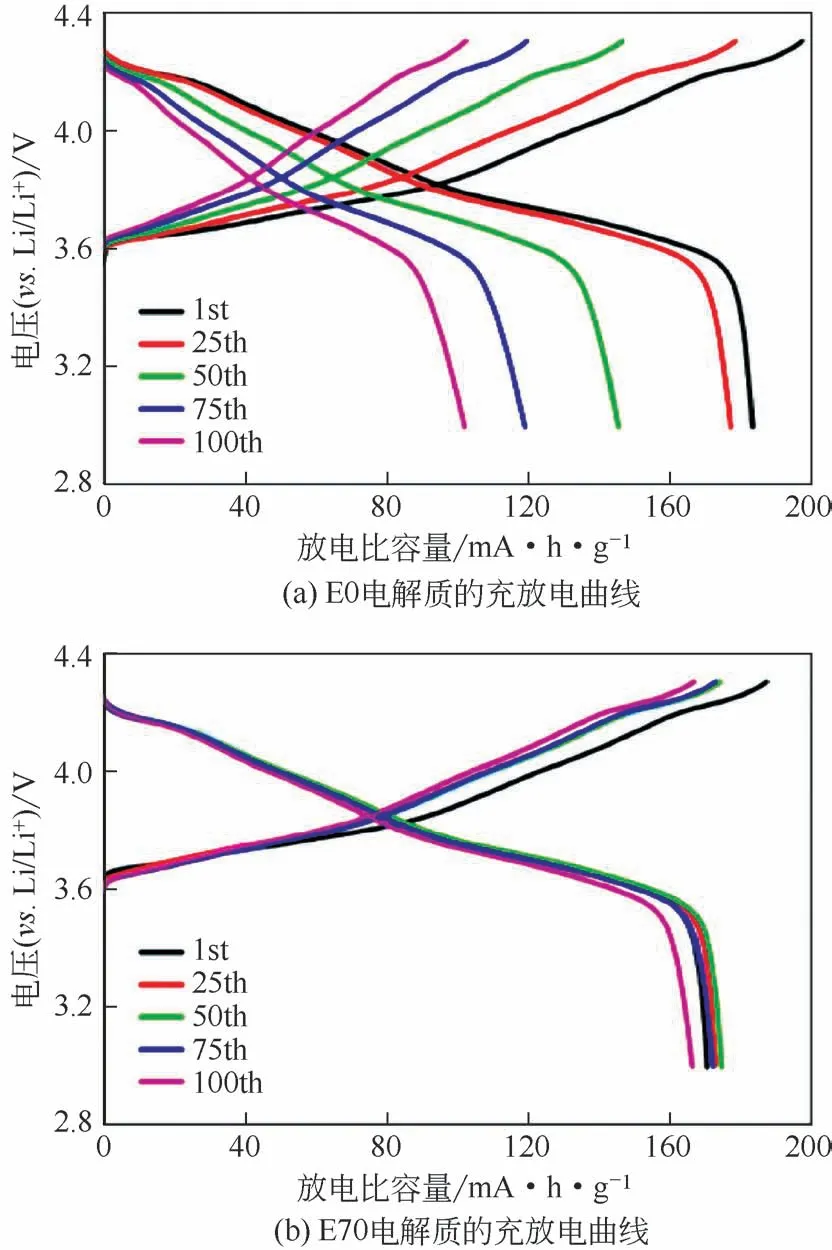
图13 E0与E70常温0.5C下的充放电曲线[53]
然而,纯离子液体电解质的高黏度特性不利于三元电池高容量的发挥。因此,离子液体可以作为共溶剂与传统有机溶剂混合形成二元电解质系统[52],以降低电解质的黏度,提高Li+传输效率。这样既保证了电池的安全稳定性,又使其具备良好的循环性能。Ma 等[53]考察了N-甲基-N-丙基吡咯烷双(三氟甲磺酰基)酰亚胺(Pyr13TFSI)离子液体与环丁砜、EMC 有机溶剂混合形成的电解质在NCM811 半电池中的充放电性能。通过调整Pyr13TFSI在混合电解质中的相对组成,经测试最终找到最优电解质E70(离子液体质量分数为70%)。如图13 所示,常温下E70 在0.5C的电流密度循环100 圈后的放电容量为166.1mA·h/g,且容量保持率为97.6%,远高于E0的放电容量102mA·h/g,保持率55.8%。此外,EIS 交流阻抗测试显示,E70循环100 圈后的界面膜电阻Rsf为32.89Ω,而相同条件下E0 的Rsf电阻为75.42Ω。这是由于E70 在循环过程中形成了致密而薄的SEI膜,保证了阴极层状氧化物表面的结构完整性。
基于离子液体基二元混合电解质的优良特性,本文作者课题组正在研究将一种新型的功能化咪唑离子液体与传统有机溶剂(EC+DEC+EMC)混合形成电解质并用于NCM523半电池,主要目的是提高电池能量密度,同时保证安全稳定性。合成的咪唑离子液体中阳离子引入了醚基和酯基两种官能团,用来降低离子液体的黏度,提高电化学稳定性,结构如图14 所示。为了考察二元混合电解质的可行性以及与NCM523电极的相容性,对不同含量的ILs 混合电解质进行了物理化学性能测试以及应用在NCM523半电池中的循环表现分析。研究结果发现,离子液体基混合电解质具有良好的热稳定性和电化学稳定性。根据图15(a)可知,常温、0.1C下,由L0(ILs 质量分数为0,下同)、L10、L20、L40、L60这5组混合电解质组成的Li/NCM523电池首次充电比容量分别为205.5mA·h/g、214.3mA·h/g、234.6mA·h/g、197.9mA·h/g和192.7mA·h/g;相应的首 次 放 电 比 容 量 为165.1mA·h/g、186.9mA·h/g、217.6mA·h/g、167.2mA·h/g 和149.8mA·h/g;得到的库仑效率为80.34%、87.21%、92.75%、84.49%和77.74%。由上述数据可以发现,L10、L20、L40的放电比容量和库仑效率都高于传统有机液体电解质且L20 循环效果最好,但随着ILs 含量的逐渐增加,电解质的黏度急剧升高,其与电极表面的浸润性较差,使Li+在电解质的传输速率降低,电池首次循环性能也变差。图15(b)中50 圈循环测试的结果与首次充放电大体一致,L20 混合电解质的容量保持率为96.69%,电化学稳定性最佳,更适合应用于高镍三元材料电池。接下来的主要工作是对混合电解质进行不同倍率下的充放电测试,观察电流大小对电池电化学性能的影响;进行EIS交流阻抗测试,分析电极系统所包含的动力学过程和机理,并计算动力学参数;最终寻找最优浓度电解质,进行成膜性分析。表2、表3 归纳了上述3 种类型电解质应用在高镍NCM 电池中的优缺点及电化学性能数据对比。由于离子液体浓度相对较高会导致混合电解质的黏度升高,不利于电池循环,因此表3 选择了ILs 质量分数小于50%的混合电解质进行电化学性能对比,且表中结果取为大量文献实验数据的均值。由表中对比结果可知,离子液体-有机溶剂混合电解质的电化学性能最好,为高镍三元材料锂离子电池电解质的发展提供了很好的选择。

图14 合成的咪唑离子液体结构

图15 不同浓度混合电解质的循环性能
3 电解质的量化计算
利用量子化学理论计算的方法设计锂离子电池电解质已经引起了研究者的广泛关注。理论计算既可以对某些实验问题及结果作出解释和验证,还能预测一些分子化合物的性质以及其作为电解质组分的合理性,进而优选电解质成分[54]。目前,量化计算应用最多的方法是从头算法和密度泛函理论(DFT)方法,从头算法还可以细分为Hartree Fock(HF)方法[55]和Moller-Plesset(MPn)多体微扰理论[56],密度泛函理论常采用B3LYP方法计算。不同的方法基于不同的方程推导,利用不同的理论体系对分子进行优化,最终模拟出分子的前线轨道能量。前线轨道能量计算是设计电解质组分的重要理论依据,对于电解质的氧化稳定性研究具有直接参考意义。
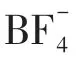

表2 高镍NCM电池电解质类型及特点

表3 室温(25℃)下几种电解质在高镍三元锂电池中的电化学性能
事实上,基于HOMO 值计算电解质分子的氧化电位是以化合物在真空状态下单独存在为前提,但电解质中的溶剂分子并不是单独存在,而是与锂盐发生相互作用形成络合物参与电池的电化学过程,构成溶剂化体系,影响电解质分子的氧化电位[60]。因此,利用溶剂化模型计算分子的氧化电位更为准确。Cao 等[61]根据HF 和MP2 计算方法并利用SMD 溶剂化模型对一系列吡咯离子液体电解质分子的氧化电位进行了模拟计算,如图16 所示。研究发现,碳碳双键与醚基修饰的吡咯ILs 氧化电位较烷基吡咯ILs 的低,而酯基修饰的吡咯ILs 氧化电位[7.8Vvs.(Li/Li+)左右]高于烷基吡咯ILs,更适于高压应用,形成的ILs 电解质系统匹配于高镍三元材料电池。相比于有机碳酸酯分子,离子液体的氧化电位更高,在电极表面能优先成膜,符合上述分析结果。利用溶剂化模型计算分子的氧化电位以验证实验结果或筛选合适的电解质组分将会是高镍三元材料电池电解质的一种发展方向。

表4 传统有机碳酸酯类溶剂的HOMO与LOMO值

图16 一系列吡咯离子液体的氧化电位值[61]
此外,很多研究者还致力于电解质中溶剂分子与Li+结合能(Eb)的计算,以研究电极表面SEI膜的形成过程。张文林等[62]利用DFT理论方法计算了所制备的新型离子液体添加剂(AMCEIMTFSI)与Li+的结合能,并与电解质中其他有机溶剂组分的Li+结合能作对比,优化后的各组分结构如图17 所示。从图中可以看出,AMCEIMTFSI 与Li+的结合能最小,因此更容易被吸附到电极表面参与形成SEI膜,抑制EC、DMC溶剂的氧化分解。Park等[63]计算了VC、FEC等32个有机添加剂分子与Li+的结合能,结果发现,大多数成膜添加剂与Li+都具有较低的亲和力而更容易参与成膜。结合能的计算无疑是筛选有效电解质添加剂或溶剂的一种重要途径,对稳定高镍材料结构,促进三元电池高效运转提供了理论支撑。
4 结语
在以高镍三元材料为正极的锂离子电池研发过程中,与其配套的电解质也越来越成为人们关注的焦点。目前,单一的有机液体电解质、离子液体电解质或固体电解质很难满足电池的各项需求。而离子液体-有机溶剂混合电解质,充分发挥了二者的协同作用和功能,符合高镍三元电池高稳定、高安全、高能量的要求。
尽管离子液体-有机溶剂混合电解质在高镍三元材料电池中取得了重大研究成果,但目前仍有很多问题亟待解决。
(1)在混合电解质的应用过程中,离子液体与有机溶剂的相互作用机理尚不明确,且缺乏对离子液体基混合电解质性能预测的理论计算。
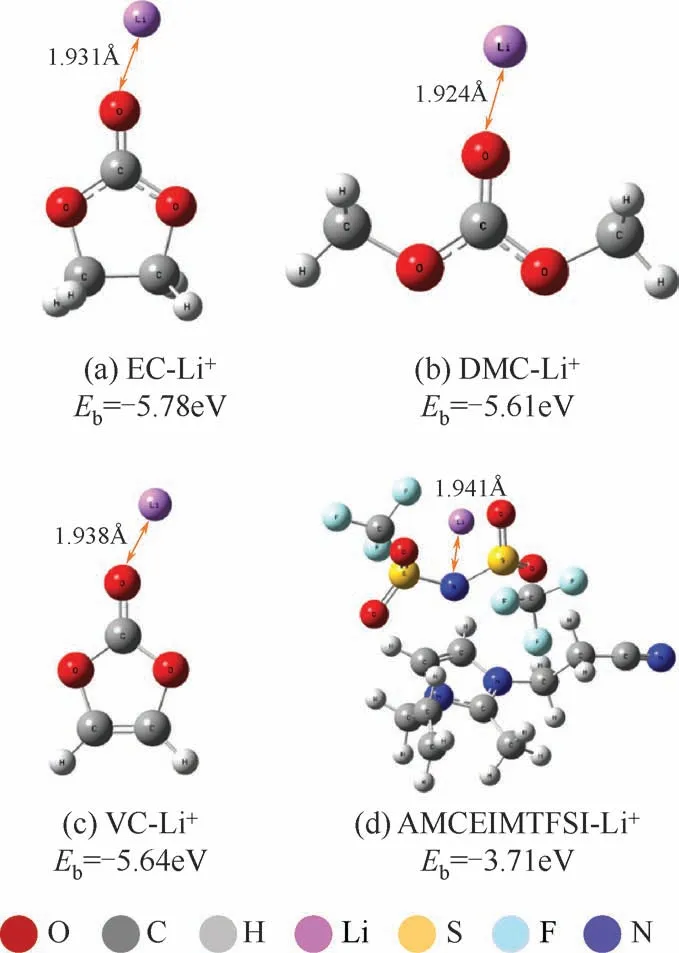
图17 离子液体添加剂及有机溶剂分子与Li+的结合能[62](1Å=0.1nm)
(2)在高镍三元电池体系中,对离子液体-有机溶剂混合电解质Li+迁移率及输运特性等分子动力学的研究尚空缺。
(3)离子液体成本较高、种类有限。开发新型的离子液体以降低成本、提高性能是目前高镍锂离子电池研究的重点之一。
随着研究的进一步深入,离子液体-有机溶剂混合电解质的相关理论体系会更加完善,微观性能研究会更加广泛,应用在高镍三元锂离子电池中将会发挥更大的作用。
