热电池用过渡金属二硫化物及其复合材料的研究进展
2021-04-20黄国勇李毅屈辰玮孙晓华李勃天戈磊叶海木张红梅
黄国勇,李毅,屈辰玮,孙晓华,李勃天,戈磊,叶海木,张红梅
(1 中国石油大学(北京)新能源与材料学院,重质油国家重点实验室,北京102249;2 贵州梅岭电源有限公司,特种化学电源国家重点实验室,贵州遵义563003)
热电池是一种利用热源将熔盐电解质加热熔融,从而被迅速激活的储备电池[1]。其具有贮存时间长(10~25 年)、激活迅速可靠(0.2~2.0s)、使用环境温度广(-50~100℃)、比能量与比功率高等优点,被广泛用于引信电源、火警电源、航天航空应急电源等[2-5],在特种化学电源行业中拥有战略性地位。普通单体热电池如图1所示,由正极、负极、电解质、集流体、加热板等组成。根据负极材料的不同可分为钙系热电池、镁系热电池和锂系热电池,其中锂系热电池在当前工业中应用最广。然而,发展迅速的航空航天、国防军事等领域对配套用锂系热电池的性能提出了越来越高的要求,例如,延长工作寿命、增大放电功率、提升高温性能等。但是目前主要的锂系热电池正极材料依然存在性能短板,如电极电位低、电阻大、热稳定性不佳等,严重掣肘热电池行业的发展。前人研究指出,热电池的电化学性能主要取决于正极材料[6-7]。因此,为了推动锂系热电池的升级换代,开发放电电压高、放电功率大、热稳定性好、导电性优良的新型正极材料迫在眉睫。
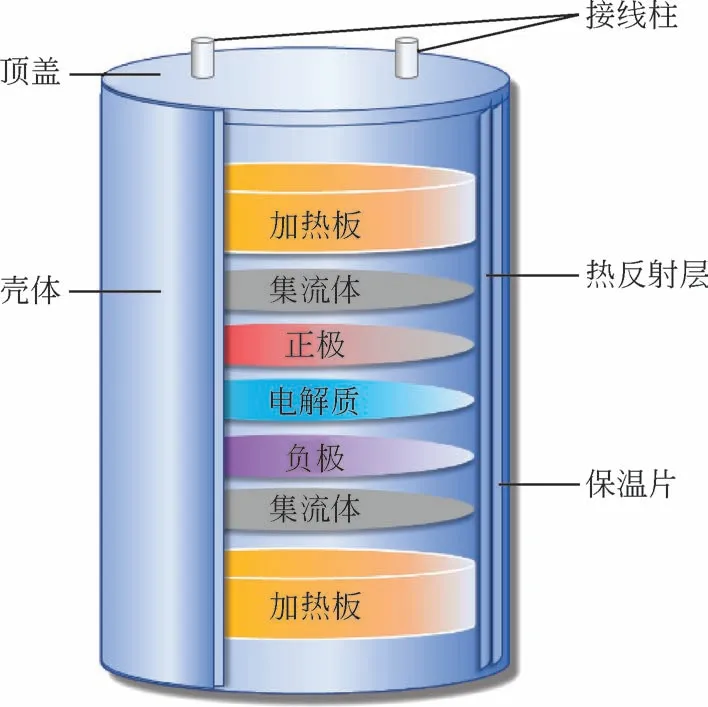
图1 单体热电池结构
目前,备受关注的锂系热电池正极材料主要分为以下几类:①过渡金属氧化物[8-15]。过渡金属氧化物正极材料主要有NiO、V2O5、MnO2及Cu2O 等,虽具有较高的放电电压(2.0~3.0V),但内阻较大、导电性弱且比能量较低,同时存在与电解质兼容性较差的问题,因此在工业应用方面还远远不够成熟[16]。②过渡金属氯化物[17-20]。过渡金属氯化物正极材料主要有NiCl2、CrCl3等,其理论电动势较高,适合大功率放电,但导电及导热性能差,且易溶于卤族电解质。③过渡金属氟化物[21-24]。过渡金属氟化物正极材料主要有FeF3、NiF2、CuF2等,虽具有较高的电极电位与比容量,但制备较为困难,且放电产物熔点较高,易导致电解质提前固化;同时,氟化物与氧化物黏结剂相容性较差的问题尚需进一步解决[23]。④过渡金属硫化物。过渡金属硫化物具有稳定的放电性能和成熟的制备工艺,十分适合商业化应用,但同时也存在放电电压较低的问题。通常,过渡金属硫化物可分为一硫化物[25-28]、二硫化物[29-32]及多硫化物[33-35]。其中,过渡金属二硫化物,如FeS2、CoS2与NiS2等应用最为广泛。FeS2比能量高、原料来源丰富、生产成本低廉,是当前最为成熟的锂系热电池正极材料[36]。CoS2及NiS2因具备热稳定性好、电阻率低、比能量高的优势,也是正极材料的优质选择[37-38]。
发展至今,过渡金属二硫化物已然成为锂系热电池最理想的正极材料之一,而且其性能仍然具备优化提升的空间,因而拥有巨大的研发潜能与应用价值。故本文以过渡金属二硫化物及其复合材料为对象进行详细综述。
1 过渡金属二硫化物
1.1 FeS2材料
FeS2在自然界中一般以黄铁矿的形式存在且储量丰富。20 世纪70 年代,黄铁矿首次作为高温电极材料进入研究者视野,随后美国阿贡实验室推出LiMx/FeS2热电池[39-40]。此后,FeS2作为正极材料在锂系热电池中一直发挥着重要作用。
在放电机理方面,诸多学者均进行了深入的研究。图2 是LiB/FeS2热电池典型的放电曲线,其分别在2.0V、1.45V 和1.0V 处存在电压平台。种晋等[41]对于该放电现象进行了解释,图2 中3 个电压平台分别对应于FeS2在热电池中电化学反应的3个步骤,具体反应如式(1)~式(3)。


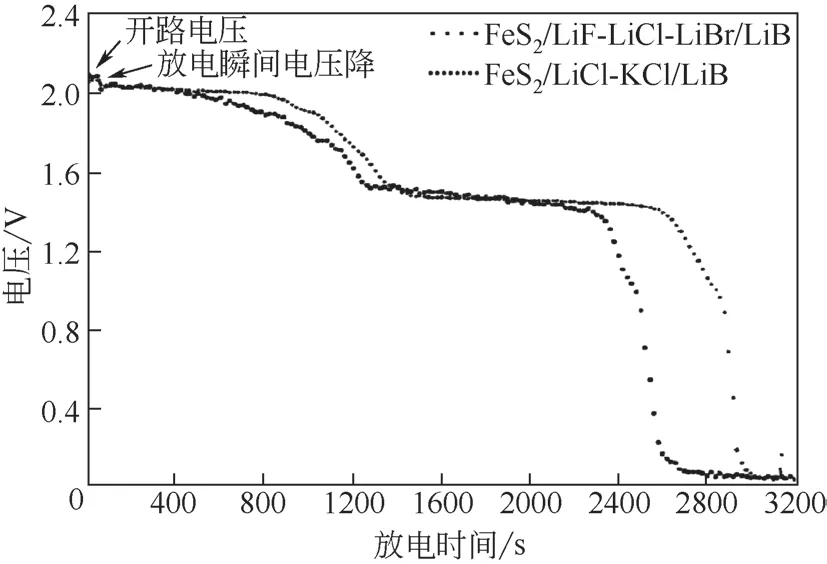
图2 分别采用LiF-LiCl-LiBr和LiCl-KCl电解质体系的LiB/FeS2热电池在0.1A/cm2放电电流密度下的放电曲线[41]


截止目前,对于FeS2放电过程中的中间相演变以及第一放电平台的放电机理还未有新的报道,因此尚需依托可靠技术对其进一步研究论证。
在制备合成方面,储量丰富的天然黄铁矿是FeS2最优质的来源。但其易含杂质,颗粒尺寸不均且电化学性能有待提升,故国内外研究者也通过人工合成来获得高性能的FeS2材料。1994 年,Dallek 等[43]利用高温固相法合成出可作为热电池正极的FeS2,粒径为300~500nm,但产物中含有FeS杂质,且电化学性能不佳。胡静[44]同样以高温固相法制得粒径为2~10μm 的FeS2。但该FeS2形貌不规则,且团聚较为严重。在0.25A/cm2的电流密度下,虽然其峰值电压可达2.01V,但截至1.5V 时,放电时长仅为299s。Primo 等[45]以铁粉和硫粉为原料,通过机械球磨制备出FeS2纳米球,尺寸约为85nm,无杂相,但颗粒间团聚较为严重,形貌规则度不高,且热稳定性有待提升。Chin 等[46]同样采用球磨法,以NaCl 为分散剂,制得20~30nm 的FeS2,同样存在颗粒形貌不规则及团聚的问题。Zeng 等[47]采用水热法合成出FeS2材料,并探讨了投料配比和反应条件对FeS2形貌、结构和性能的影响。研究发现,通过调控投料比与水热条件,可得到纯净均一的FeS2。纯相FeS2呈立方体结构,粒径约1μm,且放电比容量接近理论值。Yang等[48]同样利用水热法得到一系列立方状FeS2正极材料,粒径介于80~700nm。在500℃、0.5A/cm2的放电条件下,单体热电池的放电比容量介于330~406mA·h/g,比能量约6000W·h/kg。Soumitra 等[49]采用溶剂热法,以乙二胺为溶剂,通过不同铁盐与硫脲反应生成不同形貌的FeS2(纳米线、纳米棒和纳米管),该方法的优势在于样品的形貌均匀且可控。Liao 等[50]同样以溶剂热法制备出孔径约为100nm 的FeS2纳米管,其形貌规则并具有较高的放电比容量。
通常,制备工艺可决定产品的微观形貌、颗粒尺寸及聚集状态,进而影响材料的整体性能[51]。表1将上述FeS2常用合成方法进行了对比。其中,水热法与溶剂热法的优势在于可以调控微观形貌并能制备出更加均一纯净的FeS2材料。但就生产成本而言,高温固相法及机械球磨法更具经济性,更适合扩大化生产。
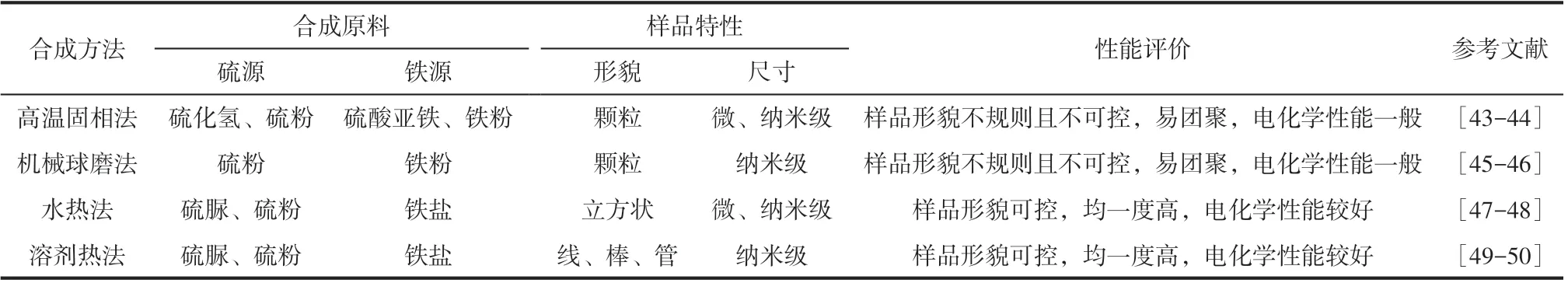
表1 FeS2的常用合成方法对比
除上述常用方法外,一些新型的材料制备工艺也被用于FeS2的合成。Xiao等[52]以单模微波辐射法原位合成出具有不同微观结构的FeS2。如图3所示,辐射温度为120℃时可得到纺锤状FeS2颗粒,180℃时则可得到FeS2纳米片。Wei 等[53]采用液相沉淀法将不同硫源(Na2S、Na2S4和NaHS)与FeCl3在氮气氛围下反应生成1~2μm的FeS2。Henríquez等[54]将电化学沉积和低温水热技术结合,无需硫化便可得到黄铁矿薄膜。该薄膜质地均匀且黏附性良好,无明显杂质。之后,Henríquez等[55]在较低的温度下,通过微波辅助水热法合成出高纯黄铁矿型FeS2,尺寸介于150nm~1μm,并且微观形貌可控。遗憾的是,上述研究并未将FeS2作为热电池正极材料进行评估。但就制备而言,上述方法仍具有很大的参考价值。

图3 FeS2的SEM图[52]
1.2 CoS2材料
CoS2的分解温度约为650℃,比FeS2高100℃左右,其较好的热稳定性有利于拓宽热电池的工作温度区间[56]。同时,CoS2还具有电阻小、比表面积大、自放电低的优点,因而也被视为当前最具潜力的FeS2替代材料。
在放电机理方面,Masset 等[57]提出CoS2的放电机理不同于FeS2,其区别在于CoS2在放电过程中不会形成锂化的中间体。具体反应历程如式(5)~式(7)所示。
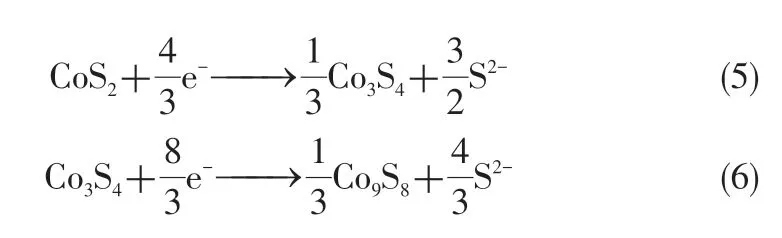
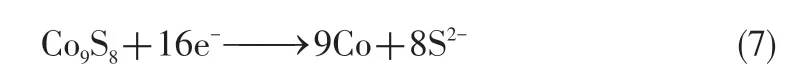
2019 年,Payne 等[58]利用原位中子衍射技术对CoS2正极在放电过程中的中间相演化进行观测,并绘制出各相组分与电压随时间变化的曲线。如图4(a)、(b)所示,在该研究中并未发现形成Co3S4的证据,反而观察到CoS 的存在,且在CoS 减少的同时,Co9S8组分随之增加。故Payne等提出CoS2在放电过程中新的晶相演变路径[图4(c)]与放电机制,如式(8)~式(10)。
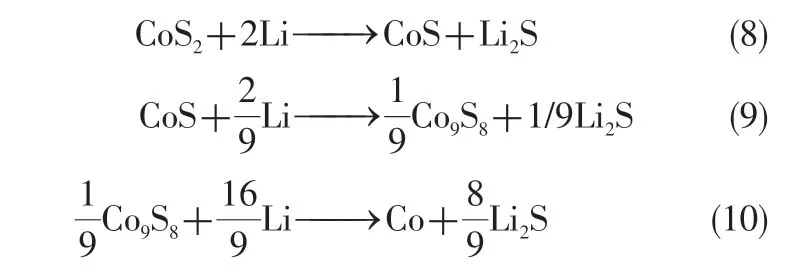

图4 CoS2正极在热电池放电过程中的晶相演变[58]
在制备合成方面,CoS2大多依赖人工合成,合成方法与制备FeS2类似。Guidotti等[59]使用高温固相法,以Co2O3、CoSO4·7H2O、Co(NO3)2·6H2O、CoBr2等作为钴源分别合成CoS2,但仅以CoSO4·7H2O为钴源合成的CoS2物相纯净单一,使用其他钴源合成的CoS2中均不同程度地混入了Co3S4或CoS1.097杂质。Wu[60]同样以高温固相法制得CoS2材料。该CoS2具有良好的热稳定性,于700℃下保温1h分解率仅为15.6%。将其应用于高功率热电池中,其稳态比功率为1690W/kg,脉冲比功率超过4700W/kg。Qin等[61]将钴粉和硫粉以1∶2 混合,利用机械球磨法制备出纯净的CoS2材料。但该CoS2颗粒形貌规则度不高,粒径分布较宽且电化学性能一般。杨潇薇等[62]在水热条件下,通过改变反应物浓度成功制备出微观形貌和结构可控的CoS2材料。脉冲放电结果表明,在放电初期的平稳阶段,CoS2单体热电池内阻比FeS2单体热电池小0.5Ω 左右。Hu等[63]利用溶剂热法合成出类球形CoS2,该CoS2球由平均粒径约5nm 的CoS2颗粒组成,具有较大的比表面积和较好的结构稳定性。魏明炜等[64]采用水热工艺在pH=5 和pH=10 时分别获得类球状和不规则块状的黄铁矿型CoS2,其对应的热分解温度分别为650℃和610℃。在0.1A/cm2的条件下,两种CoS2正极材料的电化学性能较为相近。而在0.8A/cm2的条件下,类球状CoS2的电化学性能则更加出色。该结果表明规则的形貌对提升材料电化学性能较为有利。
表2 对比了上述CoS2的常用合成方法。与合成FeS2类似,水热法与溶剂热法制备的CoS2综合性能更好;虽然高温固相法以及机械球磨法产量大且成本低,但所获CoS2的电化学性能还有待提升。
此外,一些新的方法也被用于CoS2合成。Wu等[65]利用微波加热法,通过优化反应条件,合成出结晶度高、形态丰富的CoS2材料。该方法的优势在于仅需要10min便可合成高纯度CoS2。Guidotti等[66]采用离子喷涂法制得片状CoS2,该CoS2片的尺寸比传统方法制备的更薄。而减小CoS2正极片厚度可降低电阻率和极化率,并能提高放电比容量。该研究为直接制备CoS2薄片电极提供了思路。
1.3 NiS2材料
NiS2与FeS2、CoS2的性质十分相似,其热稳定性能和电化学性能介于CoS2与FeS2之间[57]。但由于NiS2在生产成本上不占优势,因此不具备替代FeS2和CoS2的实力,故国内外对其研究相对较少。
在放电机理方面,Preto等[67]首先研究了NiS2在热电池中的放电机理,并给出如下所示的晶相演变过程:NiS2→NiS→Ni7S6→Ni3S→Ni。
2017 年,Payne 等[37]以Li13Si4为负极,在500℃下对NiS2进行放电测试,同时利用原位中子衍射技术对放电过程中的中间相演变进行观测,并绘制出各相组分与电压的变化曲线[见图5(a)、(b)]。由于并未在放电过程中发现Ni7S6的形成,故Payne等提出了NiS2在放电过程中新的晶相演变路径[图5(c)]与放电机理,如式(11)~式(13)。
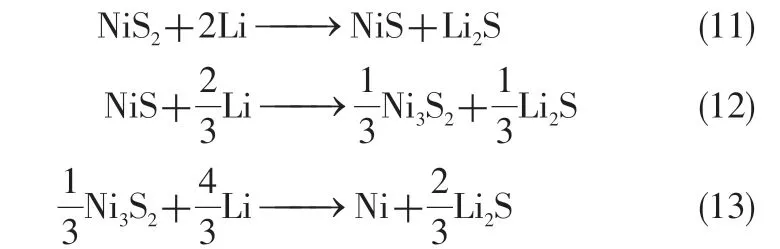
然而,Jin等[68]于同年发表的关于NiS2放电中间相演化的研究成果中提供了Ni7S6形成的证据。因此,关于NiS2在热电池中的放电机理,尤其是中间相的演化机制尚未完全定论,还需进行深入的研究与探讨。

表2 CoS2的常用合成方法对比
在制备合成方面,谌冰等[69]利用改良的高温固相法,以镍粉与硫粉为原料成功合成出单相NiS2。该工艺采用新颖的微波加热技术,克服了常规固相反应耗时耗能的缺陷,可将反应时间缩短至30min。Jin 等[68,70]通过机械球磨法制备出平均尺寸为85nm 的NiS2材料。该NiS2具有良好的电化学性能,在0.1A/cm2和0.5A/cm2电流密度下,分别具有794mA·h/g 和654mA·h/g 的高比容量,综合放电能力明显优于微米级NiS2。Yang等[71]通过水热工艺合成了平均尺寸约为2.8μm的立方相NiS2。在500℃、0.5A/cm2下,截止1.5V时,该NiS2正极的比容量达326mA·h/g,比功率为580W·h/kg,分别是天然黄铁矿的1.1倍和1.3倍。林保山等[72]同样采用水热工艺,在不同pH 下得到了不同形貌(近立方状、球状、片状)的NiS2。其中,近立方体状NiS2的综合放电性能最好,其第一放电平台在1.85V附近,截止1.5V 时,放电比容量为293.8mA·h/g,并在锂化后提高至321.2mA·h/g。Yang 等[73]利用溶剂热法分别合成出十二面体状与球状的NiS2材料。两种NiS2的形貌极为规则,但分解温度均在420℃以下,热稳定性尚待提升。

图5 NiS2正极在热电池放电过程中的晶相演变[37]
如表3所示,在上述研究中,水热法与溶剂热法在调控材料形貌方面依旧具有出色的表现,但所制备的NiS2并无明显的性能优势。此外,综合表1~表3可知,通过机械球磨法合成材料的粒径普遍更小,而较小的材料尺寸对于增大反应活性,减小电化学极化较为有利[68]。
此外,Huang 等[74]通过溶胶凝胶法将氧化镍沉积在金基底上,再经高温硫化后制得晶粒尺寸为60nm 黄铁矿型NiS2薄膜。Guo 等[75]以镍盐为金属源、H2S等离子体为硫源,通过原子层沉积技术合成出结晶良好的NiS2薄膜。上述两种NiS2薄膜不添加黏合剂,在提升活性物质的利用效率方面具有巨大优势,虽然并未应用于热电池中,但其合成方法仍具有一定参考价值。
1.4 其他二硫化物材料
Zheng 等[76]通过水热法成功合成出球状、片状及块状的MoS2正极材料。其中,MoS2微球由厚度约10nm 的纳米片组成,形貌规则,尺寸均一,性能远优于其他两种MoS2材料。与普通的FeS2或CoS2材料相比,球状MoS2热稳定性更好,放电时间更长,放电容量更大,更适合作为长寿命热电池的正极材料。此外,Zheng等进一步提出了MoS2可能的放电机理,大致分为三个步骤:①嵌锂化合物(LixMoS2)的生成;②脱硫后生成低价嵌锂化合物;③低价嵌锂化合物的还原。
Guo 等[77]以金属钨和硫粉为原料,利用高温固相法成功制得片状WS2纳米材料。该WS2热稳定性极好,在高达1200℃下依然能保持稳定。同时,Guo 还研究了WS2作为热电池正极的适用性。相对于LiB 负极,WS2正极的开路电压为1.43V,在0.15A/cm2的电流密度下,截止1.0V时,LiB/WS2单电池的比容量为334.7mA·h/g。因而WS2是一种潜在的高温正极材料。

表3 NiS2的常用合成方法对比
表4总结了上述过渡金属二硫化物的优势、劣势与主要性能参数。其中,FeS2电阻较大,热稳定性差,不适配于高性能的热电池体系,但由于天然储量极其丰富,因而对工业化生产较为有利;CoS2电阻小,综合放电性能突出,但是受限于Co 元素的自然储量较小,故未能广泛投入工业化生产之中;NiS2热稳定性及电化学性能均介于FeS2与CoS2之间,但不具备生产成本优势;MoS2热稳定性良好,放电时间较长,但综合放电能力相对较弱,导电性能也需要进一步提升;WS2具有十分出色的热稳定性能,但其开路电压及理论放电比容量均相对较低,因而应用前景一般。

表4 主要过渡金属二硫化物正极材料的优势、劣势及性能参数
此外,电极电位较低、不适合大功率放电是过渡金属二硫化物的普遍问题。但相比其他种类的正极材料,过渡金属二硫化物综合放电性能更好,经济性更高。因此,通过改性进一步提升过渡金属二硫化物电化学性能的策略更具有实用价值。
2 过渡金属二硫化物复合材料
2.1 双金属二硫化物复合材料
研究表明,双金属电极材料不仅可以继承单金属电极材料的优势,而且能在一定程度上弥补其不足[43,78]。此外,以廉价金属取代部分稀贵金属还可大幅降低电极材料的生产成本,因而诸多研究学者逐渐将目光转向双金属二硫化物复合材料。
Dallek 等[43]以高温固相法合成出Fe0.8Co0.2S2、Co0.8Ni0.2S2等一系列复合正极材料。与FeS2相比,所有双金属二硫化物的电阻率均大幅降低,导电性能得到显著提升。Cheng等[79]制得多种Fe1-xCoxS2材料。其中,Fe0.85Co0.15S2的放电电压可达1.8V以上,截止1.5V时,比容量超过280mA·h/g,放电性能明显优于FeS2、CoS2以及FeS2/CoS2共混物。类似地,本文作者课题组[80]借助水热工艺,同样制备出一系列Fe1-xCoxS2(0.2≤x≤0.8)材料。所得材料呈八面体型,平均颗粒尺寸为200~300nm,放电平台电压约1.85V。在450℃、0.1A/cm2的条件下,截至1.5V时,放电比容量最高达285mA·h/g。Zhang 等[81]以Co 掺杂FeS2制备了球状Co0.5Fe0.5S2纳米材料,其形貌规则,粒径介于50~500nm。Hu 等[82]分别通过高温固相法和液相法合成了Fe0.5Co0.5S2正极材料。结果显示,Fe0.5Co0.5S2的电化学性能远优于FeS2,其中以液相法制备的Fe0.5Co0.5S2的物理特性和电化学性能则更为出色。杨坤坤等[83]合成了不同x值的NixCo1-xS2材料。当x=0.3时,以Ni0.7Co0.3S2为正极的单体热电池具有最佳的放电性能,放电过程中内阻增幅较小,截止1.5V 时,其放电比容量为276.5mA·h/g。He等[84]制备出多种空心微球结构的CoxNi1-xS2(x为0.1~0.5)。当x=0.1 时,以Co0.9Ni0.1S2为正极的单体热电池电化学性能最佳。其在450℃、0.1A/cm2的条件下,初始放电电压达2.037V;截止1.5V时,比容量为297.4mA·h/g,电化学性能优于同条件下的NiS2材料。Yu 等[85]制备了Co0.7Fe0.3S2与Co0.3Fe0.7S2正极材料。两种材料的粒径比同条件下制备的CoS2与FeS2更小,在空气中的热稳定性得到明显提升,并具有更低的电阻和更出色的脉冲放电性能。
表5总结了上述双金属二硫化物的合成方法及主要性能。如表5所示,目前研究者普遍采用高温固相法或水热法制备双金属二硫化物,且所获材料的性能均优于同条件下制备的单金属二硫化物。因此,利用元素掺杂制备双金属二硫化物复合材料是十分有效的改性策略。
2.2 过渡金属二硫化物/碳素类复合材料
以石墨烯(GO)、碳纳米管(CNTs)等为代表的碳素类材料具有较大的比表面积、优异的导电性、出色的化学稳定性及结构稳定性,因而在电池领域具有巨大的应用潜力[86-90]。
2.2.1 FeS2/碳素类复合材料
Choi等[91]分别将不同质量分数的炭黑(CB)或多壁碳纳米管(MWCNTs)加入FeS2制备出一系列复合材料。其中,添加0.1%MWCNT(质量分数)的FeS2电化学性能最佳,其开路电压为1.9V,具有较长的放电时间和较高的平台电压,且总极化值明显低于普通FeS2。Ko 等[92]比较了FeS2-MWCNTs 复合薄膜与其他正极材料的差异性。如表6所示,由于不使用黏合剂,FeS2-MWCNTs 复合薄膜中活性物质的占比更高,并且其放电比容量是颗粒型正极的2.3 倍,是有机黏合剂薄膜正极的1.13 倍(见图6)。此外,以FeS2-MWCNTs 复合薄膜为正极的单体热电池还具有较低的制造成本。

表5 双金属二硫化物性能总结
Wang 等[93]利用水热法合成出FeS2/RGO(还原氧化石墨烯)纳米复合材料,并对其放电性能进行了系统性研究。结果发现,加入石墨烯后,FeS2的比表面积增大,稳定性及导电能力明显提升,其单体热电池的放电性能得到改善。杨坤坤[94]同样制备了FeS2/RGO复合材料。在450℃下,以该材料为正极的单体热电池放电起始电压为1.818V,截止1.5V 时,放电比容量为314.9mA·h/g;在500℃下,放电起始电压为1.898V,截止1.5V 时,其放电比容量为302.3mA·h/g。与普通FeS2相比,添加RGO提高了放电比容量,并减小了内阻极化,表明FeS2/RGO正极材料的确能提升单体热电池的放电性能。

表6 不同正极材料的组分及含量[92]

图6 不同类型正极材料在500℃下的脉冲放电曲线[92]
2.2.2 CoS2/碳素类复合材料
Xie等[95]将蔗糖在400℃下热解,得到碳包覆的CoS2复合材料,其微观形貌如图7(a)、(b)所示。以该材料为正极时,单体热电池的放电时长远超普通CoS2热电池[见图7(c)],其第一放电平台的比容量比CoS2高出50mA·h/g,且脉冲放电性能也更加出色。巴忠菊等[96]将CoS2与葡萄糖经高温煅烧后制得炭化CoS2复合材料。炭化后,LiSi/CoS2热电池的尖峰电压降低了81.3%,比容量得到大幅提升。Xie等[97]同样合成了碳包覆的CoS2复合材料。以该复合材料为正极的单体热电池在1.7V 的截止电压下,具有235.8mA·h/g 的比容量和416.9W·h/kg 的比能量,空气稳定性明显增强。在干燥空气中存储3个月后仍具有232.4mA·h/g 的比容量,比相同条件下的CoS2高出43mA·h/g。
此外,Xie 等[98]还在碳纳米管(CNTs)上生长CoS2得到了CoS2/CNTs 复合正极材料。CoS2与碳纳米管的结合使复合正极的电导率和放电性能得到提升,但对其热稳定性影响甚小。电化学性能方面,以该复合材料为正极的单体热电池,在0.5A/cm2的脉冲电流密度下具有2.45W的脉冲功率;截止1.7V时,其放电比容量与能量密度分别为219.8mA·h/g与387.2W·h/kg。
杨坤坤[94]为进一步提升CoS2的电化学性能,采用水热工艺制备了CoS2/RGO 复合正极材料。在500℃、0.2A/cm2的条件下,截止1.5V 时,CoS2/RGO 的放电比容量可达327mA·h/g,高于CoS2的266mA·h/g。并且在放电过程中,复合正极的放电电压下降更慢,第一放电平台电压也更平稳。杨潇薇等[62]同样对CoS2/石墨烯复合材料的电化学性能进行了研究。结果表明,与CoS2相比,CoS2/石墨烯复合正极在大电流放电时的电化学极化更小,具有更出色的电化学性能。
2.2.3 NiS2/碳素类复合材料

图7 CoS2/C复合正极材料的微观形貌与放电性能[95]
Jin 等[99]以硬脂酸为碳源,经高温炭化后制备出无壳石榴结构的改性纳米NiS2材料,其微观形貌如图8(a)、(b)所示。经过碳改性后,NiS2的初始热分解温度从400℃升至590℃[见图8(c)],并在高温下表现出优异的放电性能。在500℃、0.1A/cm2的条件下,截止1.4V 时,比能量及比容量分别为1082W·h/kg与610mA·h/g。之后,Jin 又基于原位合成法在碳纤维布(CF)上构建了柔性自组装的NiS2/C薄膜电极(NiS2/C@CF)[100]。其中,碳布作为集电器和存储位置;热解碳用作黏合剂和导电添加剂。该NiS2/C@CF 复合正极在500℃、0.03A/cm2的条件下,截止1.75V 时,比容量达1663mA·h/g;在0.025A/cm2(100s)~0.1A/cm2(2s)的脉冲电流下,脉冲电压为2.25~2.0V,并具有1063mA·h/g 的比容量。此外,该团队还制备了碳包覆的NiCl2/NiS2双活性正极材料[101]。当NiCl2和NiS2的质量相当时,NiCl2/NiS2@C 复合正极的初始放电电压可达2.78V。在500℃、0.1A/cm2的条件下,截止0.5V 时,其比容量可达946mA·h/g。

图8 NiS2/C复合材料的微观形貌与热稳定性[99]
综上所述,过渡金属二硫化物与碳素类材料复合后,其电化学性能均能得到不同程度的改善,尤其在提升比容量、导电能力与热稳定性以及降低电化学极化方面效果显著。这主要归因于:①碳素类在复合材料中可形成导电网络,具有增大电导率,降低电阻极化的作用;②碳结构的支撑可使得复合材料更加稳定;③碳的包覆可以减弱电解液对活性物质的侵蚀。
图9总结并展示了上述研究报道中的金属二硫化物及其复合材料的放电电压与放电比容量的分布情况。如图9所示,相较普通金属二硫化物,大部分复合材料的电化学性能均得到了不同程度的优化。其中,通过与高电压材料复合,并经过碳包覆得到的NiCl2/NiS2@C正极材料,其在放电电压与放电比容量方面的提升尤为显著。因而可以预见,在储能电池行业飞速发展的大环境下,使用多种手段进行综合改性将会是金属二硫化物今后研究的主要方向。

图9 过渡金属二硫化物及其复合材料的实际放电电压及放电比容量分布(除WS2以外,截止电压均为1.5V)
3 结语与展望
3.1 过渡金属二硫化物正极材料存在的问题
截止目前,对于过渡金属二硫化物的研究及应用还存在以下几点问题。
(1)放电机理尚存在一些分歧。目前,诸多学者对于本综述中涉及的几种过渡金属二硫化物的放电机理均进行了详细研究,但结果却不尽相同,问题主要集中在反应中间产物的类型不同,故还需进一步研究论证。
(2)放电电压较低。过渡金属二硫化物的放电电压一般不超过2.0V,严重掣肘其在大功率、高电压热电池中的应用。然而放电电压受限于材料自身,因而过渡金属二硫化物放电电压低的问题较难得到解决。
(3)活性物质利用效率低。现有金属二硫化物在热电池中的利用率普遍不足50%,严重影响其在实际应用中的表现。主要原因是金属二硫化物为粉体材料,自身机械性能差,因此需要添加黏合剂方可使用。而黏合剂的加入不仅减小活性物质的占比,而且会对其放电性能产生负面影响。
3.2 过渡金属二硫化物电化学性能的改性手段
当前可用于提升过渡金属二硫化物电化学性能的手段主要有以下几种。
(1)调控材料尺寸,制备纳米级过渡金属二硫化物。材料纳米化主要有三点优势:①增大比表面积,增加反应活性位点;②缩短锂离子的传输距离,减小电化学极化;③促进中间相的演化,减缓比容量衰减。
(2)针对不同需求,制备复合材料。与不同材料进行复合,可实现不同目的:①引入其他金属元素,制备多元金属二硫化物,可以取长补短,并能降低一部分生产成本;②与碳素类复合,可增大电导率,提升稳定性,减小极化电阻;③与高电压材料复合,可提升放电电压,增大放电功率。
(3)优化加工工艺,制备薄膜材料。薄膜正极通常具有较高的活性物质利用率和较大的放电比容量。当前已有研究者使用流延成型和丝网印刷等工艺制备得到金属二硫化物薄膜,虽未得到广泛应用,但其方法值得借鉴。
3.3 过渡金属二硫化物正极材料的发展方向
为推动过渡金属二硫化物正极材料的发展,本文认为还需在以下几个方面进行探索。
(1)部分金属二硫化物的放电机理还需进行更加深入的研究,特别是借助先进的原位技术对中间相演化进行监测,论证现有放电机理的正确性,并为新型二硫化物的放电机理研究提供借鉴。
(2)优化并结合多种改性手段,克服或改善过渡金属二硫化物的性能短板,进一步优化其导电能力、热稳定性、放电电压及使用寿命,拓展其在高性能热电池领域的应用。
(3)系统研究过渡金属二硫化物的微观形貌及尺寸对电化学性能的影响规律,并依托制备技术提出合理的工艺路线,研发出结构稳定、性能优异的过渡金属二硫化物正极材料。
(4)探索新型的薄膜电极材料制备技术,研发出活性高、位点多、形貌规整的过渡金属二硫化物薄膜,以期能大幅提升活性物质的利用率。
