棒状β-FeOOH纳米酶的制备及其类酶催化机理研究
2021-04-20王丽霞高可奕贾彤彤薛朝华
杨 冬, 雷 蕾, 王丽霞, 高可奕, 贾彤彤, 王 雪, 薛朝华
(1.陕西科技大学 化学与化工学院 中国轻工业轻化工助剂重点实验室, 陕西 西安 710021; 2.深圳君和生物科技有限公司, 广东 深圳 518101; 3.陕西科技大学 轻工科学与工程学院, 陕西 西安 710021)
0 引言
天然过氧化物酶(HRP)作为一种精细的生物催化剂,以H2O2为电子受体催化底物发生氧化反应,可使生物体内的生化反应速率提高1019倍[1].由于其较高的催化活性和底物特异性[2],HRP在工业、医疗、生物等领域有着广泛的前景.尽管如此,在实际操作中HRP仍存在着一些固有的缺陷,如制备和纯化成本高、运输和储存大、稳定性差、催化活性对环境条件的敏感性等极大地限制了其在实际生产中的应用[3,4].为了克服上述弊端,研究人员付出巨大努力开发了具有酶催化活性的纳米粒子来模拟天然酶的功能.与天然酶相比,纳米酶具有成本低、贮存时间长、稳定性高、在恶劣环境下的稳定性好、产量大等优点.研究发现Ag、Au、Pt等贵金属以及铁基金属材料具有优越的类过氧化物酶催化活性,可催化H2O2与有机底物(以TMB为例)的氧化反应,使体系由无色变为蓝绿色,催化反应如下:
纳米酶可以通过优化合成途径来改善其尺寸和形态[5,6],研究发现,纳米酶尺寸越小,催化活性越高,这是因为尺寸较小的纳米粒子的比表面积相对较大,可以更加充分地与底物接触,提高催化活性[3].除了尺寸外,粒子的表面结构也会影响其催化活性.Liu等[7]报导了三种不同形貌(团簇微球、八面体、三角形)的Fe3O4的过氧化物酶催化活性,研究发现其催化活性:团簇微球 > 三角板 > 八面体,这一现象与材料暴露的Fe位点有关,比表面积较大的粒子可以暴露更多的活性位点,增加与底物的有效接触面积,提高纳米酶的催化活性.
β-FeOOH是一种天然矿物,广泛存在于土壤水体和沉积物中,因其特殊的隧道结构、稳定的理化性质、巨大的比表面积和丰富的羟基基团而受到广泛关注.目前已报导的β-FeOOH棒的制备方法包括水热法、热分解法、沉淀法、亚铁氧化法、微乳液法、微波水解法等,这些方法往往需要昂贵的仪器,反应条件复杂,生产周期较长,生产效率低.此外,上述方法制备的粒子多为微米级,形貌调控难度大,影响因素多,不利于大规模生产.Taeghwan等报导了一种Wrap-bake-peel法制备形貌可控的纳米级β-FeOOH棒[8],但所得的β-FeOOH纳米棒分散性较差,后续应用时需表面改性改善材料分散稳定性.
研究者发现β-FeOOH具有类过氧化氢酶活性,可促进H2O2的分解产生·OH[9].在随后的研究中,Zhang等制备了一种Au/FeOOH-APC复合材料,利用Au和FeOOH棒的协同作用促进体系中H2O2分解为H2O和·OH[10].但上述研究都没有系统的对FeOOH的类过氧化物酶活性以及催化机理进行讨论.
为了进一步探讨β-FeOOH的酶催化活性及机理问题,本课题采用了一种简单地低温水解沉淀法制备了一种具有类过氧化物酶活性的β-FeOOH纳米棒.通过分光光度计法测定·OH的产生情况,对类酶催化的机理进行讨论,通过以TMB作为显色底物评价了β-FeOOH纳米棒的酶催化效果,并与天然HRP进行了对比,为纳米酶代替天然HRP的实际应用提供了新思路.
1 实验部分
1.1 实验试剂及仪器
1.1.1 主要试剂
六水合氯化铁(FeCl3·6H2O),国药集团化学试剂有限公司;聚乙烯亚胺(PEI,Mw~750000),上海泰坦科技股份有限公司;无水乙醇,国药集团化学试剂有限公司;3,3′,5,5′-四甲基联苯胺(TMB),Sigma-Aldrich;乙酸(CH3COOH),AR,国药集团化学试剂有限公司;无水乙酸钠(CH3COONa),国药集团化学试剂有限公司;30%双氧水(H2O2),天津市科密欧化学试剂有限公司;水杨酸(C7H6O3),上海泰坦科技股份有限公司.以上试剂均为分析纯,无需进一步纯化即可使用.
1.1.2 主要仪器
场发射扫描电子显微镜(SEM),日本HITACHI公司;透射电子显微镜(TEM),美国FEI公司;傅里变换红外光谱分析仪(FT-IR),德国布鲁克Bruker公司;X-射线粉末衍射仪(XRD),德国布鲁克Bruker公司;X光电子能谱(XPS),美国 Thermo Scientific 公司;紫外可见分光光度计(UV-Vis),美国安捷伦 Agilent 公司.
1.2 β-FeOOH纳米棒的制备
采用先前的报导的方法[11]并做了改进,制备了β-FeOOH纳米棒,方法如下:取500μL的PEI将其分散于100 mL去离子水中,置于磁力搅拌器上待其分散均匀后,加入5.4 g FeCl3·6H2O(20mmol)磁力搅拌30 min.将上述溶液转入三口烧瓶,油浴升高温度至80 ℃,反应2 h,在此过程中,溶液由橙红色转变为黄色悬浊液.反应结束后,将所得溶液冷却至室温,随后在6 000 r/min转速下离心30 min,去除上清液,用无水乙醇和去离子水交替清洗3次去除多余的PEI,将产物分散在去离子水中,得到稳定分散的黄色溶液.
1.3 β-FeOOH纳米棒的酶催化
取4支5 mL离心管,分别编号1~4,设置1号为空白对照组,研究加入试剂对TMB显色的催化作用.试剂投入量如表1所示,其中,TMB浓度为25 mM,H2O2为50 mM,β-FeOOH纳米棒浓度为10 mg/mL,加样完成后用pH=4的乙酸-乙酸钠缓冲溶液定容至3 mL,快速混匀,室温反应5 min后用紫外可见分光光度计测定200~800 nm吸光度.

表1 β-FeOOH纳米棒催化性能
1.4 β-FeOOH纳米棒的酶催化性能评价
为评价β-FeOOH纳米棒的类酶催化性能,实验设计用米氏方程(Michaelis-Menten equation)[12]来表示β-FeOOH纳米棒的酶促动力学,并采用双倒数作图,得到Linrweaver-Burk曲线对计算米氏常数Km和最大反应速率Vm.
实验分别对底物TMB和H2O2的浓度进行了单因素控制,研究了β-FeOOH纳米棒对两种底物的亲和能力和反应速率.其中,TMB浓度为25 mM,H2O2浓度为50 mM,β-FeOOH纳米棒浓度为10 mg/mL.
TMB动力学测定:取10支离心管分别编号1~10,加入30μL的β-FeOOH纳米棒和108μL的H2O2溶液,随后依次加入24μL、48μL、72μL、96μL、120μL、144μL、168μL、192μL、216μL、240μL的TMB溶液,加入乙酸-乙酸钠缓冲溶液(pH=4),定容至3 mL,体系TMB浓度为0.2~2 mM,混匀后UV-Vis扫描(波长为652 nm,时间间隔1 s,扫描300 s).
H2O2动力学测定:取10支离心管分别编号1~10,加入30μLβ-FeOOH纳米棒和240μL的 TMB水溶液(25 mM),随后依次加入12μL、24μL、36μL、48μL、60μL、72μL、84μL、96μL、108μL、120μL的H2O2溶液,加入乙酸-乙酸钠缓冲溶液(pH=4),定容至3 mL,体系H2O2浓度为0.2~2 mM,混匀后UV-Vis扫描(波长为652 nm,时间间隔1 s,扫描300 s).
1.5 催化机理
分别取5支5 mL离心管编号1~5,设置1号为空白对照组,通过UV-Vis在510 nm处的显色研究水杨酸捕获·OH,并反应生成二羟基苯甲酸情况.实验设计如表2所示,其中水杨酸浓度为0.2 M,H2O2为3%,β-FeOOH纳米棒浓度为10 mg/mL.加样完成后用H2O调整体系体积为4 mL,混合均匀,室温反应5 min后用紫外可见分光光度计测定510 nm处的吸光度.
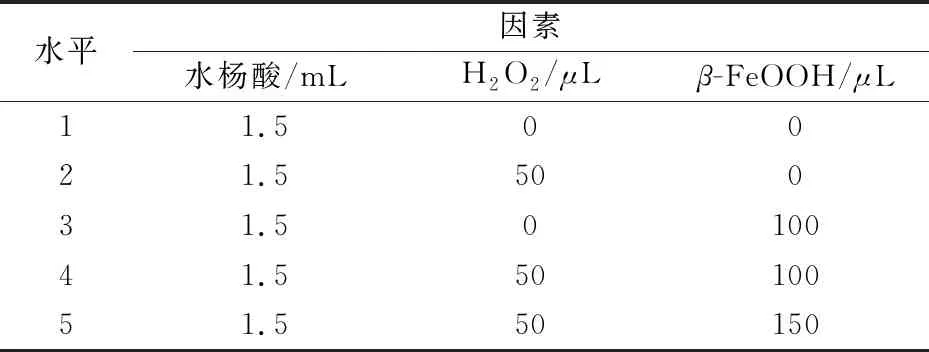
表2 ·OH含量测定
2 结果与讨论
2.1 形貌分析
纳米酶与底物的有效接触面积是影响反应速率的重要因素.实验首先通过SEM和TEM对粒子的形貌进行表征.如图1(a)所示,粒子表面光滑平整呈现出明确的棒状结构,尺寸为62*21 nm(Nanomeasure统计).纳米级棒状结构可以提供更大的表面积,暴露更多地活性位点,增加了在酶催化反应中与底物接触的机率.
从TEM图可以看出纳米粒子在水溶液中的分散性,如图1(b)所示,纳米棒呈现出良好的分散性.此外,水溶液中保存,用激光粒度分析仪测1、3、5、7、15天的平均粒径,15天内纳米粒子水溶液保持澄清透明状态,经DLS测得粒径分布在61~63 nm范围内(图1(c)),说明纳米粒子在水溶液中具有良好的分散性和稳定性.这是因为PEI附着在纳米棒的表面,PEI带有大量氨基基团对纳米粒子起到保护作用,提高了分散性,保证了粒子在水溶液中的稳定性.这种稳定性和分散性可以保证纳米酶在反应过程中与底物充分接触,有效提高酶催化的效率.

(a)电子扫描照片(SEM)

(b)透射电子显微镜(TEM)

(c)15天内平均粒径的变化(DLS)图1 β-FeOOH纳米棒的形貌表征结果
2.2 β-FeOOH纳米棒成份表征
为了更进一步讨论β-FeOOH纳米棒的化学组成,实验采用了XRD、FT-IR、XPS进行了表征,如图2(a)~(d)所示.首先确认了实验产物的物相组成,图2(a)为β-FeOOH纳米棒的XRD衍射图,由图可知,在2θ=12 °(110)、26.9 °(310)、35.4 °(211)、39.4 °(301)、56.2 °(521)显示出尖锐的衍射峰,这与典型的β-FeOOH标准卡片(JCPDS No 34.1266)出峰位置一致,衍射峰无其他杂峰且强度较强,这表明产物为结晶性能良好的β-FeOOH.
为了研究β-FeOOH纳米棒的表面官能团,实验对β-FeOOH纳米棒进行了FT-IR表征,如图2(b)所示,856 cm-1、695 cm-1对应于文献报道的β-FeOOH纳米棒的Fe-O伸缩振动峰[13],3 320 cm-1为β-FeOOH纳米棒的O-H吸收峰.3 480 cm-1为PEI的N-H伸缩振动峰,1 680 cm-1、1 531 cm-1为PEI所带的伯氨及仲胺的N-H弯曲振动峰,1 073 cm-1、1 363 cm-1为PEI中的伯氨及仲胺的C-N伸缩振动峰,这是因为在合成中引入了PEI作为一种软模板,引导β-FeOOH棒状形貌的生成[14].
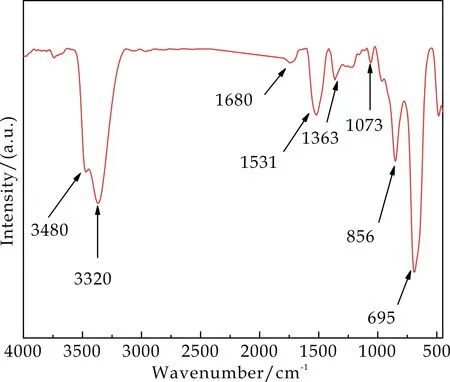
此外,实验还通过XPS讨论了β-FeOOH纳米棒的元素组成,如图2(c)、(d)所示.图2(c)为XPS全谱图,可以看出β-FeOOH纳米棒中含有Fe、O、C、N元素,其中N元素是因为PEI包裹在了β-FeOOH纳米棒的表面.在Fe2P的谱图可以看出在724.2 eV和710.7 eV处有明显的峰,分别对应于β-FeOOH纳米棒中Fe2P1/2、Fe2P3/2轨道结合能的特征峰,这与早前报道一致[15].
综上所述,实验通过以PEI作为软模板成功制备了结晶性能良好的较高纯度的β-FeOOH纳米棒,β-FeOOH纳米棒表面具有大量的羧基和氨基基团,有效提高了粒子的分散性和稳定性.这为β-FeOOH纳米棒作为纳米酶参与催化反应提供了有利条件.

(a)粉末X射线衍射图谱(XRD)
(b)傅立叶红外光谱谱图(FT-IR)

(c)X光电子能谱全谱图(XPS)
(d)XPS谱图中Fe的光谱图图2 β-FeOOH纳米棒的表征结果
2.3 类酶催化活性
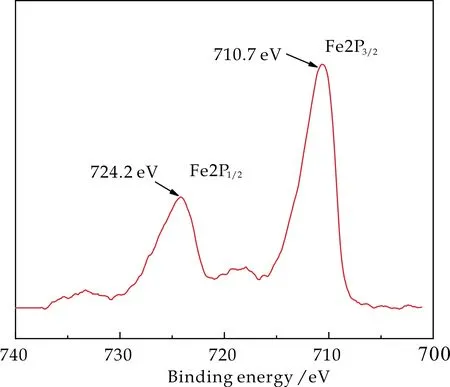
在催化剂作用及底物作用下,TMB被氧化会呈现出蓝绿色,生成ox-TMB,因而通过观察颜色 变化,以及UV-Vis扫描图谱,可以确定反应的发生.图3为不同体系中TMB催化氧化显色的UV-Vis谱图,插图为显色后目视的颜色变化.如图所示,当体系中仅存在TMB(图3中a曲线)和TMB+β-FeOOH(图3中b曲线)时,体系中无蓝绿色ox-TMB产生,从UV-Vis图也可以看出,在652 nm处无特征吸收峰,这表明TMB没有发生氧化反应.
当体系中存在H2O2时(图3中c曲线),在652 nm处有明显的ox-TMB特征吸收峰,溶液的颜色也显示出浅蓝绿色,这证明,体系中存在H2O2时可与TMB反应,使TMB氧化为ox-TMB.
当体系中加入β-FeOOH纳米棒(图3中d曲线)时,在相同时间内显示出深蓝绿色,在UV-Vis谱图的652 nm处显示出强烈的吸收峰,这表明体系中有较多的ox-TMB产生,β-FeOOH纳米棒的加入加快了TMB的催化氧化,在相同时间内反应速率更快,起到了催化反应进程的作用,具有类似天然过氧化物酶的催化效果.
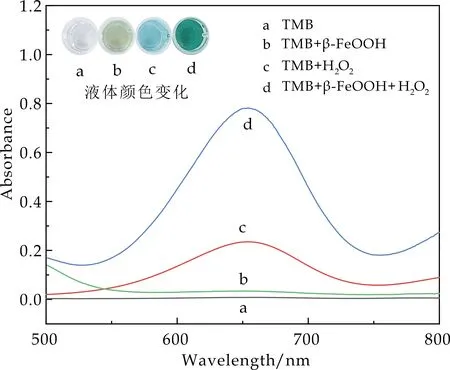
图3 TMB在不同体系中氧化显色 的UV-Vis谱图
2.4 类酶催化活性评价
基于上述研究结果,实验对β-FeOOH纳米棒的催化活性进行了评价.
保持其他条件不变,改变底物TMB或者H2O2的浓度,测定TMB氧化产物(ox-TMB)在652 nm处的吸光度的变化,并通过公式(1)将ox-TMB的吸光度值与ox-TMB的浓度C相对应,做出C随时间t变化的曲线,由曲线斜率得到不同ox-TMB的浓度C下相应的氧化反应的初始速率V:
(1)
式(1)中:C—不同时刻ox-TMB的浓度;A—652 nm处的吸光度值;εox-TMB—ox-TMB摩尔吸光系数(39 000 M-1·cm-1);L—光在样本中经过的距离(通常为比色皿的厚度),单位cm.
随后用初始速率V和初始体系中底物浓度[S]拟合得到米氏(Michealis-Menten)曲线(2):
(2)
取双倒数作图,得到Linrweaver-Burk曲线(3):
(3)
式(2)、(3)中:[S]—底物浓度(mM);V—不同[S]时的反应速度(10-8M·S-1);Vm—最大反应速率(10-8M·S-1);Km—米氏常数.
如图4(a)、(b)所示,以β-FeOOH纳米棒为类酶催化剂,对两种底物催化所得的米氏曲线.在底物浓度较低时,随底物浓度增加,反应速率呈线性关系增长,当TMB浓度超过0.8 mM,H2O2浓度浓度超过1.6 mM时反应速率的增速逐渐变缓,这与典型米氏方程的变化特性一致.
将米氏方程进行双倒数作图并模拟线性关系,即可得到Linrweaver-Burk直线(图4(c)、(d)),其中Linrweaver-Burk直线图的纵坐标截距为1/Vm,斜率为Km/Vm,通过计算即得到β-FeOOH纳米棒的动力学参数Vm和Km值.

(a)米氏曲线:[V]~[ H2O2]
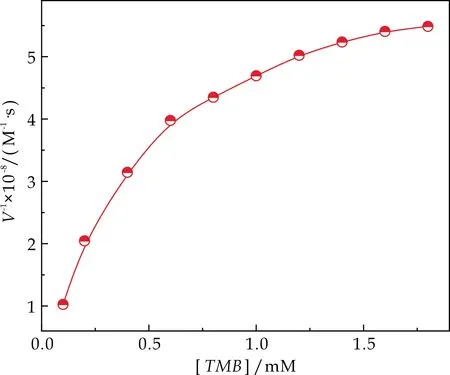
(b)米氏曲线:[V]~[TMB]

(c)Linrweaver-Burk曲线:[V]-1~[H2O2]-1

(d)Linrweaver-Burk曲线:[V]-1~[TMB]-1图4 β-FeOOH酶催化动力学曲线
Km体现了纳米酶与底物的亲和力大小,Km值越小,亲和力越强.如表3所示,β-FeOOH纳米棒与天然过氧化物酶HRP对两种底物的亲和(Km)相当,对底物H2O2而言,Vm(β-FeOOH)>Vm(HRP),这表明β-FeOOH纳米棒与HRP对底物有相似的亲和能力,在相同时间内β-FeOOH纳米棒与底物的反应速率更快,大大缩短了反应进程,使TMB更快被氧化显色,与HRP相比有更高的酶催化活性.
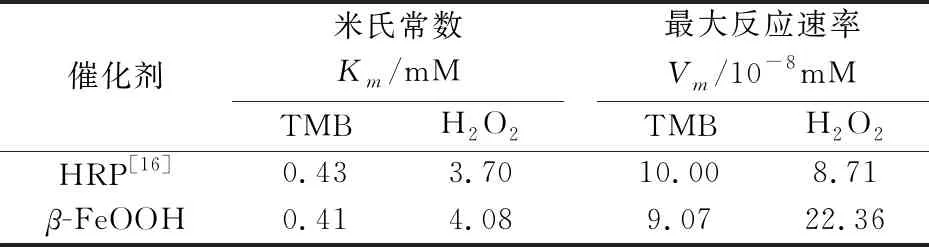
表3 β-FeOOH纳米棒的动力学参数
2.5 类酶催化机理
上述研究发现,β-FeOOH纳米棒具有类似HRP的功能,可以催化H2O2氧化TMB发生显色反应.为了进一步探明β-FeOOH纳米棒催化反应的机理,本文采用分光光度法测定反应过程中的·OH[17].以水杨酸作为·OH的捕获剂,生成二羟基苯甲酸,通过UV-Vis扫描,若在510 nm处可以产生吸收峰,则可证明β-FeOOH纳米棒对H2O2与TMB氧化反应的催化作用,是缘自于β-FeOOH纳米棒催化H2O2分解产生具有强氧化性的·OH,从而完成对TMB的氧化过程[18].
图5为反应5 min时水杨酸捕获·OH后,扫描510 nm处的紫外吸收谱图.由图5可见,当体系中存在水杨酸(a曲线)、水杨酸+ H2O2(b曲线)、水杨酸+1 mgβ-FeOOH(c曲线)时在510 nm处无吸收峰,即没有检测到二羟基苯甲酸生成这表明在,仅有H2O2或β-FeOOH存在时,体系中,没有·OH产生.当体系中存在H2O2和β-FeOOH时(d、e曲线),紫外吸收谱图在510 nm附近显示出二羟基苯甲酸的特征峰,这是因为水杨酸被体系中的·OH氧化产生了二羟基苯甲酸,这证明加入β-FeOOH纳米棒后可以促进H2O2的分解,使体系中产生·OH.当β-FeOOH投入量从1 mg增加到1.5 mg时,产生的·OH相应增多,体系中二羟基苯甲酸含量增加,在510 nm处的吸收峰也随之增强.由此可以看出,β-FeOOH纳米棒的加入可以促使H2O2分解生成H2O和·OH,水杨酸迅速捕获·OH并生成二羟基苯甲酸,在510 nm处显示出特征吸收峰.随β-FeOOH纳米棒投入量的增加,体系中·OH的含量也随之增加.

图5 水杨酸捕获·OH在510 nm处显色 的UV-Vis谱图
TMB与H2O2氧化显色反应,实质上依赖于H2O2产生的·OH来氧化TMB,生成ox-TMB显色.这个过程在室温条件下是非常缓慢的,常常需要加入酶来促进·OH产生,从而加快反应速率.β-FeOOH纳米棒催化的反应过程如图6所示.在酸性条件下,β-FeOOH纳米棒与体系中的H2O2接触,在极短时间内催化H2O2分解产生H2O 和·OH,具有强氧化性的·OH迅速与无色的TMB发反应,将无色溶液氧化为蓝绿色的ox-TMB溶液.通过这种催化作用可以达到类过氧化物酶的催化效果,实现了加快反应速率,缩短TMB氧化显色时间的目的.

图6 β-FeOOH纳米棒的酶催化 机理示意图
3 结论
本文以FeCl3和聚乙烯亚胺为原料,以简单的低温热沉淀法制备了具有类过氧化物酶活性的β-FeOOH纳米棒.同时,对β-FeOOH纳米棒的酶活性和催化原理和进行了研究.通过以TMB作为显色标志物评价β-FeOOH纳米棒的类酶催化效果发现,β-FeOOH纳米棒对TMB和H2O2的Km值与HRP类似为0.41,但最大反应速率Vm更高,为HRP的2.6倍,这表明在相同条件下,β-FeOOH纳米棒催化的反应更快,更早到达反应终点.对β-FeOOH纳米棒的酶催化机理研究发现,β-FeOOH纳米棒是通过催化H2O2分解产生具有强氧化性的·OH,迅速氧化TMB发生显色,加快反应进程,从而达到类过氧化物酶的催化效果.
β-FeOOH纳米棒是具有类过氧化物酶特性的纳米粒子,其良好的分散性和稳定性可以确保在催化过程中与底物的充分接触,保证了催化反应的效率.与HRP相比,β-FeOOH纳米棒与底物亲和力相似,反应速率更高,具有更高的催化活性,且制备简单,成本更低,为纳米酶取代天然酶在工业、医疗、生物等领域的实际应用提供了新思路.
