Pt/ZSM-5水相催化二氧化碳加氢制甲醇
2021-04-20何珍红李竹惠王忠宇郭攀攀李佳策姚曼清王伟涛杨阳刘昭铁
何珍红, 李竹惠, 王忠宇, 郭攀攀, 李佳策, 姚曼清,王 宽, 王伟涛, 杨阳, 刘昭铁,2*
(1.陕西科技大学 化学与化工学院 教育部轻化工助剂化学与技术重点实验室, 陕西 西安 710021; 2.陕西师范大学 化学化工学院, 陕西 西安 710119)
0 引言
能源和环境问题是人类面临的两大主要问题,随着大气中CO2浓度的不断升高,全球气温逐渐变暖,导致灾害性天气不断增加.此外,传统化石能源(如石油、煤、天然气等)的过度消耗使其价格快速上涨的同时还排放大量含氮、硫等有害物质到环境中,造成光化学污染、酸雨等环境事件发生.利用CO2加氢不仅能消耗大气中的CO2,同时还能产生高价值化学品,因而具有非常重要的意义,是CO2资源化的主要方向之一.通过催化转化,可以将CO2转化成如一氧化碳(CO)[1]、甲醇(MeOH)[1,2]、乙醇(EtOH)[3]、甲烷(CH4)、低碳烯烃[4]、长链烷烃[5]等重要化学品.在这些化学品中,甲醇作为重要的清洁燃料和化学品,其高效合成具有非常重要的理论意义和工业应用价值[6,7].
目前,用于CO2加氢制备甲醇反应的催化剂主要包括Cu、Au、Pd等负载型催化剂.例如,在工业上多采用Cu/ZnO/Al2O3催化体系,然而该催化剂需苛刻的反应条件(200 ℃~270 ℃,5~10 MPa)[7],且表现出中等的催化活性以及相对较低的选择性[8].此外还有CuO-ZnO-ZrO2[9,10]、负载型Cu-Zn/石墨烯气凝胶[11]、CuIn@SiO2[12]等催化剂.贵金属催化剂主要以Pd为主,如PdIn双金属纳米催化剂[2]、以非晶态二氧化硅负载的PdCu催化剂[13]、由Pd@ZIF-8为前驱体的PdZn合金催化剂[14]等,此外还有负载Au催化剂[15],ZnO-ZrO2固溶体[16]等其他类型的催化剂.这些催化剂在反应中的实验条件大多采用气相反应,反应条件相对苛刻.目前,在液相反应体系中合成甲醇的研究相对较少[13].水作为溶剂时,不仅有利于甲醇产物的收集,同时水是绿色无害的,不对环境产生危害,因而开发出水相体系中催化CO2加氢制备甲醇具有非常重要的意义.
ZSM-5分子筛具有较短的扩散路径、丰富的孔结构和表面酸碱性位点,是一种理想的催化剂或载体[17].通过调控其Si/Al摩尔比例,可以显著影响载体表面酸碱性能.当其负载其他金属组分时,酸和金属物质不受框架几何形状和酸性特征的限制[18].因此,本文制备了一系列不同硅铝比的Pt贵金属负载ZSM-5分子筛催化剂并用于CO2加氢反应中,研究其制备甲醇的反应活性及其构效关系.
1 实验部分
1.1 试剂与仪器
H2PtCl6(Pt含量>47.5%),陕西开达化工有限责任公司; ZSM-5分子筛,南开大学催化剂厂; CO2(99.99%)和H2(99.99%)均购自西安泰达低温设备有限公司.
高压反应釜(16 mL)和TRC-2恒温调速磁力搅拌器,安徽华蕊实验设备有限公司; GC 9720和GC 9790 Ⅱ 气相色谱仪,浙江福立分析仪器股份有限责任公司; KQ 300DE超声清洗机,昆山超声仪器设备有限公司; RE-52AA旋转蒸发器,上海亚荣生化仪器厂; 电热鼓风干燥箱,上海-恒科学仪器有限公司; KSL-1200X-7.2L马弗炉和OTF-1200X管式炉,合肥科晶材料技术有限公司.
1.2 催化剂制备
Pt/ZSM-5催化剂采用等体积浸渍法制备.以1 wt% Pt/ZSM-5(Si/Al摩尔比为360)为例,其制备方法如下: 称取0.025 g氯铂酸溶于1.5 mL去离子水中形成均匀溶液,然后将该溶液缓慢滴加到1.00 g ZSM-5,超声30 min后常温静置12 h,再经80 ℃干燥过夜后转移至马弗炉中500 ℃焙烧2 h(5 ℃/min),之后再在管式炉中H2气氛下400 ℃焙烧1 h(5 ℃/min),最后用1%O2/N2钝化20 min得到1 wt% Pt/ZSM-5(360)催化剂.
1.3 催化剂表征
对制备的催化剂进行XRD、XPS、N2物理吸附、(HR)TEM以及CO2-TPD表征.利用X射线粉末衍射(XRD)对催化剂体相结构进行分析,所用仪器为德国布鲁克D8 Advance原位X-射线衍射仪,Cu靶Kα辐射,步长5 °/min,2θ扫描角度为5 °~ 60 °; 比表面积(BET)和孔径分析使用ASAP 2460(美国Micromeritics公司); 催化剂表面Pt价态信息采用X光电子能谱(XPS)测试,所用仪器为 AXIS SUPRA(英国KRATOS公司); 样品的形貌特征采用透射电子显微镜(TEM)测试,仪器为 JEM-2100(日本JEOL公司).
CO2程序升温脱附(CO2-TPD)在美国Micromeritics公司Autochem II 2920上进行.测试前,将样品置于U型石英管中并在50 mL/min的氦气气流下以10 ℃/min的升温速率加热至300 ℃处理1 h以除去催化剂表面吸附的水.然后降温至50 ℃,切换为10% CO2/He混合气吹扫60 min,待吸附饱和后,用He气以50 mL/min的流速吹扫催化剂60 min.最后,以10 ℃/min升温速率加热到600 ℃脱附被吸附的CO2,并用TCD检测器检测脱附的气体.
1.4 催化剂活性评价
水相CO2加氢反应在带有聚四氟乙烯内衬(16 mL)的高压反应釜内进行.将50 mg催化剂和1.0 mL脱氧水置于聚四氟内衬中,并密封于高压反应釜内,充入适量的CO2和H2气体.将反应釜升温至目标温度后连续反应12 h.反应结束后,待高压反应釜冷却至室温,对反应液体和反应气体分别采用FL 9720型气相色谱仪和FL 9790 II型气相色谱仪检测产物组成.采用1,4-二氧六环为内标计算液相产物收率,催化剂活性以产物的时空收率(STY)表示,STY和选择性(Sele.)计算公式分别如式(1)和式(2)所示:
(1)
(2)
2 结果与讨论
2.1 催化剂表征
图1为不同Si/Al比的1 wt%Pt/ZSM-5催化剂的XRD图谱.从图1可以看出,所有催化剂均具有典型的MFI沸石结构,表明Si/Al比对ZSM-5的结构并没有明显影响,且负载Pt没有破坏分子筛的骨架结构.催化剂在2θ为39.7 °均检测到了Pt(111)晶面的衍射峰,表明Pt成功负载到ZSM-5载体上[19,20].

图1 不同Si/Al比的1 wt%Pt/ZSM-5 催化剂的X-射线粉末衍射图谱
N2物理吸附测试用来表征催化剂的比表面积和孔结构,其等温吸附曲线及结果如图2和表1所示.从图2可以看出,所测材料均具有丰富的微孔和介孔结构.从表1可以看出,除了Si/Al比为5 000的1 wt%Pt/ZSM-5(5 000)外,Si/Al比为50和360的催化剂均有相似的比表面积(约500 m2/g)和孔结构特征(孔体积约0.30 cm3/g,孔径约4 nm),表明ZSM-5催化剂Si/Al比较低时,其比表面积和孔道结构特征不受Si/Al比的影响.

图2 不同Si/Al比的1 wt% Pt/ZSM-5 催化剂的N2吸附-脱附等温线

表1 催化剂比表面积和孔结构特征
图3为催化剂1 wt%Pt/ZSM-5(360)的(HR)TEM图谱。从图3中可以看出,催化剂呈块状颗粒,负载的金属Pt纳米粒子清晰可见且粒径大小相当,平均粒径约为4.9 nm.另外,图3(c)晶格条纹的晶格间距为0.66 nm,属于ZSM-5晶格条纹;
图3(f)中Pt纳米颗粒的晶格间距为0.23 nm,可归属于Pt(111)晶面[21].


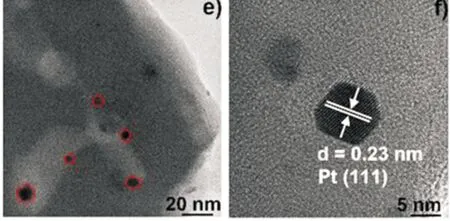
(a)、(b)、(d)、(e)为催化剂1 wt%Pt/ZSM-5(360)的TEM图 (c)、(f) 分别为ZSM-5 载体和Pt纳米粒子的HRTEM图图3 催化剂的TEM和HRTEM图
图4为1 wt%Pt/ZSM-5(360)催化剂的Pt元素XPS谱图.在72.3 eV和76.2 eV处可见两个峰,可归属为Pt04f7/2和Pt04f5/2[22],表明催化剂经过还原后,Pt物种变成了Pt0.
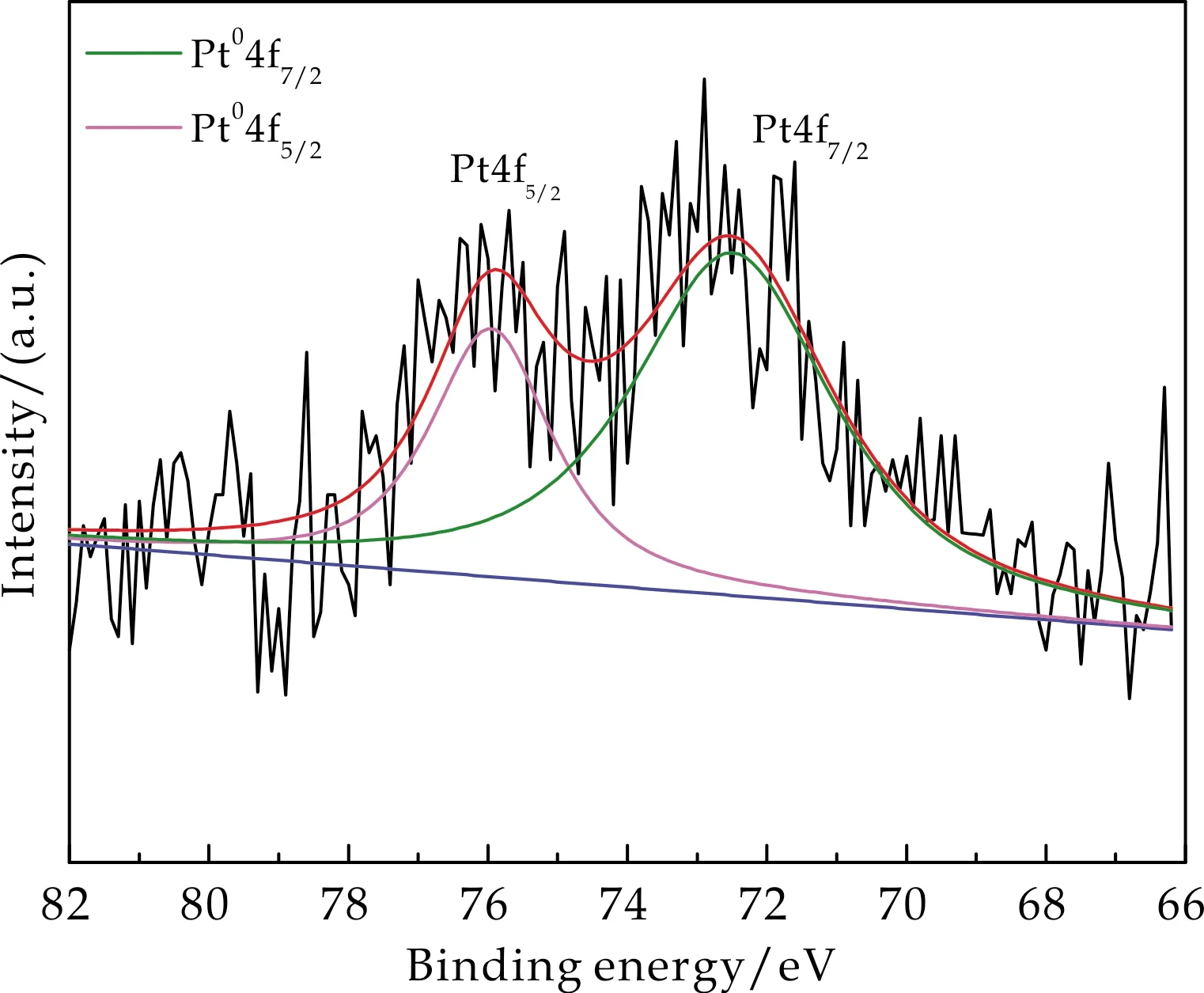
图4 1 wt% Pt/ZSM-5(360)催化剂中 Pt的XPS图谱
图5为不同Si/Al比的1 wt% Pt/ZSM-5催化剂的CO2-TPD吸附曲线.由图5可知,催化剂对CO2吸附性能与ZSM-5载体的Si/Al摩尔比密切相关,随着ZSM-5载体的Si/Al摩尔比升高,CO2脱附曲线峰面积逐渐变小.当Si/Al摩尔比为50时,催化剂中Al含量相对较高,催化剂在100 ℃和350 ℃具有两个明显的CO2脱附峰,且CO2脱附面积远远大于其他较高Si/Al摩尔比的催化剂,表明Si/Al比为50时,ZSM-5表面具有丰富的碱位点使得催化剂对CO2的吸附大大增加.然而过强的CO2吸附性能可能导致催化剂对H2的吸附性能降低,导致催化活性降低.同样,对于Pt/ZSM-5(5000)催化剂而言,其CO2吸附能力太弱,导致催化活性较低.因此,适当的CO2吸附能力对CO2加氢制备甲醇具有非常重要的影响,Pt/ZSM-5(360)具有适中的CO2吸附能力,因此表现出较高的催化性能.
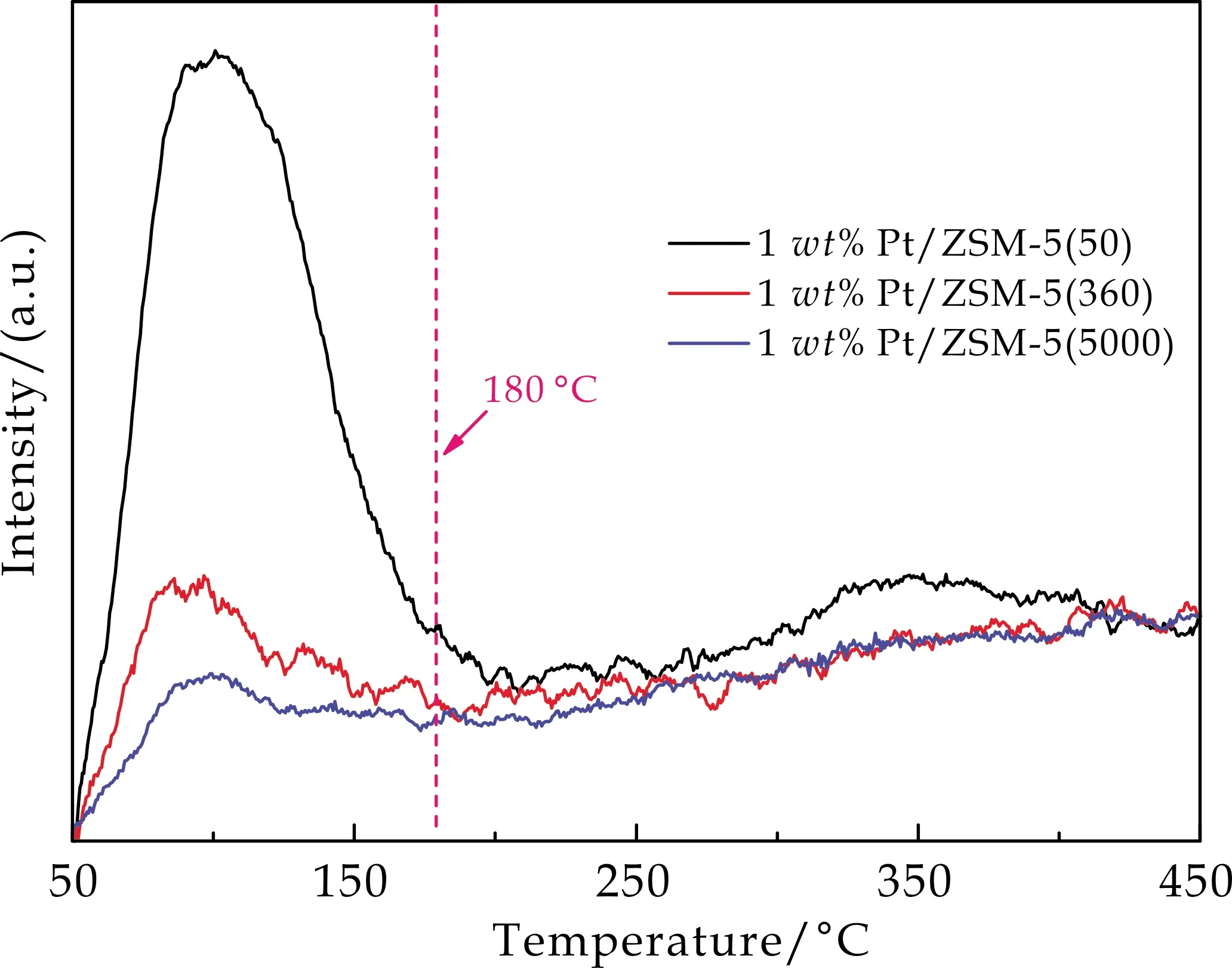
图5 不同Si/Al比的1 wt%Pt/ZSM-5 催化剂的CO2-TPD吸附曲线
2.2 催化剂活性评价
图6为不同Si/Al摩尔比的1wt%Pt/ZSM-5在CO2加氢制备甲醇反应中的活性评价结果.由图6可知,ZSM-5载体Si/Al摩尔比对催化活性影响显著.MeOH的时空收率随着Si/Al摩尔比的增大呈先增后减的趋势,例如1 wt%Pt/ZSM-5(50)催化剂的甲醇收率不足0.05 mmol·mmolPt-1·h-1,这可能是因为Si/Al摩尔比为50时,催化剂表面丰富的碱位点和CO2之间产生较强的相互作用阻碍了H2的吸附与活化.当Si/Al摩尔比为360时,催化活性最高,而当Si/Al摩尔比为5 000时,活性降低,表明适量的碱位点有助于反应的进行,使得MeOH的时空收率增加.
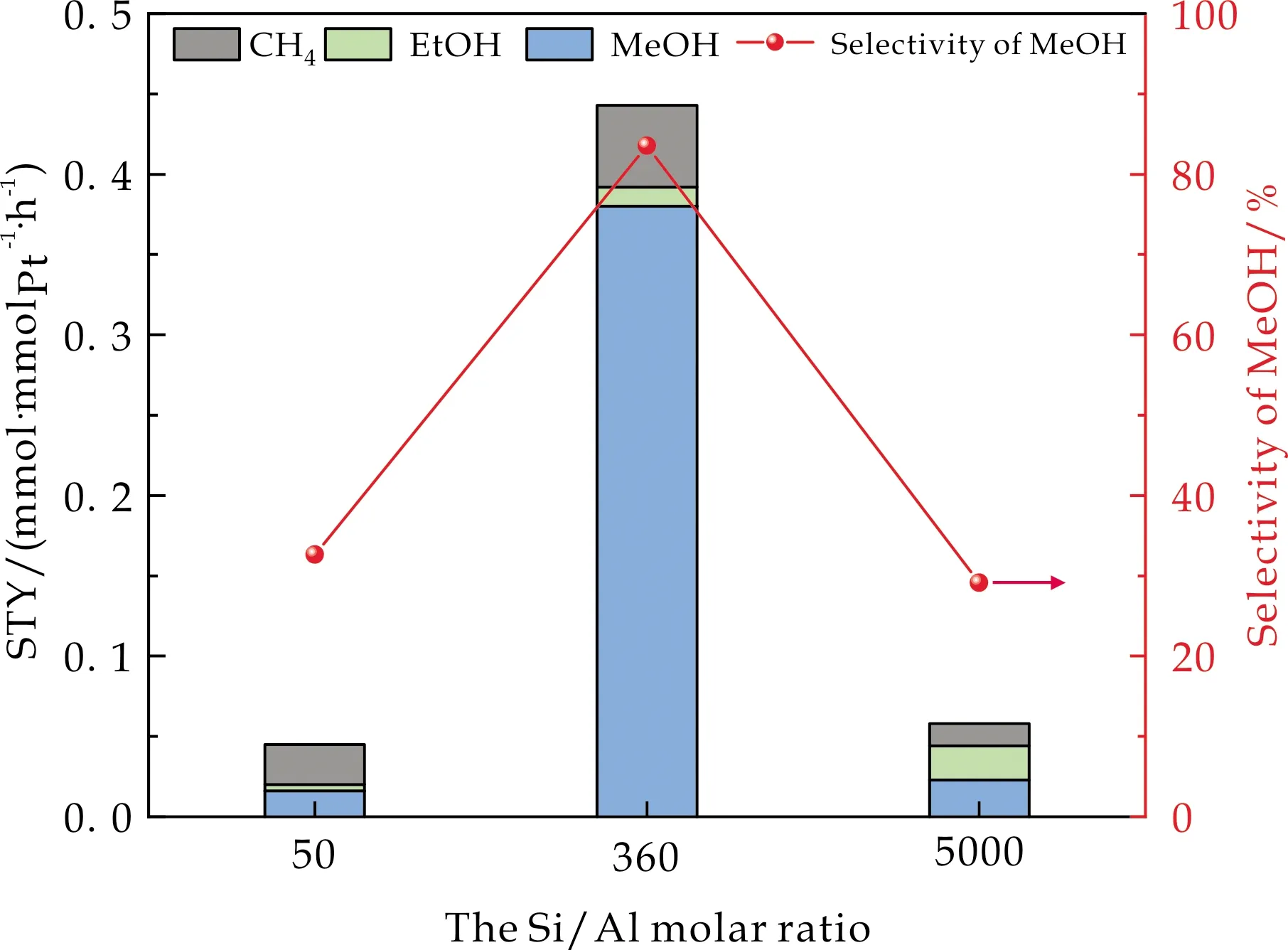
图6 不同Si/Al比对1 wt%Pt/ZSM-5催化CO2加氢催化性能的影响(反应条件:mcat 50 mg,H2O 1 mL,180 ℃,CO2 2 MPa,H2 6 MPa,12 h)
图7为温度对1 wt%Pt/ZSM-5(360)催化CO2加氢反应制甲醇催化性能的影响.由图7可知,随着反应温度的升高,MeOH的时空收率也增加,在180 ℃下达到最大值0.38 mmol·mmolPt-1·h-1.催化剂对MeOH的选择性随着温度的升高先增大后减小,在160 ℃时达到最大值91%.在180 ℃时由于副产物CH4的收率的大幅增加,导致MeOH选择性下降至最低点83%.虽然180 ℃时MeOH的选择性较低,但在该温度下MeOH时空收率最高,且主要的副产物CH4与MeOH容易分离,因此选择180 ℃为最优反应温度.

图7 温度对1 wt%Pt/ZSM-5(360)催化CO2加氢反应催化性能的影响(反应条件:H2O 1 mL,mcat 50 mg,12 h,CO2 2 MPa,H2 6 MPa)
图8为1 wt%Pt/ZSM-5(360)催化剂在不同时间下催化CO2加氢制甲醇的催化活性结果.由图8可知,随着反应时间的延长,产物的总时空收率缓慢增加.其中,MeOH的时空收率先增加后减小,在反应时间为12 h时达到MeOH最大时空收率0.38 mmol·mmolPt-1·h-1.进一步延长反应时间至15 h,MeOH的时空收率急剧下降,而CH4大幅度增加.表明适当的增加反应时间有助于获得较高的甲醇产品,但是反应时间过长则使得副产物CH4迅速增加,因此选择12 h为最优反应时间.

图8 反应时间对1 wt%Pt/ZSM-5(360)催化CO2加氢催化性能的影响(反应条件:mcat 50 mg,H2O 1 mL,180 ℃,CO2 2 MPa,H2 6 MPa)
图9为1 wt%Pt/ZSM-5(360)催化剂在不同CO2/H2分压比下催化CO2加氢反应制甲醇的催化活性结果.由图9可知,随着CO2分压增大,总产物时空收率、MeOH时空收率以及选择性呈现先增加后减小的趋势,在CO2分压为2时产物的总时空收率、MeOH的时空收率和MeOH的选择性达到0.44 mmol·mmolPt-1·h-1、0.38 mmol·mmolPt-1·h-1和83%.近一步增大CO2分压,催化剂的催化活性降低.因此,选择CO2/H2分压比为2/6作为最优的CO2/H2分压比.

图9 不同CO2/H2分压比对1 wt%Pt/ZSM-5(360)催化剂催化CO2加氢反应的催化活性影响(反应条件:mcat 50 mg,H2O 1 mL,180 ℃,12 h,总压8 MPa)
3 结论
通过等体积浸渍法制备了不同硅铝比的Pt/ZSM-5催化剂,并借助表征手段和性能评价系统研究了催化剂的理化性质和构效关系.探明了催化剂Pt/ZSM-5的表面碱性位点对CO2加氢反应的影响.结果表明,随着Si/Al比的增加,催化剂对MeOH的时空收率呈现先增加后减小的趋势.适中的Si/Al比催化剂如Pt/ZSM-5(360)具有适中的CO2吸附能力,使得其表现出最佳的催化活性,在反应温度为180 ℃,反应时间为12 h,CO2和H2压力分别为2 MPa和6 MPa时,1 wt%Pt/ZSM-5(360)的催化活性最高,表明适量的碱位点有助于反应的进行,得到MeOH的时空收率为0.38 mmol·mmolPt-1·h-1.
