奶源乳酸菌发酵液对沙门氏菌抑制作用的研究
2021-04-20皇甫和平
张 华,刘 媛,皇甫和平
(1.河南牧业经济学院 食品与生物工程学院,河南 郑州 450046;2.郑州大学 物理学院(微电子学院),河南 郑州 450052)
乳酸菌是一类能利用可发酵碳水化合物产生大量乳酸的细菌的统称,包括肠球菌属、乳酸菌属、乳球菌属、亮串珠菌属、片球菌属和链球菌属等,这类细菌在自然界中的分布极为广泛[1]。乳酸菌天然存在于某些食品中,参与食品的发酵过程,乳酸菌发酵的生化反应涉及一系列酶的反应,发酵过程中发生的变化包括pH值的降低以及代谢产物如乳酸、乙酸、过氧化氢和肽的产生[2]。食品经乳酸菌发酵有诸多好处:首先,乳酸菌发酵可以提高食品的消化率;其次,发酵的次生代谢产物可以抑制病原微生物的生长,提高食品的安全性;再次,食用乳酸菌发酵的食品有助于维持肠道的微生物菌群,防止因肠道菌群失调引起的疾病。由于乳酸菌的这些功效,一些乳酸菌被认为是益生菌[3]。
沙门氏菌是一种常见的食源性致病菌,现已发现近一千种(或菌株),广泛分布于自然界中。沙门氏菌对禽类、生猪及其鲜肉制品的感染率很高,蛋类、畜禽类肉制品是人类感染沙门氏菌的主要渠道[4]。头孢曲松钠、头孢他啶等抗生素可以有效地抑制沙门氏菌的繁殖,但滥用会导致细菌耐药性和动物体内抗生素残留等问题[5]。益生菌作为抗生素的替代品已被确定为预防畜禽沙门氏菌感染的策略之一。
本研究以发酵酸奶中的乳酸菌为菌源,筛选对沙门氏菌有较强抑制作用的菌株并分析其抑菌原理,以期为利用乳酸菌预防畜禽沙门氏菌的感染提供理论依据。
1 材料与方法
1.1 菌源
乳酸菌分离自青海省传统发酵酸奶,经16S rDNA测序鉴定,用R1-R20表示。沙门氏菌由河南牧业经济学院动物医药学院皇甫和平博士赠送,分别用S1-S8来表示。菌源保存于河南牧业经济学院动物医药学院实验室。
1.2 培养基与试剂
MRS培养基、MRS肉汤、NA培养基、氢氧化钠、盐酸、过氧化氢等均为国产分析纯试剂。胃蛋白酶(1∶100000)、胰蛋白酶(1∶250)、过氧化氢酶均购自Amersco公司。
1.3 仪器与设备
pH计(LC-7H,上海精密科学仪器有限公司雷磁仪器厂)。紫外可见分光光度计(CAAM-1043,苏州优谱通用科学仪器有限公司)。恒温培养箱(SDRH-700F,天津胜卫电子科技有限公司)。分析天平(FR2333CN,上海奥豪斯有限公司)。电子游标卡尺(ADS-X023-05000,安迪斯测控技术有限公司)。高速冷冻离心机(DJSJGI-OLP-26,爱而斯特生命科学有限公司)。抽滤装置(R300-B,上海令德仪器有限公司)。高效液相色谱仪(Agilent 1280,PERKIN ELMER)。
1.4 乳酸菌发酵上清液的制备
挑取MRS固体平板上形态饱满的菌落3~5个,用接种环置于 50 mL MRS肉汤培养基中,37 ℃厌氧培养12 h,用移液枪移取100 μL接种于10 mL MRS肉汤培养基中,37 ℃厌氧培养24 h,4 ℃ 6000 g 离心10 min,取上清液,用于后续牛津杯试验。
1.5 沙门氏菌培养液的制备
将沙门氏菌进行菌种活化,用1 mL无菌生理盐水溶解菌种,用移液枪移取100 μL涂布于NA 固体培养基上,37 ℃有氧培养24 h,挑取单个菌落连续培养 2~3 代,用于后续牛津杯试验。
1.6 牛津杯法抑菌试验
乳酸菌菌株的初步筛选采用牛津杯法[6]。将20 mL营养琼脂培养基倒入平板中,让其凝固。将沙门氏菌(过夜预培养,600 nm处光密度为1)注射到5 mL NA琼脂中,冷却至50 ℃,接种率为3%。待培养基凝固后,将4个灭菌后的牛津杯轻轻压在NA琼脂表面,每个牛津杯中加入250 μL乳酸菌发酵离心上清液(已培养了24 h),37 ℃孵育24 h,测定抑菌圈的直径。每个试验重复三次。
1.7 酸抑制排除试验
用1 mol/L NaOH将乳酸菌发酵离心上清液的pH值调整为4、5、5.5、6。用牛津杯法做抑菌试验,37 ℃孵育24 h后测定抑菌圈的直径。每个试验重复三次。
1.8 蛋白酶和过氧化氢酶对乳酸菌抗菌活性的影响
将胃蛋白酶溶解在pH2.0的磷酸缓冲液中,将胰蛋白酶溶解在pH7.0的磷酸缓冲液中。取2份等量的乳酸菌发酵上清液,将pH分别调为2.0(胃蛋白酶最适pH)、7.0(胰蛋白酶最适pH),按照最终浓度1.0 mg/mL加入胃蛋白酶溶液或胰蛋白酶溶液,37 ℃温浴2 h后取出,沸水煮沸5 min使酶灭活,pH值调整为6.0。以未经酶处理的乳酸菌发酵上清液作对照。用牛津杯法做抑菌试验,37 ℃培养24 h后测定抑菌圈的直径。
过氧化氢酶溶解在50 mmol/L磷酸缓冲液(pH7.0)中,然后按照最终浓度1 mg/mL加入到乳酸菌发酵上清液中,37 ℃温浴2 h后取出,沸水煮沸5 min使酶灭活,pH值调为6.0。以未经过氧化氢酶处理的乳酸菌发酵离心上清液作对照。用牛津杯法做抑菌试验,37 ℃培养24 h后测定抑菌圈的直径[7]。
1.9 产酸能力曲线
筛选出抑菌效果较好的乳酸菌菌株,每10 mL MRS肉汤培养基接种40 μL菌液(1×109CFU/mL),37 ℃静止培养14~16 h。将处在对数生长期的菌液按照1%的接种量接种于500 mL MRS肉汤培养基中,37 ℃厌氧培养48 h,每隔2 h取样。利用pH计测定乳酸菌发酵上清液的pH值,利用高效液相色谱仪分析乳酸菌发酵上清液中有机酸的种类和质量浓度[8]。
2 结果
2.1 乳酸菌发酵上清液的抑菌效果
20株乳酸菌发酵上清液对沙门氏菌的抑制效果如表1所示。不同乳酸菌对同种沙门氏菌的抑菌效果有差异,同种乳酸菌对不同沙门氏菌的抑菌效果也有差异。14株乳酸菌发酵上清液对沙门氏菌表现出较好的抑菌活性,其中,R4、R7、R10、R11这4株乳酸菌发酵上清液的抑菌活性较强,有些抑菌圈直径在20 mm以上,选取这4株乳酸菌进行后续试验。
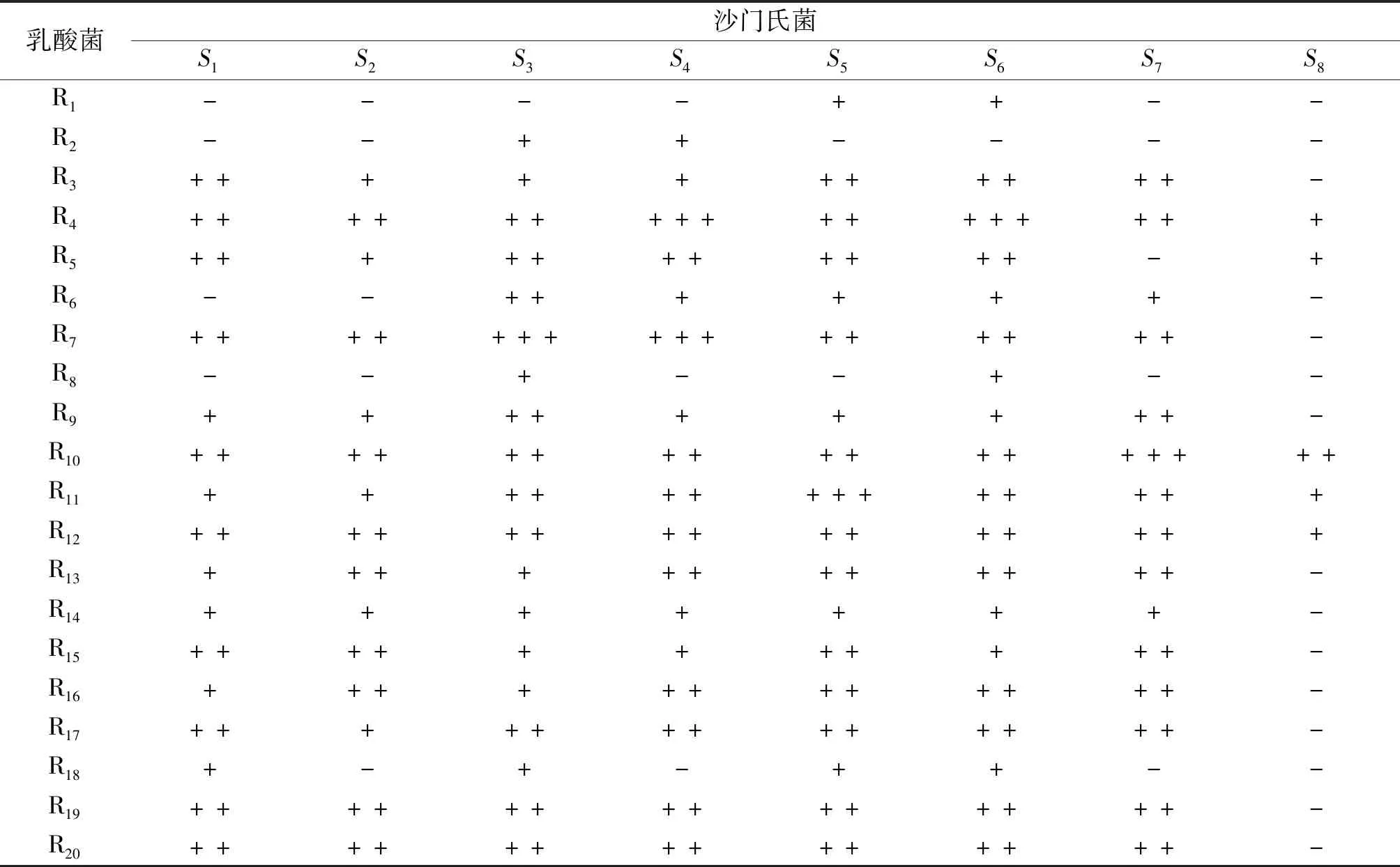
表1 乳酸菌发酵上清液对沙门氏菌的抑菌结果
2.2 乳酸菌发酵上清液pH值对抗菌活性的影响
乳酸菌发酵上清液pH值对抗菌活性的影响如表2所示。在pH=4时,4株乳酸菌发酵上清液对沙门氏菌表现出较好的抑菌活性。与pH=4时相比,pH=5时R4对S6、R7对S3和S4、R10对S7、R11对S5的抗菌活性降低。在pH=5.5或6时,未检测到乳酸菌发酵上清液对沙门氏菌的抗菌活性,说明此时乳酸菌发酵上清液对沙门氏菌的抗菌活性丧失。
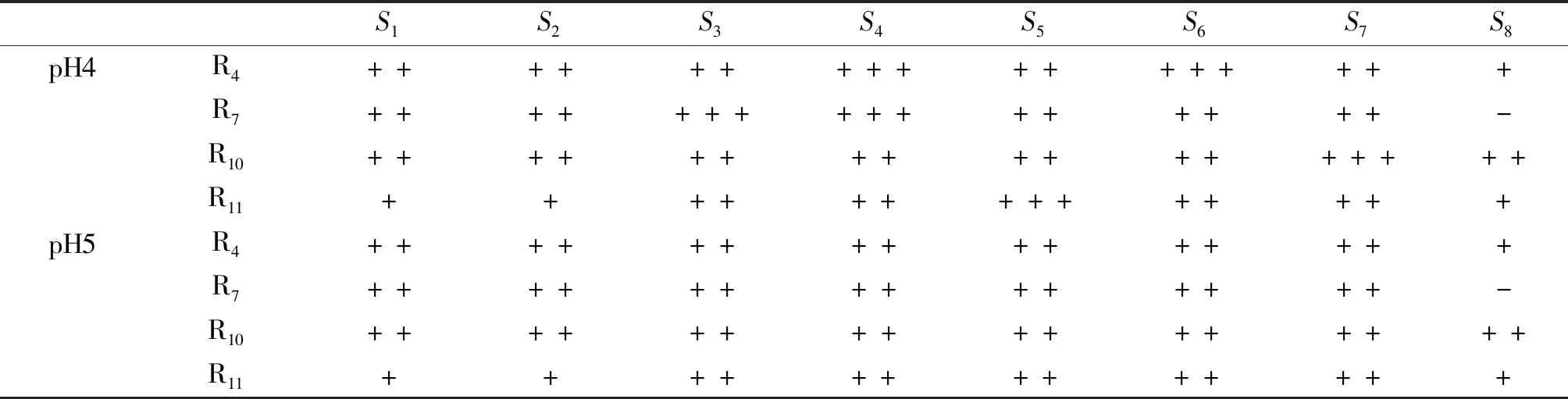
表2 乳酸菌发酵上清液的pH值对乳酸菌抗菌活性的影响
2.3 蛋白酶和过氧化氢酶处理对乳酸菌发酵上清液抗菌活性的影响
胃蛋白酶和胰蛋白酶处理后的乳酸菌发酵上清液无抗菌作用。乳酸菌在代谢过程中可能产生过氧化氢,从而抑制病原菌的生长,用过氧化氢酶处理乳酸菌发酵上清液以探明过氧化氢对乳酸菌发酵上清液抗菌活性的影响。经过氧化氢酶处理后,所有乳酸菌发酵上清液的抗菌活性均未丧失(数据未显示)。
2.4 产酸能力
4株乳酸菌产酸能力及乳酸菌发酵上清液pH的动态变化如图1所示。MRS肉汤初始pH为5.85。在48 h的发酵过程中,0~8 h乳酸菌生长缓慢,乳酸和乙酸产生速率无明显变化,但pH开始下降;8~16 h乳酸菌生长加速,乳酸和乙酸产生速率增大,pH急剧下降;16~24 h乳酸菌处于对数生长期,斜率最大,产乳酸、乙酸能力强,pH缓慢下降;24 h后乳酸菌进入稳定生长期,产酸能力稳定,随着发酵时间的延长,pH基本保持稳定。
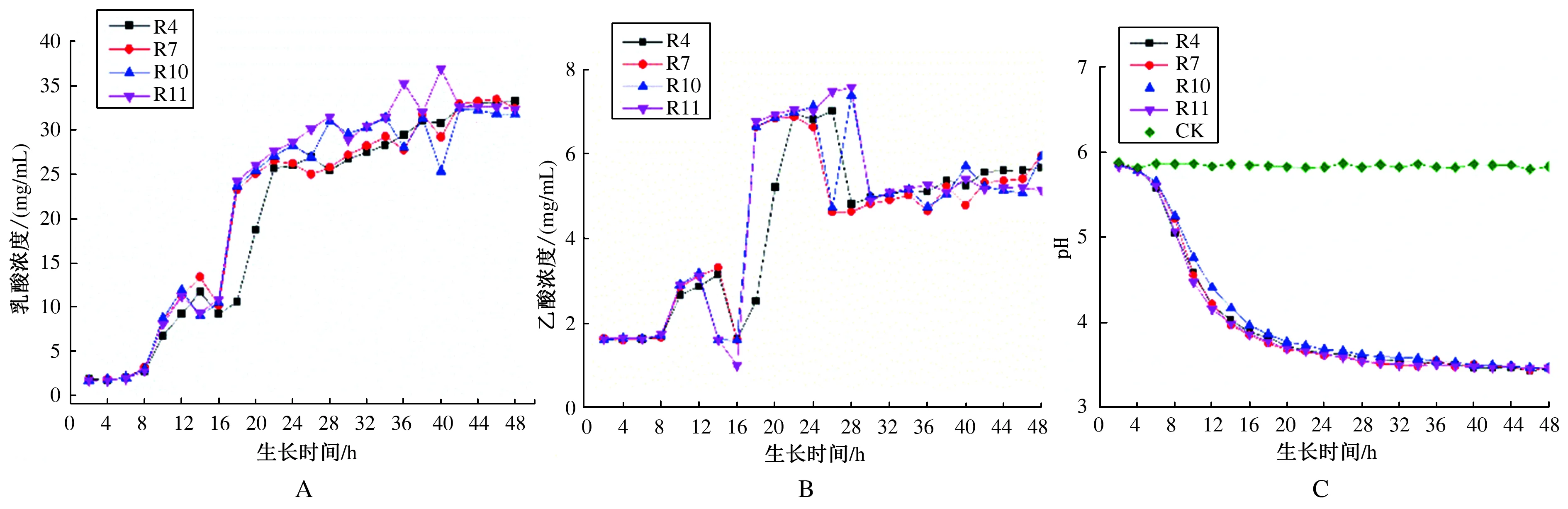
图1 菌株产酸能力
3 讨论
沙门氏菌是常见的条件性致病菌之一,其血清型众多,对人和动物有致病性,还会污染畜禽产品[9,10]。沙门氏菌毒性因子包括鞭毛蛋白、毒力岛、生物膜等[11]。在细胞外壁包被着一个重要的脂质多糖复合物-脂多糖(Lipopoly-saccharide,LPS),LPS在沙门氏菌感染发病机制中起着重要的作用[12,13],LPS层形成一个紧密的屏障,能够阻挡包括抗生素在内的许多化合物[14,15],给沙门氏菌病的防控带来困难。
本试验中,4株乳酸菌发酵上清液对8株沙门氏菌均表现出较强的抑菌活性。经过氧化氢酶处理后,4株乳酸菌发酵上清液的抗菌活性未丧失,证实乳酸菌的抗菌活性与过氧化氢的产生无关。蛋白酶处理后的乳酸菌发酵上清液无抗菌作用,说明胃蛋白酶和胰蛋白酶水解了抗菌物质。
在pH=4时,4株乳酸菌发酵上清液对沙门氏菌表现出较强的抑菌活性;将4株乳酸菌发酵上清液的pH值调整到5时,其对沙门氏菌的抑菌活性降低;将4株乳酸菌发酵上清液的pH值调整到5.5或6时,其对沙门氏菌的抑制作用丧失。上述结果说明,有机酸具有抑菌作用,或源自乳酸菌的抑菌物质在酸性条件下才能发挥作用。产酸能力试验发现乳酸菌发酵液中含有乳酸、乙酸。前期研究表明,乳酸菌发酵液中含有乳酸、乙酸或苯乳酸等有机酸及短链脂肪酸[16]。
总之,奶源乳酸菌的抑菌作用与发酵上清液中的酸性物质有关。乳酸菌的抑菌作用可能涉及多种机制的协同,例如有文献表明细菌素在酸性条件下才具有抗菌活性[17],因此对协同机制还需要进一步探索。
