cpxR基因缺失对鼠伤寒沙门菌生物被膜形成能力的影响
2021-04-20樊国燕彭志锋王晓琳裴亚玲胡功政
黄 慧,樊国燕,彭志锋,娄 飞,王晓琳,裴亚玲,胡功政
(1.河南牧业经济学院 动物医药学院 河南 郑州 450046; 2.河南农业大学 动物医学院 河南 郑州 450046)
细菌生物被膜(biofilm,BF)的形成是细菌对抗菌药物耐药以及造成临床不同程度慢性或持续性细菌感染的关键因素[1]。沙门菌是引起人类食源性疾病的主要病原菌,生物被膜的形成与沙门菌病的爆发和患者的持续感染密切相关[2-4]。因此,抑制或减弱其生物被膜的形成,能有效降低其致病性,可成为临床防治沙门菌病的重要手段。
生物被膜的形成和消解过程存在复杂的调控网络,有报道称多种双组分信号转导系统(two-compontent signal transduction system,TCS),如OmpR/EnvZ、RcsBCD、PvrRS、PprAB、CpxAR等,参与调控生物被膜的形成[5],但其具体调控机制还未被完全阐明。CpxAR系统是革兰阴性菌中普遍存在的一种TCS,主要参与细菌膜压力变化的调控,由感应子激酶CpxA和应答调节子cpxR组成,cpxR作为转录调控因子,调控靶基因表达、帮助细菌应对环境变化[6]。CpxAR系统被证实对大肠杆菌和胸膜肺炎放线杆菌等细菌生物被膜的形成具有重要调控作用[7-9],而其在沙门菌生物被膜形成过程中发挥怎样的作用,目前还未被阐明。研究旨在通过用结晶紫染色法测定鼠伤寒沙门菌标准菌株和临床分离菌株在cpxR基因缺失前后生物被膜形成量的变化,以分析cpxR基因对鼠伤寒沙门菌生物被膜形成能力的影响,能为进一步研究CpxAR系统对沙门菌生物被膜形成的调控机制以及阐明沙门菌生物被膜形成过程中的调控网络奠定基础,能为临床防治沙门菌病提供新的思路。
1 材料与方法
1.1 材料
1.1.1 菌株来源
鼠伤寒沙门菌标准株CVCC541(以下简写为JS)为河南农业大学兽医药理学实验室赠送;6株临床分离菌(编号分别为SH1、SH2、SH3、SH4、SH5、SH7)经鉴定为鼠伤寒沙门菌;以上各菌株的cpxR基因缺失菌株(分别命名为JSΔcpxR、SH1ΔcpxR、SH2ΔcpxR、SH3ΔcpxR、SH4ΔcpxR、SH5ΔcpxR、SH7ΔcpxR),为前期研究中通过Red同源重组技术和噬菌体转导技术制备所得[10]。
1.1.2 培养基
LB肉汤、SS琼脂培养基、TSA培养基、TSB培养基为北京奥博星生物技术有限责任公司产品。
1.1.3 主要试剂
2×Taq PCR Mastermix,购自TAKARA公司;DNA分子量标准(100~2000 bp),购自Sangon Biotech公司;琼脂糖购自TIANGEN公司;丙三醇、冰乙酸为天津市永大化学试剂有限公司产品;结晶紫、草酸铵为天津市瑞金特化学品有限公司产品。
1.2 方法
1.2.1 菌株的复苏
取甘油菌种,按1∶100比例无菌接种于LB肉汤中,37 ℃震荡培养16 h,用接种环无菌挑取一环菌液,划线接种于SS琼脂平板上,37 ℃温箱倒置培养12 h,然后钓取1-2个典型菌落接种于LB肉汤,37 ℃震荡培养12 h备用。
1.2.2 菌株cpxR基因的鉴定
(1)引物合成
引物序列参考前期研究中的cpxR基因扩增引物Cr-F/Cr-R[11],委托华大基因公司合成,引物序列具体信息如表1。
(2)PCR扩增
取1.2.1中复苏培养的细菌培养物,煮沸10 min,12000 r/min 离心3 min,取上清液。利用前期研究中设计的cpxR基因扩增引物Cr-F/Cr-R,以煮沸离心得到的上清液为模板,对研究中选取的cpxR基因缺失株进行PCR鉴定,确证所选取菌株cpxR基因的存在或失活。PCR扩增体系(25 μL):DNA模板1 μL,DNA聚合酶(2×Taq PCR Mastermix)12.5 μL,上游引物Cr-F(10 μmol/L)1 μL,下游引物Cr-R(10 μmol/L)1 μL,灭菌纯化水9.5 μL。PCR扩增条件:94 ℃预变性5 min;94 ℃变性30 s,55 ℃退火30 s,72℃延伸1.5 min,30个循环;72 ℃后延伸10 min。PCR产物经1%的琼脂糖凝胶电泳后鉴定。

表1 cpxR基因鉴定引物
1.2.3 生物被膜形成能力测定
(1)1%草酸铵结晶紫染液的配制
取结晶紫2 g、 95%乙醇20 mL混合制成溶液A(结晶紫乙醇饱和液20 mL),再取草酸铵0.8 g、蒸馏水80 mL混合制成溶液B(1%草酸铵水溶液80 mL),然后将溶液A与溶液B混合,用滤纸过滤即得。
(2)96孔微量板定量检测生物被膜
将1.2.2中鉴定后的菌株转TSA平板37 ℃过夜培养,次日挑取单个菌落于TSB培养液中过夜培养,以麦氏比浊法将菌液稀释至约麦氏比浊度后,用TSB肉汤将菌液稀释至1.0×107CFU/mL,然后以每孔100 μL加到灭菌的96孔微量培养板,置于37 ℃恒温箱中孵育24 h,每组设5个重复孔,同时设置空白培养液组,作为阴性对照。次日,小心吸取培养液,用蒸馏水轻柔冲洗两次,置通风阴凉处倒置风干固定。然后用每孔120 μL的1%的结晶紫溶液染色15-20 min后,以流水冲洗至空白染色孔未见明显颜色,再置通风处。风干后向每孔加入150 μL的33%的冰醋酸溶液,充分溶解染色液10 min。而后放置酶标仪中,读取波长为570 nm处的OD值。
1.2.4 数据处理与分析
以ODc值(ODc等于空白孔的平均OD值加上其3倍标准差而得到的OD值)为界限值,将菌株分为:不成膜株(OD≤ODc)(-);弱成膜能力株(ODc
采用t检验的方法,对cpxR基因缺失前后测得菌株OD570值进行统计学分析,根据p值判断cpxR基因缺失前后菌株生物被膜形成量的差异。
2 结果与分析
2.1 菌株cpxR基因的鉴定
将菌株进行cpxR基因的PCR扩增后,电泳结果如图1。结果显示,所有亲本菌(JS、SH1、SH2、SH3、SH4、SH5、SH7)PCR扩增后均得到分子量为854 bp的条带,而cpxR基因缺失株(JSΔcpxR、SH1ΔcpxR、SH2ΔcpxR、SH3ΔcpxR、SH4ΔcpxR、SH5ΔcpxR、SH7ΔcpxR)扩增后均得到分子量为1 632 bp的条带,原因是cpxR基因缺失株是抗性基因替换掉cpxR基因所得。此结果与预期一致,说明所选菌株为亲本菌和cpxR基因缺失菌。
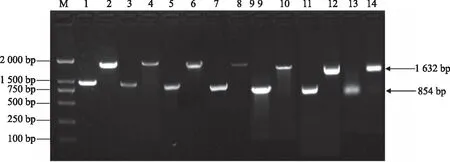
M:DNA Marker 2000;1、3、5、7、9、11、13分别为亲本菌JS、SH1、SH2、SH3、SH4、SH5、SH7;2、4、6、8、10、12、14分别为cpxR基因缺失株JSΔcpxR、SH1ΔcpxR、SH2ΔcpxR、SH3ΔcpxR、SH4ΔcpxR、SH5ΔcpxR、SH7ΔcpxR
2.2 菌株生物被膜形成能力测定结果
根据空白对照孔的平均OD值,计算得到ODc、2ODc和4ODc值分别为0.0600、0.1314和0.2628。将各菌株OD值与ODc、2ODc和4ODc值比较判定出各菌株的生物被膜形成能力(表2)。结果发现,标准菌株JS为中等成膜能力株,在cpxR缺失后(JSΔcpxR)成为弱成膜能力株;6株临床分离的鼠伤寒沙门菌中,SH2、SH4、SH5、SH7为强成膜能力菌株,cpxR基因缺失后,SH2ΔcpxR和SH4ΔcpxR为中等成膜能力菌株,SH7ΔcpxR成为弱成膜能力菌株,SH5ΔcpxR仍为强成膜能力菌株;SH1为中等成膜能力菌株,cpxR基因缺失后(SH1ΔcpxR)成为弱成膜能力菌株;SH3为弱成膜能力菌株,cpxR基因缺失后(SH3ΔcpxR)仍为弱成膜能力菌株。

表2 各菌株生物被膜形成能力测定结果
通过对cpxR基因缺失前后菌株生物被膜形成量进行统计学分析(图2),发现7株鼠伤寒沙门菌在cpxR基因缺失后生物被膜形成量均有所降低,其中有2株(SH3和SH7)在cpxR缺失后生物被膜形成量降低极显著(p<0.01),3株(JS、SH2和SH4)在cpxR缺失后生物被膜形成量降低显著(p<0.05)。结果表明,cpxR基因缺失可使鼠伤寒沙门菌生物被膜形成能力明显降低。

图2 各菌株在cpxR缺失前后生物被膜形成量的差异性分析
3 结论与讨论
沙门菌在自然环境中多数是以生物被膜形态存在的,生物被膜的形成是其耐药性和致病性增强的关键因素[12]。目前发现沙门菌中主要存在9种 TCS,其中CpxAR系统是对多种革兰阴性细菌的致病性和耐药性有调控作用的 TCS 之一[13,14],而弄清CpxAR系统与沙门菌生物被膜形成之间的关系,对揭示沙门菌耐药性和致病性形成的调控机制至关重要。研究通过分析鼠伤寒沙门菌标准菌株和临床分离株在cpxR基因缺失前后的生物膜形成情况,发现鼠伤寒沙门菌标准菌株和临床分离株在cpxR基因缺失后,生物被膜形成能力明显降低。前期关于cpxR对鼠伤寒沙门菌致病性和耐药性调控作用的研究表明,cpxR基因缺失后鼠伤寒沙门菌对多种抗菌药物的敏感性增强[10],而其黏附和侵袭PK-15细胞能力下降[14,15]。联合研究结果知道,cpxR是沙门菌致病性、耐药性和生物被膜形成的核心调控元件,是极具潜力的抗菌作用靶点。细菌中不同TCS之间往往存在着复杂的交联作用,欲以CpxAR系统为靶点开发新型抗菌药物,还需深入探讨其中的调控网络,阐明CpxAR系统介导的生物被膜形成的分子机制。研究为进一步研究沙门菌生物被膜形成的调控机制探明了方向,为阐明沙门菌生物被膜形成的分子机制奠定了基础,也为将来更好的防控鼠伤寒沙门氏菌的暴发和流行提供了参考依据。
