黄芪甲苷对新生大鼠缺氧缺血性脑损伤NLRP3 炎性小体表达的影响
2021-04-19李娜穆亚平刘春英王阳李晓锋王雪薇
李娜 穆亚平 刘春英 王阳 李晓锋 王雪薇
(1.辽宁中医药大学中西医结合学院,辽宁沈阳 110847;2.沈阳市儿童医院神经康复实验室,辽宁沈阳 110032)
新生儿缺氧缺血性脑病(hypoxic-ischemic encephalopathy, HIE)是由围生期窒息引起的脑缺氧缺血性损害,是新生儿死亡和伤残的主要原因。除亚低温治疗外,诸如硫酸镁、促红细胞生成素、间充质干细胞移植等治疗方法尚未在临床广泛应用,而且存在争议[1-2]。在接受亚低温治疗的中、重度HIE 婴儿中,仍有近31.6%~51.4%的患者残障存活[3-5]。因此,有必要寻找新的安全有效的治疗方法来促进HIE 患儿神经系统康复。缺氧缺血性脑损伤(hypoxic-ischemic brain damage, HIBD)是HIE 的病理过程,缺氧缺血再灌注时中性粒细胞聚集、炎症介质释放增多,因此深入研究各种黏附因子和炎症介质的作用机制,及早发现拮抗措施,可能是预防和减轻HIBD 的途径之一。Nod样受体蛋白3(NLRP3)是一种多蛋白复合体,能够识别病原体相关模式分子和危险因素相关模式分子等信号,激活半胱氨酸蛋白酶-1(Caspase-1),活化的Caspase-1 能够剪切打孔Gasdermin D 蛋白(GSDMD),导致炎症因子白细胞介素(IL)-1β和IL-18 释放,从而诱导细胞焦亡[6]。NLRP3 和Caspase-1 与多种神经系统疾病有关,如缺血性中风、动脉粥样硬化斑块形成、阿尔茨海默病、帕金森病等[7-8]。Serdar 等[9]发现,HIBD 24 h 后,小胶质细胞活化和神经元损伤与NLRP3 炎性小体基因的表达上调有关。Ystgaard 等[10]的研究则提示新生小鼠脑缺氧缺血后24 h,NLRP3 在海马中表达上调2.6 倍,高于纹状体和丘脑,NLRP3 炎性小体信号通路激活与神经细胞死亡相关且不利于机体自身早期保护机制的启动。
黄芪甲苷(astragaloside IV, AS-IV)是黄芪的主要活性成分之一,是黄芪皂苷类的单体成分,可通过抑制炎症反应发挥神经保护作用[11]。研究显示,AS-IV 具有抗抑郁作用,其抗抑郁的作用是通过上调过氧化物酶体增殖物激活受体γ 的表达来抑制小鼠海马区NF-κB 磷酸化、降低NLRP3 炎症小体和IL-1β 的表达发挥作用[12]。Li 等[13]研究发现AS-IV 通过抑制NLRP3 信号通路,减轻脑缺血再灌注诱导的小鼠短暂性认知障碍。AS-IV 是一种潜在的神经保护剂,但其在新生儿HIBD 中的作用机制有待进一步研究。新生儿大脑在发生HIBD后其适应和再生能力有限,而海马齿状回的脑室下带和颗粒下层是神经发生的主要部位,因此关于中枢神经系统的信号通路的研究常集中在海马体结构上[14-15]。本实验通过建立乳鼠HIBD 模型及小鼠海马神经元HT22 细胞缺氧模型,观察AS-IV对NLRP3 炎性小体的干预作用,并初步探讨其治疗最佳干预浓度,旨在为临床治疗新生儿HIE 提供新的方法。
1 材料与方法
1.1 动物及细胞
Sprague-Dawley 雄 性2 日 龄 仔 鼠30 只 由 辽宁省长生生物技术股份有限公司提供[动物许可证号:SCXK(辽)2015-0001]。小鼠海马神经元HT22 细胞购自武汉普诺赛生命科技有限公司(货号CL-0595)。
1.2 主要试剂及耗材
AS-IV(含量>98%,20 mg)购自大连美仑生物技术有限公司(货号J0201AS),分子量为784.97 g/mol。DMEM 高糖培养基(SH30022.01,HyClone 公 司, 美 国 ),DMEM 无 糖 培 养 基(90113)、DMSO(D8371)购自北京索莱宝科技有限公司,yo-PRO-1(V23201)、EthD-2(E3599)购自美国Thermofisher 公司,β-actin(66009-1-Ig,Proteintech 公司,美国);磷酸盐缓冲液、胰酶、青链霉素、二抗均购自美国Gibco 公司;NLRP3、Caspase-1、IL-1β、GSDMD、CCK-8 一抗均购自英国Abcam 公司。
1.3 分组及模型建立
仔鼠养育至第7 日,SPF 级条件饲养。选择体重10~14 g 的7 日龄新生大鼠24 只,随机分为假手术组、HIBD 组和AS-IV 治疗组(AS-IV 组),每组均8 只。HIBD 组参照文献[16]造模:仔鼠用异氟醚麻醉后行右侧颈总动脉双重结扎。术后放置2 h,待仔鼠完全清醒后再置于37℃恒温密闭缺氧舱中,以 5 L/min 的流速向舱内输入8%O2+92%N2的混合气体,持续60 min 后取出;假手术组仅用眼科器械切开皮肤,钝性分离右侧颈总动脉,不予结扎,直接进行皮肤缝合。AS-IV 组在造模后,立即将AS-IV(10 mg/kg)溶于DMSO 液中(10 mL/kg),根据仔鼠体重进行计算后灌胃,每8 h 1 次,共记3 次。结束后将仔鼠放回母鼠笼中饲养,24 h 后异氟醚麻醉,行脑部组织取样。
1.4 脑组织苏木精-伊红染色
取造模后24 h 仔鼠,3%~4%异氟醚麻醉处死,取脑组织置于4%多聚甲醛中固定24 h,分级酒精脱水,石蜡包埋。脑组织石蜡块沿冠状面行5 μm厚度切片,然后行苏木精-伊红(HE)染色,莱卡DM4B 光学显微镜观察各组大鼠脑组织海马的病理变化。
1.5 AS-IV 对仔鼠脑组织细胞焦亡的影响
采用yo-PRO-1 和EthD-2 染色剂检测细胞焦亡[17-18]。取造模后24 h 仔鼠脑组织,用4%多聚甲醛固定脑组织48 h,冷冻切片法制作切片,脑组织切片厚度为5~10 μm。将脑组织切片置于载玻片上,暗室环境中PBS 液洗4 次,每次5 min;分别加入yo-PRO-1 和EthD-2 抗体(工作浓度均为1 : 1 000),室温孵育30 min,PBS 液洗4 次,每次5 min;最后加入DAPI 复染细胞核,暗室室温孵育20 min 后用抗荧光淬灭封片剂封片后于荧光显微镜下观察细胞焦亡的变化。
1.6 细胞缺氧模型构建与给药
小鼠海马神经元HT22 细胞用含10%胎牛血清的高糖DMEM 培养基在37℃、5%CO2细胞培养箱中培养,隔天换液。随机分为对照组、氧糖剥夺(OGD)组、OGD+AS-IV 组。对照组为常规培养(37℃、5%CO2)的HT22 细胞;海马神经元细胞OGD 模型建立[19]:弃去正常培养基,PBS 液清洗2 次,加无糖无血清DMEM 培养基,将细胞置于充满95%N2和5%CO2的厌氧袋中孵育2 h,2 h后取出细胞,弃去无糖无血清DMEM 培养基,换为正常培养基在37℃、5%CO2细胞培养箱中继续培养。
OGD+AS-IV 组 每 孔 加 入100 μL 2 000 个 细胞,按24 h 孵育时间标准,设置AS-IV 浓度梯度(50~400 μmol/L)来明确药物的最佳浓度。
AS-IV 配 制 方 法: 将AS-IV 溶 于2.548 mL DMSO 液中,先稀释成10 mmol/L 的储存溶液,然后用培养液稀释,使药物终浓度分别为50 μmol/L、100 μmol/L、200 μmol/L、400 μmol/L,每 个 浓 度重复6 个复孔。
1.7 CCK-8 法检测细胞活力
将HT22 细胞接种于96 孔板,分别在常规培养条件和缺氧条件下培养24 h,再加入不同浓度AS-IV,向每孔加入10 μL CCK-8 溶液,37℃孵育1 h,在450 nm 波长测定吸光度,检测缺氧条件下不同AS-IV 浓度对HT22 细胞活力的影响。实验独立重复3 次。
1.8 Western blot 检测相关蛋白的表达
处理后的各组细胞加入RIPA 细胞裂解液,在预制电泳胶中按照每孔10 μL 加入蛋白样品及marker,空白孔中补充10 μL 蛋白上样缓冲液,进行SDS-PAGE 凝胶电泳,电转移至PVDF 膜,TBST 缓冲液洗膜,3%脱脂奶粉封闭3 h,分别加入一抗NLRP3、Caspase-1、GSDMD(均为1 : 1 000稀释)、IL-1β(0.1 μg/mL),以β-actin(1 : 10 000稀释)为内参,4℃孵育过夜,洗膜后分别加入辣根过氧化物酶标记的山羊抗大鼠IgG(1 : 3 000)和山羊抗兔IgG(1 : 10 000)二抗孵育1 h,ECL 化学发光显色。以目的蛋白条带灰度值与β-actin 条带灰度值之比计算目的蛋白的相对表达量。实验独立重复3 次。
取仔鼠脑组织损伤侧海马组织进行匀浆并加入裂解液,Western blot 法检测AS-IV 对HIBD 新生大鼠海马组织中NLRP3、IL-1β、Caspase-1 及GSDMD 蛋白的影响,操作步骤同细胞实验。
1.9 RT-qPCR 法 检 测 细 胞 内GSDMD、NLRP3、IL-1β、Caspase-1 的mRNA 水平
收集各组细胞后使用TRIzol 法提取各组细胞总RNA,并测定浓度。使用One Step TB Green®PrimeScript™RT-PCR Kit试剂盒(日本TaKaRa公司)进行检测。PCR 反应体系(20 μL):2×Buffer 10 μL,Ex Taq HS 0.4 μL,enzyme Mix Ⅱ 0.4 μL,上下游引物各0.4 μL,ROX Reference Dye or Dye Ⅱ0.4 μL,Total RNA 2 μL,RNase Free dH2O 6 μL。PCR 反应条件:95℃ 5 s,60℃ 34 s,共40 个循环。结果采用2-ΔΔCT法计算mRNA 的相对表达量。引物序列由沈阳实创生物技术有限公司合成(表1)。实验独立重复3 次。
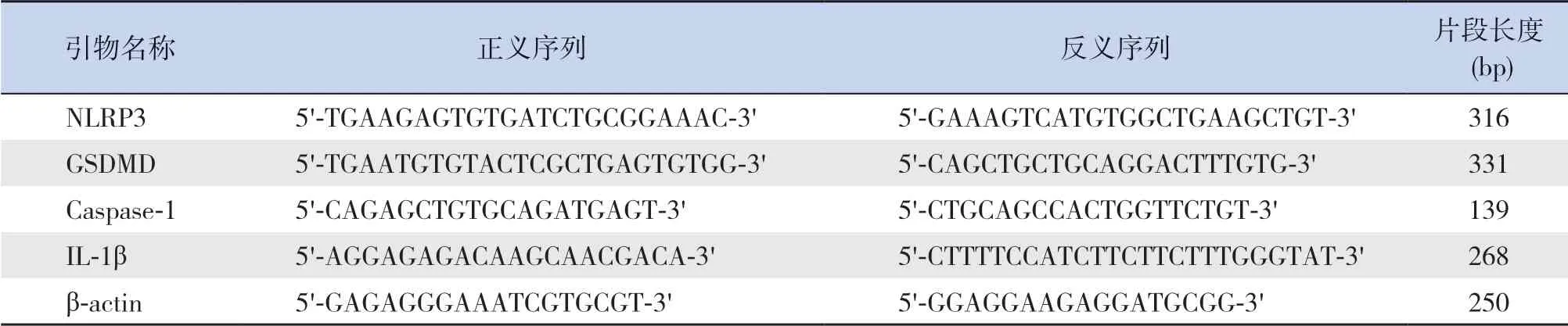
表1 RT-PCR 引物序列
1.10 统计学分析
采用 SPSS 24.0 统计软件对数据进行统计学分析,计量资料以均数±标准差(x±s)表示,多组间比较采用单因素方差分析,组间两两比较采用SNK-q检验,P<0.05 为差异有统计学意义。
2 结果
2.1 AS-IV 对HIBD 新生大鼠的影响
造模24 h 后脑组织HE 染色显示,与假手术组比较,HIBD 组海马区锥体细胞层细胞密度降低、排列松散、层次紊乱,部分细胞可见空泡样变性和典型急性缺血性红色神经元;AS-IV 组海马神经元细胞变性程度减轻,急性缺血性改变明显减少(图1)。
采用yo-PRO-1 和EthD-2 染色剂检测细胞焦亡,HIBD 组焦亡细胞(核内绿/蓝双阳性,青色为主)明显增多,同时可见少量坏死细胞(阳性细胞核内呈红色);AS-IV 组则显示焦亡细胞和坏死细胞均明显减少。见图2。
2.2 AS-IV 对乳鼠焦亡相关蛋白NLRP3、IL-1β、Caspase-1 及GSDMD 表达水平的影响
与假手术组比较,HIBD 组脑组织NLRP3、IL-1β、Caspase-1 及GSDMD 表 达 水 平 明 显 升 高(P<0.05);AS-IV 组 脑 组 织NLRP3、Caspase-1及GSDMD 表达水平显著低于HIBD 组(P<0.05),且与假手术组比较差异无统计学意义(P>0.05);AS-IV 组脑组织IL-1β 表达水平与HIBD 组比较差异无统计学意义(P>0.05),且仍高于假手术组(P<0.05)。见表2 和图3。
2.3 不同浓度AS-IV 对缺氧处理后HT22 细胞活力的影响
CCK-8 实验结果显示,HT22 细胞OGD 模型建立后,细胞活力较对照组明显下降(P<0.05);与OGD 组比较,缺氧处理后的HT22 细胞应用100~400 μmol/L AS-IV 干预后,HT22 细胞活力均升高(P<0.05);AS-IV 药物浓度在200 μmol/L 时能明显减轻缺氧损害,与OGD 组比较,细胞活力升高最明显。见表3。
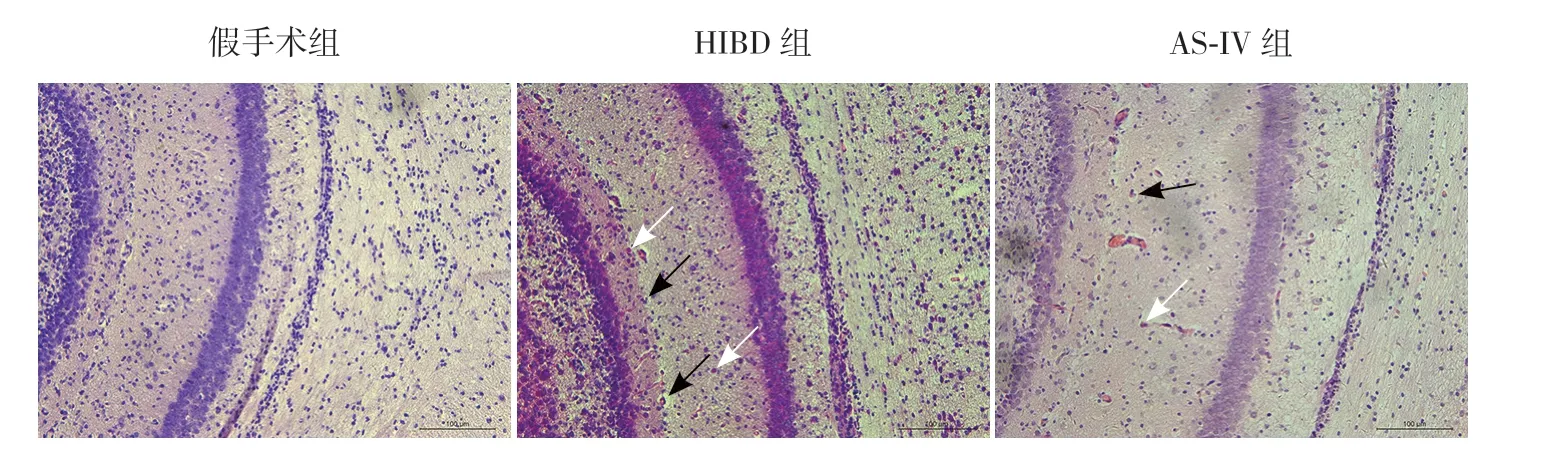
图1 AS-IV 对HIBD 新生大鼠脑组织的影响(苏木精-伊红染色,×200) 与假手术组比较,HIBD 组细胞排列层次紊乱,可见典型急性缺血性红色神经元及细胞空泡样改变;AS-IV 治疗后,急性缺血性红色神经元明显减少,细胞空泡样变性程度降低。白色箭头示缺血性神经元,表现为细胞核固缩,红染;黑色箭头示细胞空泡样改变。
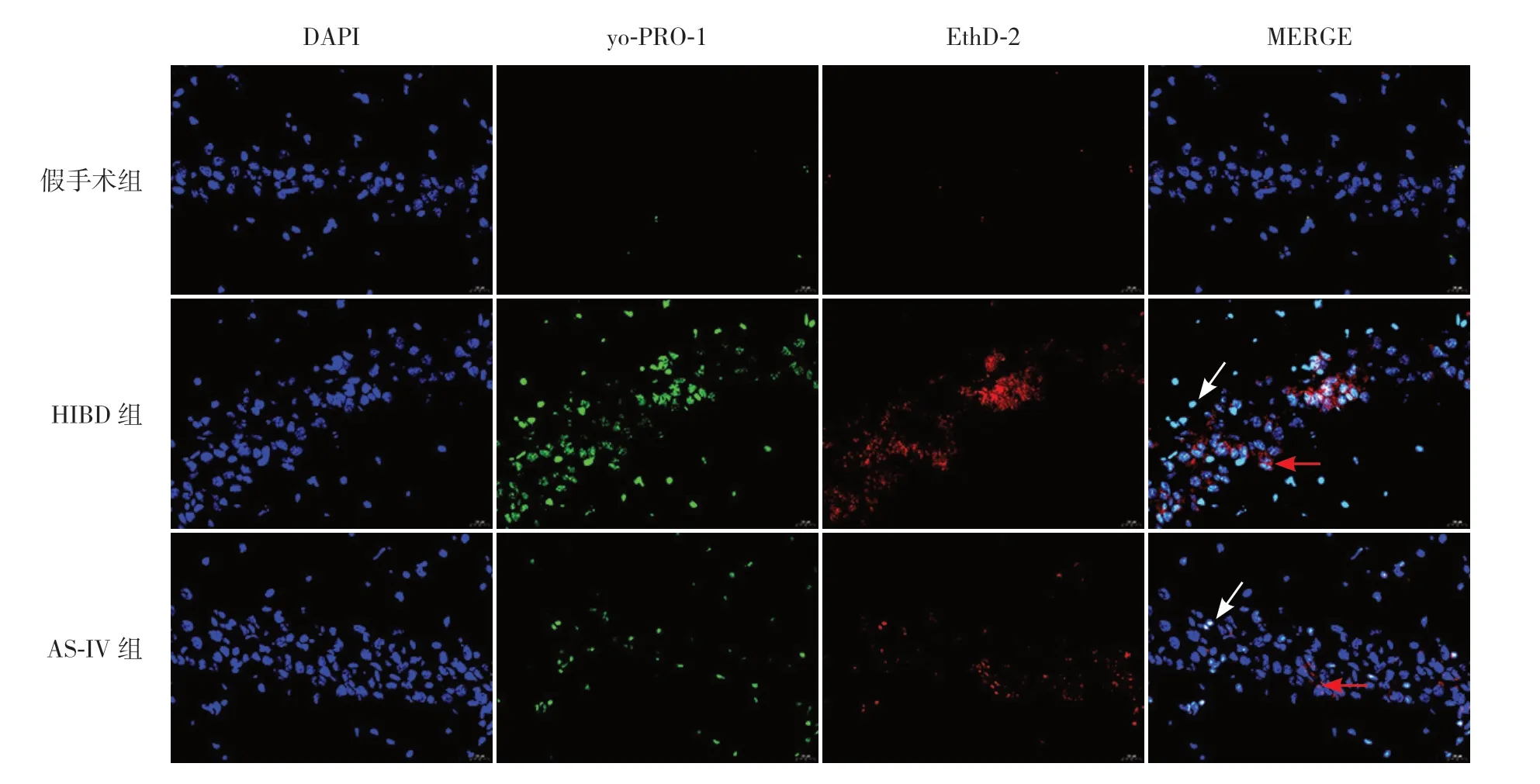
图2 AS-IV 对HIBD 新生大鼠细胞焦亡的影响(免疫荧光,×100) 与假手术组比较,HIBD 组焦亡细胞(核内绿/蓝双阳性,青色为主)明显增多,同时可见少量坏死细胞(阳性细胞核内呈红色)。白色箭头示焦亡细胞,红色箭头示坏死细胞。
表2 各组脑组织中NLRP3、IL-1β、Caspase-1 及GSDMD 蛋白检测结果比较 (n=8)
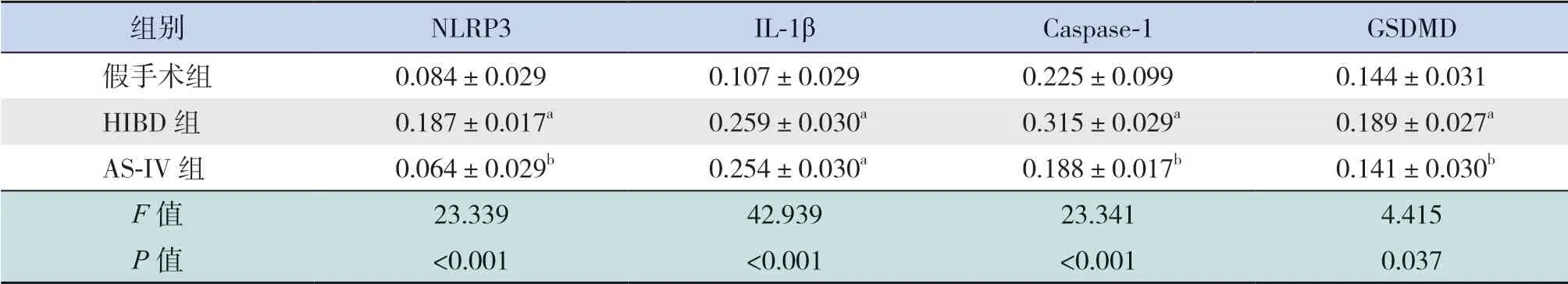
表2 各组脑组织中NLRP3、IL-1β、Caspase-1 及GSDMD 蛋白检测结果比较 (n=8)
注:[NLRP3] Nod 样受体蛋白3;[IL-1β]白细胞介素-1β;[Caspase-1]半胱氨酸蛋白酶-1;[GSDMD] Gasdermin D 蛋白。a 示与假手术组比较,P<0.05;b 示与HIBD 组比较,P<0.05。
组别 NLRP3 IL-1β Caspase-1 GSDMD假手术组 0.084±0.029 0.107±0.029 0.225±0.099 0.144±0.031 HIBD 组 0.187±0.017a 0.259±0.030a 0.315±0.029a 0.189±0.027a AS-IV 组 0.064±0.029b 0.254±0.030a 0.188±0.017b 0.141±0.030b F 值 23.339 42.939 23.341 4.415 P 值 <0.001 <0.001 <0.001 0.037
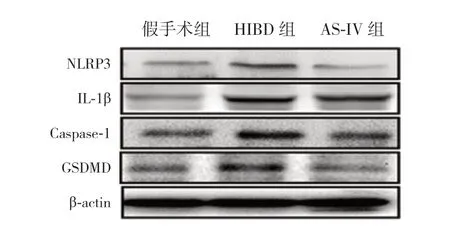
图3 Western blot 法检测各组新生大鼠海马组织中NLRP3、IL-1β、Caspase-1 及GSDMD 蛋白的表达
2.4 不同浓度AS-IV 对细胞焦亡相关蛋白表达的影响
Western blot 检测结果显示,与对照组比较,OGD 组 NLRP3、IL-1β、Caspase-1 和GSDMD 蛋白表达水平均上升(P<0.05);与OGD 组比较,应 用50~400 μmol/L 4 个 浓 度AS-IV 干 预OGD 细胞 后,NLRP3、IL-1β、Caspase-1 和GSDMD 蛋 白表达水平均下降(P<0.05);NLRP3、GSDMD、IL-1β、Caspase-1 蛋 白 表 达 水 平 在200 μmol/L 和400 μmol/L 两个浓度组间比较差异均无统计学意义(P>0.05)。见图4 和表4。
2.5 不 同 浓 度AS-IV 对NLRP3、GSDMD、Caspase-1、IL-1β mRNA 水平的影响
不同浓度AS-IV 干预HT22 缺氧细胞后,应用RT-qPCR 法检测NLRP3、GSDMD、Caspase-1、IL-1β 的mRNA 水 平。与 对 照 组 比 较,OGD 组NLRP3、IL-1β、Caspase-1 和GSDMD 的mRNA 表达水平均上升(P<0.05);与OGD 组比较,应用50~400 μmol/L 4 个浓度AS-IV 干预OGD 细胞后,NLRP3、GSDMD、Caspase-1、IL-1β 的mRNA 表达水平均明显下降(P<0.05);与200 μmol/L 比较,其他浓度AS-IV 干预后NLRP3、GSDMD、Caspase-1、IL-1β mRNA 表 达 水 平 均 有 所 上 升(P<0.05),提示200 μmol/L AS-IV干预OGD细胞时,上述炎性小体和细胞因子下降最明显。见表5。
表3 不同浓度AS-IV 对缺氧HT22 细胞活力的影响(,%,n=8)
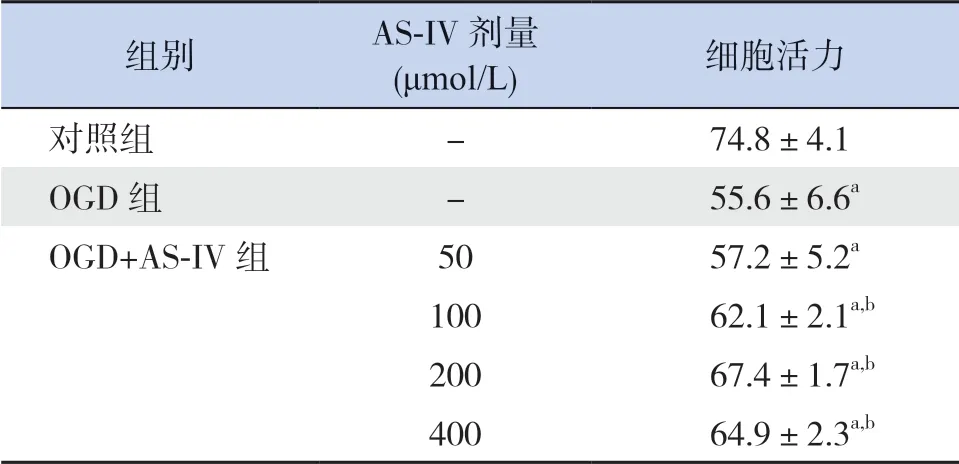
表3 不同浓度AS-IV 对缺氧HT22 细胞活力的影响(,%,n=8)
注:a 示与对照组比较,P<0.05;b 示与OGD 组比较,P<0.05。
组别 AS-IV 剂量(μmol/L) 细胞活力对照组 - 74.8±4.1 OGD 组 - 55.6±6.6a OGD+AS-IV 组 50 57.2±5.2a 100 62.1±2.1a,b 200 67.4±1.7a,b 400 64.9±2.3a,b
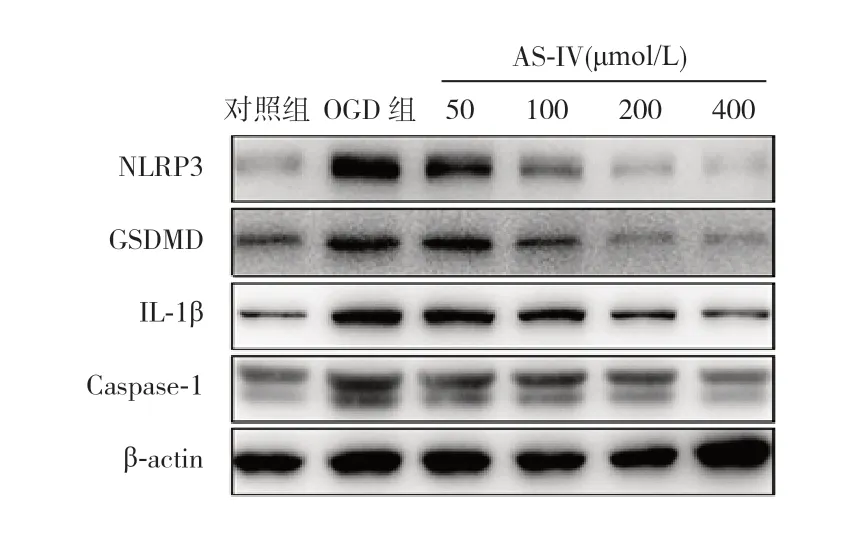
图4 Western blot 法检测不同浓度AS-IV 对各组HT22 细 胞 中NLRP3、IL-1β、Caspase-1 及GSDMD 蛋白的影响
表4 各组HT22 细胞NLRP3、IL-1β、Caspase-1 及GSDMD 蛋白检测结果比较 (,n=3)
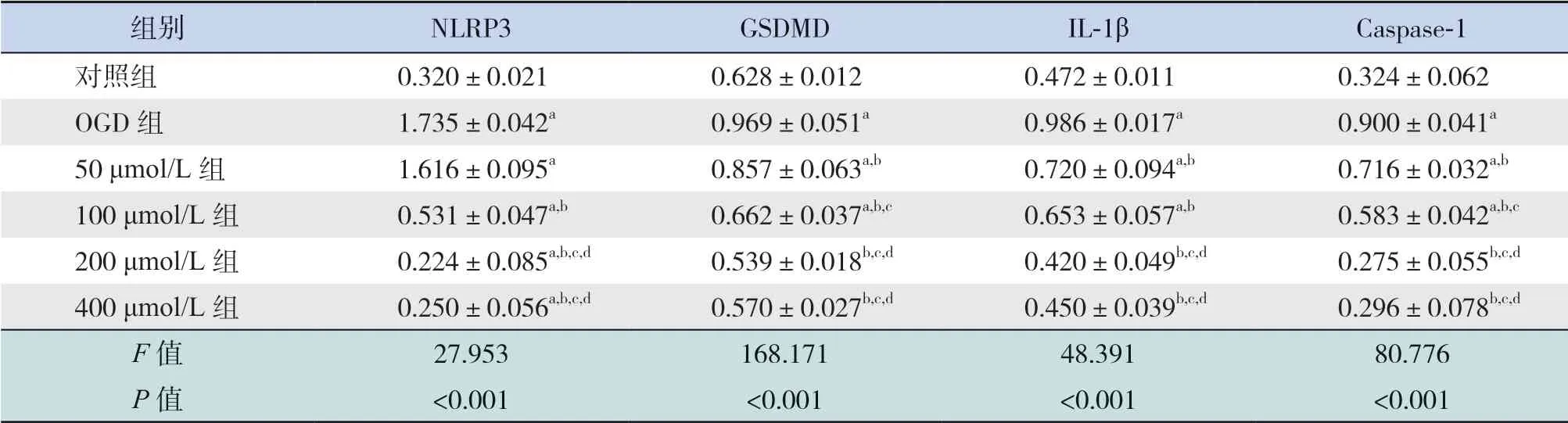
表4 各组HT22 细胞NLRP3、IL-1β、Caspase-1 及GSDMD 蛋白检测结果比较 (,n=3)
注:[NLRP3] Nod 样受体蛋白3;[GSDMD] Gasdermin D 蛋白;[IL-1β]白细胞介素-1β;[Caspase-1]半胱氨酸蛋白酶-1。a 示与对照组比较,P<0.05;b 示与OGD 组比较,P<0.05;c 示与50 μmol/L 组比较,P<0.05;d 示与100 μmol/L 组比较,P<0.05。
组别 NLRP3 GSDMD IL-1β Caspase-1对照组 0.320±0.021 0.628±0.012 0.472±0.011 0.324±0.062 OGD 组 1.735±0.042a 0.969±0.051a 0.986±0.017a 0.900±0.041a 50 μmol/L 组 1.616±0.095a 0.857±0.063a,b 0.720±0.094a,b 0.716±0.032a,b 100 μmol/L 组 0.531±0.047a,b 0.662±0.037a,b,c 0.653±0.057a,b 0.583±0.042a,b,c 200 μmol/L 组 0.224±0.085a,b,c,d 0.539±0.018b,c,d 0.420±0.049b,c,d 0.275±0.055b,c,d 400 μmol/L 组 0.250±0.056a,b,c,d 0.570±0.027b,c,d 0.450±0.039b,c,d 0.296±0.078b,c,d F 值 27.953 168.171 48.391 80.776 P 值 <0.001 <0.001 <0.001 <0.001
表5 各组HT22 细胞NLRP3、IL-1β、Caspase-1 及GSDMD 的mRNA 检测结果比较 (,n=3)
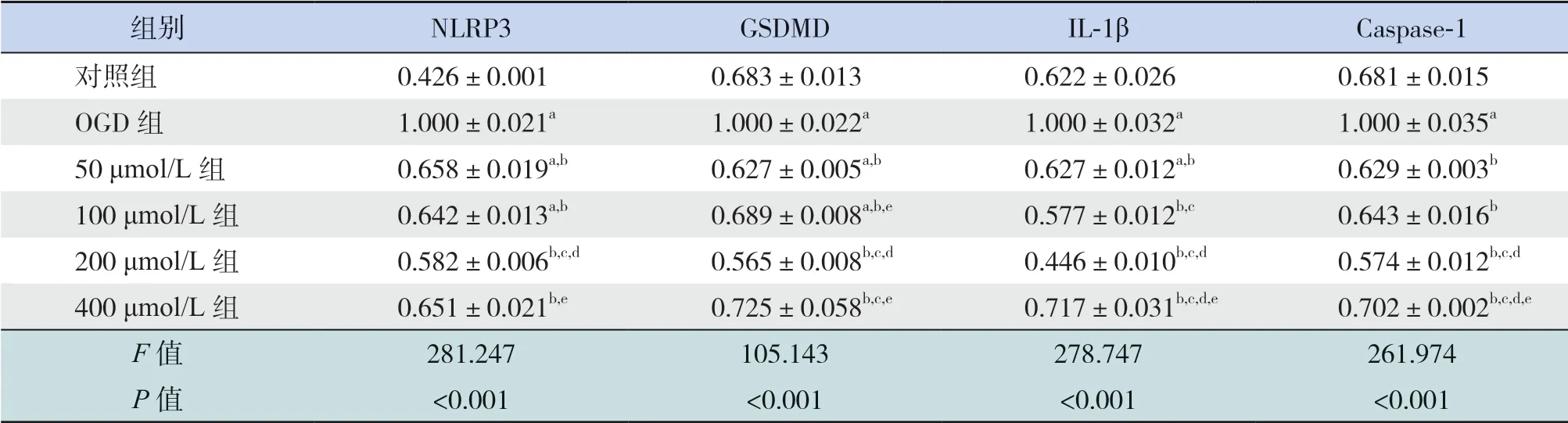
表5 各组HT22 细胞NLRP3、IL-1β、Caspase-1 及GSDMD 的mRNA 检测结果比较 (,n=3)
注:[NLRP3] Nod 样受体蛋白3;[GSDMD] Gasdermin D 蛋白;[IL-1β]白细胞介素-1β;[Caspase-1]半胱氨酸蛋白酶-1。a 示与对照组比较,P<0.05;b 示与OGD 组比较,P<0.05;c 示与50 μmol/L 组比较,P<0.05;d 示与100 μmol/L 组比较,P<0.05,e 示与200 μmol/L 组比较,P<0.05。
组别 NLRP3 GSDMD IL-1β Caspase-1对照组 0.426±0.001 0.683±0.013 0.622±0.026 0.681±0.015 OGD 组 1.000±0.021a 1.000±0.022a 1.000±0.032a 1.000±0.035a 50 μmol/L 组 0.658±0.019a,b 0.627±0.005a,b 0.627±0.012a,b 0.629±0.003b 100 μmol/L 组 0.642±0.013a,b 0.689±0.008a,b,e 0.577±0.012b,c 0.643±0.016b 200 μmol/L 组 0.582±0.006b,c,d 0.565±0.008b,c,d 0.446±0.010b,c,d 0.574±0.012b,c,d 400 μmol/L 组 0.651±0.021b,e 0.725±0.058b,c,e 0.717±0.031b,c,d,e 0.702±0.002b,c,d,e F 值 281.247 105.143 278.747 261.974 P 值 <0.001 <0.001 <0.001 <0.001
3 讨论
HIE 是导致足月儿死亡和儿童期残疾的主要原因。随着现代医疗技术的发展,HIE 的神经保护策略、神经康复技术及相关基础研究均取得了较大进步,但目前HIE 的治疗仍以稳定内环境为目的的支持疗法为主,尚无理想的治疗方法[20]。AS-IV是黄芪的主要成分,具有抗神经炎症、抑制细胞凋亡、促进血管神经修复等多重效应。Wang 等[21]系统评估了AS-IV 对实验性急性缺血性卒中的有效性和可能的机制后认为AS-IV 在脑缺血再灌注损伤过程中可能通过抗氧化、抗炎、抗凋亡等作用发挥神经保护作用。近年来已有临床医生应用黄芪注射液治疗HIE、脑性瘫痪等疾病且取得较好的临床效果[22-23],但这类治疗均处于临床摸索状态,其治疗HIE 的具体分子机制需要更深入的研究。
神经炎症是中枢神经系统的一种基本的先天免疫反应,被认为是神经系统疾病的致病因素之一。缺氧缺血引起血管内炎症级联反应是新生儿脑损伤病理生理学的重要因素。然而,免疫激活特别是适应性免疫反应对HIBD 的长期影响仍不清楚[24-25]。NLRP3 在实现适应性免疫应答的同时及时关闭固有免疫反应,因此防止炎性小体过度激活对控制炎症级联反应尤为重要。抑制NLRP3 炎性小体活性可能成为治疗脑外伤、神经退行性疾病等中枢神经系统疾病一种潜在而有效的治疗策略[26-27]。唐标等[28]认为AS-IV 可以减轻大鼠脑缺血再灌注损伤,并抑制NF-κB 磷酸化及NLRP3 炎症小体活化。
本研究发现,HIBD 组乳鼠脑组织海马区锥体细胞层细胞密度降低、层次紊乱,部分细胞可见空泡样变性和典型红色神经元改变,部分神经元出现急性坏死。细胞焦亡是近年新发现的细胞死亡形式,目前已有学者将焦亡作为治疗放射性脑损伤、HIBD 等神经系统疾病的一个潜在治疗靶点[29-30]。为了更深入探讨HIE 后是否存在焦亡现象,本实验采用yo-PRO-1 和EthD-2 两种不同分子量染色剂检测细胞焦亡。yo-PRO-1 是一种细胞膜封闭的阳离子,可以检测细胞膜通透性变化[18];而EthD-2 由于分子量较大,不能透过焦亡细胞的膜孔,但是可以穿透坏死细胞的细胞膜。作为附加优势,EthD-2 在激活后的单核细胞内不会与其他颜色荧光染色剂共存。本研究发现新生大鼠HIBD 后坏死细胞应用EthD-2 染色后未与yo-PRO-1 和DAPI 共存,考虑与HIBD 后激活单核细胞导致炎症介质Caspase-1、IL-1β 的释放增多有关,此与文献报道相符[17]。本实验通过yo-PRO-1和EthD-2 双染初步证实了HIE 存在焦亡现象,且应用AS-IV 预处理可减少焦亡的发生。为了深入探讨新生大鼠HIBD 后机体内焦亡的发生情况和后期AS-IV 预处理对焦亡的调控情况,本次实验还研究了焦亡相关蛋白NLRP3、Caspase-1、IL-1β、GSDMD 的表达情况。炎性Caspase 的底物GSDMD蛋白是介导细胞焦亡的关键“杀手蛋白”,它是细胞焦亡的直接和最终参与者[31]。GSDMD 可靶向作用于细胞膜并且诱导在质膜中形成大的渗透性孔,因此GSDMD 被认为是形成细胞焦亡孔的候选者[32]。本研究应用AS-IV 治疗后,发现AS-IV 能明显下调GSDMD 表达。HIBD 组乳鼠损伤侧脑组织中NLRP3、Caspase-1、IL-1β 蛋白表达水平均明显升高,提示HIBD 后,大鼠脑组织存在焦亡现象,应用AS-IV 治疗后NLRP3、Caspase-1 表达减少,而IL-1β 干预前后无明显变化考虑与蛋白表达延迟相关,有待进一步扩大样本,扩大观察时间点进一步论证。
中枢神经系统的通路通常集中在海马,HT22细胞来源于永生化的小鼠海马细胞系HT-4,非常适合于体外缺氧应激研究[33]。我们在动物实验研究的基础上,应用CCK-8 法检测AS-IV 对缺氧损伤的HT22 细胞活力的影响,结果显示缺氧处理后的HT22 细胞活力较对照组明显下降,AS-IV(100~400 μmol/L)能提高OGD 组的细胞存活率,且200 μmol/L AS-IV 干预效果最好。为进一步明确AS-IV 对NLRP3 炎性小体表达的影响,我们同时检测了不同浓度AS-IV 对HT22 细胞缺氧后焦亡相 关 因 子NLRP3、Caspase-1、IL-1β、GSDMD 的蛋白水平及mRNA 表达水平的影响。结果显示应用AS-IV 干预后,NLRP3 表达较OGD 组下降,其下游因子GSDMD、Caspase-1 和IL-1β 均明显下调。这些结果均说明了AS-IV 对缺氧损伤的海马神经元细胞具有一定的保护作用。
综上所述,本研究初步证实了AS-IV 对新生大鼠HIBD 的神经保护作用。AS-IV 可以通过降低脑缺氧缺血后NLRP3 炎性小体的表达起到神经保护作用,具有一定的临床应用前景。
